基于GC-MS的野生和‘鲁赫’刺蔷薇叶片代谢差异研究
吴 艳 李 赛 吴可心 穆立蔷
(东北林业大学林学院,哈尔滨 50040)
刺蔷薇(Rosa acicularis)为蔷薇科(Rosaceae)蔷薇属(Rosa)植物,是典型的野生资源植物,主要生长在中国东北、西北、华北等地区[1],是优质的医用与药用植物[2-3]。刺蔷薇果实中维生素C 和超氧化物歧化酶含量极高[4],且风味物质丰富多样[5],是具有较好开发前景的野果资源。刺蔷薇花可提取挥发油(花精油)[6]。刺蔷薇叶片富含单宁,可提制栲胶[1];同时含有丰富的黄酮和多酚类抗氧化物质[7]。‘鲁赫’刺蔷薇(R. acicularis‘Luhe’)是俄罗斯从野生刺蔷薇中选育出的一个品种,我国经西伯利亚引进。相比于野生刺蔷薇,其在观赏性[8]、抗盐碱胁迫[9]、花精油得率[6]等方面表现更好,但其抗胁迫性尚不能完全适应高寒或高盐碱地区[10]。
代谢组学(Metabonomics)是继基因组学、转录组学和蛋白质组学后又一新兴的组学方法[11]。该方法通过高通量检测和数据处理对代谢物组群指标进行分析,对生物代谢物质信息进行建模与系统整合,对研究对象进行代谢产物定性定量的分析,进而探究生物体的代谢过程和变化机制[12]。但生物体内代谢途径和产物众多且复杂,仅植物的代谢产物就有20 万~100 万种[13]。代谢组学方法目前广泛应用于植物学研究中。其中GC-MS(气相色谱-质谱联用)是一种灵敏度高、分离效果好、较为成熟的代谢组学检测方法,且有多个大型公共数据库用以检测和匹配代谢物数据[14]。
叶片是植物重要营养器官叶的主要组成部分,是植物体光合作用和很多生理活动的主要承担者,叶片的代谢物数据可以反映整个植物种类的生理特性。目前有关刺蔷薇叶片的研究多以提取精油及其抗氧化能力为主[15],暂缺乏有关叶片的代谢研究。本研究旨在通过GC-MS 代谢组学方法,探究野生刺蔷薇和‘鲁赫’刺蔷薇的叶片代谢差异,分析和总结野生与人工栽培的2 种刺蔷薇的叶片代谢差异,为刺蔷薇种质资源评价提供依据。
1 材料与方法
1.1 材料来源
野生刺蔷薇和‘鲁赫’刺蔷薇叶片于2019 年9月分别取自黑龙江省伊春市汤旺河和哈尔滨市东北林业大学植物园,均经东北林业大学穆立蔷教授鉴定。选取长势良好且高度相近的植株,剪切无病虫害侵染、品相良好的成熟叶片若干,冰袋保存,每种样品准备3个生物学重复。所有样品用去离子水洗净,滤纸吸干,备用[16]。
1.2 样品制备
精密称取90 mg 叶片,置入2 mL 离心管;加入2 粒小瓷珠和540 μL 的含内标(L-2-氯-苯丙氨酸,0.3 mg·mL-1)甲醇,超低温冷却(-80 ℃,2 min);放入研磨机中研磨(40 Hz,2 min),研磨彻底后超声提取30 min(100 W);加入300 μL的氯仿,漩涡震荡(20 Hz,2 min);加入600 μL的去离子水,重新漩涡震荡;超声提取30 min,低温离心(14 000 r·min-1,4 ℃,10 min);取700 μL 的上层溶液,导入新的2 mL离心管中,真空离心并浓缩挥干;向试管中加入400 μL 的甲氧胺盐酸吡啶溶液(15 mg·mL-1),漩涡震荡(20 Hz,2 min),将试管置入震荡培养箱(37 ℃,90 min);取出试管后加入400 μL的BSTFA(含1%的TMCS)和60 μL 的正己烷,漩涡震荡(20 Hz,2 min),水浴(70 ℃,60 min);取出样本,室温放置30 min,移入GC-MS样本小瓶[17]。
1.3 GC-MS进样条件
使用Agilent 7890A 自动进样器进样至Agilent 7890B 色谱仪(均为美国安捷伦公司)和5977B 质谱仪,经非极性DB-5 毛细管色谱柱(30 m×250 μm I.D.,美国加州Folsom 公司)分离后进入Agilent 5977B 质谱仪,进样口温度260 ℃,He 气纯度99.999%,流速1.0 mL·min-1,分流比1/10;升温程序为60~125 ℃(8 ℃·min-1)到125~210 ℃(4 ℃·min-1)到210~270℃(5 ℃·min-1)到270~305 ℃(10 ℃·min-1);终温305 ℃,保持3 min;EI 源电压-70 V,温度260 ℃;质量扫描范围50~600 m·z-1,采集延迟5 min,采集速率为每秒20个光谱[18]。
1.4 数据处理与分析
使用R 语言XCMS 数据包对原始数据进行降噪、过滤、峰提取、基线矫正、解卷积、峰积分、峰对齐、文库匹配等预处理[19],使用Excel 2019 进行峰面积归一化法处理和对数转换,使用SIMCA 14.1进行主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA),使用SPSS 25 进行t检验,登录KEGG 官网(https://www.kegg.jp/)查询差异代谢物ID 代号,将其代入MBRole 2.0(http://csbg.cnb.csic.es/mbrole2/)分析差异代谢通路,使用R 语言进行层次聚类分析和富集代谢气泡图的绘制。
2 结果与分析
2.1 两种刺蔷薇叶片代谢物总体差异
经GC-MS 非靶向代谢组学[20]对2 种刺蔷薇叶片进行的代谢组学分析,共匹配出51种代谢物,包括6种氨基酸、12种糖类、4种烷烃类化合物、17种有机酸(不包含氨基酸)、5 种酯类和7 种其他类化合物(见表1)。使用峰面积归一化法得出各代谢物的相对含量。

表1 两种刺蔷薇叶片的代谢物成分Table 1 Elements of metabolites of leaves from 2 R.acicularis
由于植物叶片含有的代谢物多为沸点较高的非挥发性物质,须将其进行衍生化处理才能进入气相色谱仪检测[21]。本试验使用的三氟乙酰胺衍生化试剂(BSTFA)含1% 的三甲基氯硅烷(TMCS),原始数据中检测到的化合物主要为硅烷化后的衍生物[22],对各代谢物峰面积归一化的计算应去掉衍生化所带来的-SiH2-亚甲硅基,才能得出较为准确的峰面积数据。计算的公式如下:
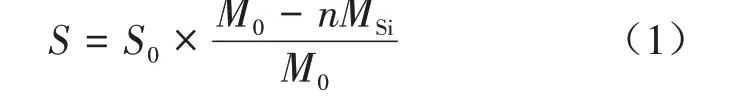
式中:S为代谢物新峰面积,S0为原始数据中的峰面积,M0为衍生化产物的分子质量,n为衍生化增添的Si 原子数量(代谢物原本含Si 原子的不计入),MSi为-SiH2的分子质量(取s30.10)。
2.2 总代谢物PCA分析
对2 种刺蔷薇叶片的GC-MS 代谢物总数据进行主成分分析(PCA),在95%的置信区间内可得R2X=0.751 497,R2X>0.5(见图1),说明根据试验数据建立的PCA 模型稳定,可以用于结果解释以及后续的处理。从结果图中可知,‘鲁赫’刺蔷薇叶片和野生刺蔷薇叶片的PCA 模型坐标分别分布于y轴两侧且分布较为均匀,初步证明二者的代谢物存在明显的不同,且同种间差异较小,可对其进行进一步的差异代谢物研究。

图1 两种刺蔷薇叶片总代谢物PCA分析Fig.1 PCA analysis of total metabolites in leaves of two kinds of R.acicularis
2.3 总代谢物OPLS-DA分析
对2 种刺蔷薇叶片的GC-MS 代谢物总数据进行正交偏最小二乘分析(OPLS-DA),可得R2X=0.966 663,Q2=0.920 560,R2X和Q2均>0.5,且R2X>Q2,二者相差极小且接近1,初步说明该模型较为有效可行。绘制2 种刺蔷薇叶片代谢物的OPLSDA的3D图,由图2可知,2组数据的模型分别位于x=0,y=0 平面两侧,且各自较为聚集,可以有效说明二者间代谢差异较为明显且同种间差异较小,建立的OPLS-DA模型较为符合预期。

图2 两种刺蔷薇叶片总代谢物OPLS-DA的3D图Fig.2 3D diagram of total metabolite OPLS-DA in leaves of two kinds of R.acicularis
为防止OPLS-DA 模型出现过拟合,对其进行20次的置换检验,可知R2X总是大于Q2,说明建立的模型未出现过拟合现象,结果较为可靠(见图3)。
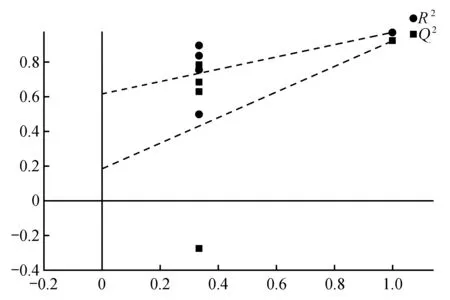
图3 两种刺蔷薇叶片总代谢物OPLS-DA的置换检验Fig.3 Displacement test of OPLS-DA of two total metabolites in leaves of two kinds of R.acicularis
2.4 差异代谢物的筛选和分析
选择OPLS-DA模型中变量投影重要性分析值(VIP)>1 的代谢物数据,使用SPSS 25 对其进行t检验,筛选出P<0.05 的数据,确定为2 种刺蔷薇叶片的显著差异代谢物。对各项代谢物的差异倍数值(FC 值)进行以2 为底数的对数换算,以野生刺蔷薇叶片为基准,log2FC<0表示上调,反之则表示下调。
根据表2 可知,筛选出2 种刺蔷薇叶片的显著差异代谢物共19 种,以野生刺蔷薇叶片为基准,‘鲁赫’刺蔷薇叶片代谢物中糖类中的β-龙胆二糖、阿拉伯呋喃糖和麦芽糖,有机酸类中的2,3,4-三羟基丁酸、没食子酸、乳酸、苹果酸和硬脂酸,烷烃类中的3,8-二甲基-十一烷,其他类中的乙醇胺、乙基-α-D-吡喃葡萄糖苷和甘油表达为下调;有机酸中的4-氨基丁酸、绿原酸、4-羟基苯甲酸和莽草酸,氨基酸中的L-丙氨酸和缬氨酸,其他类中的双酚A 单甲醚表达为上调。对2 种刺蔷薇叶片的差异代谢物相对含量数值矩阵进行欧式距离矩阵计算,以完全连锁方法进行聚类分析(见图4),大致上可将差异代谢物分成分为4 类:第1 类为4-羟基苯甲酸、双酚A 单甲醚、4-氨基丁酸、绿原酸、L-丙氨酸和莽草酸;第2类为没食子酸、乳酸、2,3,4-三羟基丁酸、阿拉伯呋喃糖、甘油和苹果酸;第3类为硬脂酸、乙基-α-D-吡喃葡萄糖苷和麦芽糖;第4类为缬氨酸、乙醇胺、β-龙胆二糖和3,8-二甲基-十一烷。其中第1 类全部为有机酸(含氨基酸),第2类以有机酸(含缬氨酸)为主,第3 类以糖(苷)为主,第4类则成分较为复杂,各类代谢物均含有。

图4 两种刺蔷薇叶片的差异代谢物的层次聚类分析热图Fig.4 Hierarchical cluster analysis of differential metabolites in leaves of two kinds of R.acicularis

表2 两种刺蔷薇叶片的差异代谢物的筛选结果Table 2 Screening results of differential metabolites in leaves of 2 R.acicularis
由以上结果可知,相较于‘鲁赫’刺蔷薇,野生刺蔷薇叶片主要在糖类和糖苷类物质代谢表达上调,在2,3,4-三羟基丁酸、没食子酸、乳酸、苹果酸和硬脂酸4种有机酸代谢表达上调,在其他有机酸类物质和氨基酸代谢表达下调。野生刺蔷薇叶片在糖(苷)类的相对含量上优于‘鲁赫’刺蔷薇,而‘鲁赫’刺蔷薇的抗胁迫物质(有机酸、氨基酸)相对含量更高。
2.5 差异代谢通路分析
将19种差异代谢物英文名称代入KEGG 官网查询ID,将ID 序列代入MBRole 2.0 得出差异代谢通路名称和组分数据,使用R 语言绘制富集气泡图,选择impact 值(气泡面积)较大和-log10(P-val⁃ue)(颜色鲜艳程度)较大的代谢通路,作为2 种刺蔷薇叶片的主要差异代谢通路(见图5)。由富集气泡图可得出二者主要的差异代谢通路有5条,分别是ABC 转运蛋白通路、苯丙烷的生物合成途径、苯甲酸的辅酶A 降解途径、苯甲酸的羟基化降解途径和丙氨酸、天冬氨酸和谷氨酸代谢途径。另有奎宁酸未被KEGG 收录ID,将在讨论中单独列出。
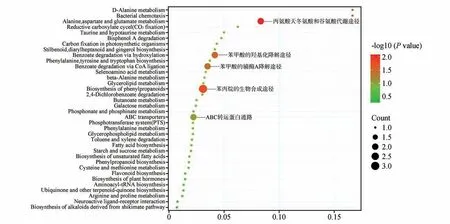
图5 两种刺蔷薇叶片的代谢通路富集气泡图Fig.5 Enrichment bubble diagram of metabolic pathway in leaves of two kinds of R.acicularis
由差异代谢通路分析可得,‘鲁赫’刺蔷薇和野生刺蔷薇的叶片主要在ABC 转运蛋白、苯丙烷的生物合成、苯甲酸的降解和丙氨酸、天冬氨酸和谷氨酸代谢这4个方面有显著的代谢差异。
3 讨论
为探究刺蔷薇的野外条件下的野生种和人工栽培的人工选育栽培种(‘鲁赫’刺蔷薇)的叶片代谢差异,对野生和‘鲁赫’刺蔷薇的叶片进行的非靶向GC-MS 代谢组学分析共检测和匹配出51 种代谢物,PCA 和OPLS-DA 模型可靠,其中利用OPLS-DA 模型共筛选出19种代谢物作为2 种刺蔷薇叶片的代谢差异物。以野生刺蔷薇作对照,‘鲁赫’刺蔷薇共有4种糖(苷)类、3,8-二甲基-十一烷、乙醇胺、甘油和少量有机酸表达下调,4种有机酸、2种氨基酸和双酚A 单甲醚表达上调。糖类物质作为光合作用的最终产物,是植物体内主要的能量和碳骨架来源[23]。在野外条件下,野生刺蔷薇叶片的糖类相对含量较高,其光合作用效率可能较‘鲁赫’刺蔷薇高,但由于二者变量不单一(取材地海拔气候有一定差别),可在今后的研究中补充叶片净光合速率对比试验。部分氨基酸和有机酸是植物的次生代谢产物或重要前体[24-25],本试验中的‘鲁赫’刺蔷薇在人工栽培条件下,部分有机酸类(2,3,4-三羟基丁酸、没食子酸、乳酸、苹果酸、麦芽糖、硬脂酸、4-氨基丁酸、4-羟基苯甲酸、绿原酸、L-丙氨酸、奎宁酸、莽草酸、缬氨酸)代谢表达和野生刺蔷薇出现差异,说明二者在有机酸类相关次生代谢方面因基因[26]和环境因子[27-28]出现表达差异。
2 种刺蔷薇叶片的显著差异代谢通路有5 条,主要表现在ABC 转运蛋白、苯丙烷的生物合成、苯甲酸的降解和部分氨基酸的代谢这4 个方面。ABC 转运蛋白是一大类跨膜蛋白,植物ABC 转运蛋白含量高达上百种,与其复杂的代谢活动密切相关,在植物表面蜡质分泌、调节重金属含量、次生代谢物运输等方面发挥着极其重要的功能[29]。苯丙烷的生物合成途径是大多数植物次生代谢物的主要来源之一[30],对植物的生长发育及应答逆境胁迫起到重要作用[31]。苯甲酸是植物的自毒作用产物[32],是植物因无益代谢物的过度积累产生的有害产物[33],苯甲酸的积累会严重抑制植物的生长发育[34]。丙氨酸、天冬氨酸和谷氨酸代谢与植物的生长发育、激素调节和抗胁迫反应密切相关[35]。奎宁酸是多种天然芳香族化合物经莽草酸生物合成途径的关键前体[36],2种刺蔷薇叶片在奎宁酸代谢上有显著差异,但二者并未在整个莽草酸代谢途径有明显差异。ABC 转运蛋白、苯丙烷的生物合成、3 种氨基酸的代谢和植物生长发育、生物素调节和环境应答有密切联系。所有的通路均受基因的调控和环境的影响,并且互相之间也有错综复杂的联系,如苯丙烷的合成影响氨基酸的合成,苯甲酸会抑制转运蛋白和氨基酸的转运等[33]。二者未在整体的代谢通路以及次生代谢上出现差异富集,说明虽然栽培条件不同,但遗传物质接近的二者叶片的代谢通路并未有整体差异,仅限于前文提到过的5条差异代谢通路。
目前的代谢组学技术还无法做到对生物体进行精准、全面的检测,本研究依靠GC-MS非靶向代谢组学技术仅能确定2 种刺蔷薇叶片的显著差异代谢物与和代谢途径,无法对其进行更深一步的定量和拓扑关系研究,但本研究的结果可为其基因序列、蛋白质种类和转录因子的选取缩小范围,结合生物信息学对其进行更全面深入的研究,并对相关产业的发展提供依据。对于刺蔷薇资源植物,在以后的研究中,可结合基因组、蛋白质组和转录组等对其进行生长发育、抗胁迫、观赏、绿化、营养与药用价值等方面的研究。

