3个马拉巴栗叶色突变体色素含量与光合特性分析
张其生
(漳州市花卉研究所,福建漳州 363204)
种业是国家战略性、基础性核心产业.我国被称为“世界园林之母”,但观赏园艺许多种类的育种工作仍落后于西方发达国家,因此还需努力实施种业振兴.观赏植物叶色突变是绿色植物一种非常重要的突变,也是新品种重要来源之一.Gustaffsson[1]将叶色突变体分为5 类:浅绿、白化、条纹、黄化和斑点;Awan 等[2]则将叶色突变体划分为黄化、绿黄、白化和条纹等8 种类型.叶色突变可作为标记性状,应用于良种繁育、杂种纯度鉴定[3]及杂交种生产[4]等;部分叶色突变体具有特殊的优良性状,可作为育种材料[5];叶色突变体是研究叶绿体结构[6-7]、叶绿体发育[8-9]、植物光合作用[10]和基因功能[11]等的理想材料,为近几年发育生物学研究热点之一.目前,叶色突变的报道更多集中在粮食和蔬菜作物,但在观赏植物领域也不断有物种见到报道,如菊花[12]、兰花[13-14]、胡颓子[15]和马拉巴栗[16-17]等.
马拉巴栗(Pachira glabra),俗称发财树,属木棉科瓜栗属常绿小乔木,是现在市场上畅销的观叶植物之一,曾被联合国环保组织评为世界十大室内观赏植物[18].但目前市场上叶色单一,易引起审美疲劳,难以满足人们的观赏需求,因此有必要选育出不同叶色的新品种.国内对马拉巴栗新品种选育报道不多,仅苏文潘等[16]对黄叶突变体、陈绿林等[17]对花叶、金叶类型进行选育,但目前未有彩叶新品种实现产业化.为丰富马拉巴栗的种质资源,培育属于我国自主产权的品种,漳州市花卉研究所自2018 年起在福建、广东等地收集叶色突变植株并进行选育,已选育10 多个株系.在选育过程中,发现部分突变体呈现叶片早衰、植株矮小及长势弱等问题,严重影响植株的观赏价值,因此有必要对马拉巴栗的叶色突变体进行深入研究,为马拉巴栗叶色突变体的利用奠定基础,也为其他观赏植物叶色突变体选育提供借鉴.
1 材料与方法
1.1 试验材料
在漳州市花卉研究所的马拉巴栗种质资源圃中选择3个命名为Mu21、Mu27和Mu37的叶色黄化、白化类型的突变单株,分别取枝条进行嫁接,以野生型的马拉巴栗为砧木,连续嫁接3~4代,待其性状稳定后进行试验.以相同规格与栽培条件下的野生型马拉巴栗为对照进行数据的测定与分析.
1.2 植物学性状的测定
嫁接后90 d,测定叶片颜色和枝条长度、叶柄长度、叶长、叶宽和叶面积等植物学性状.
采用英国皇家园艺协会RHS 比色卡测定叶片正面颜色,突变体Mu27 的幼叶与成熟叶分开测定.枝条长度为嫁接点或切点到顶端的长度;因马拉巴栗掌状叶的小叶数5~8片不等,掌状叶的叶长、叶宽等性状差异大,故选择比较稳定的顶生小叶进行测定.选择野生型与突变体植株顶端往下的第五片成熟叶,测定掌状叶叶柄长度、顶生小叶叶长、叶宽、叶面积等性状.面积测量方法参照李宝光和黄芳[19]的方法,采用HP Smart Tank 519扫描仪对顶生小叶进行扫描,保存为jpg格式后,通过Photoshop 7.01进行计算.每种材料随机选15株进行测定.
1.3 叶绿素和类胡萝卜素含量的测定
参照王学魁等[20]的方法测定叶绿素、类胡萝卜素含量.每个突变体各取植株第五片成熟叶,5 片为一组,将每组叶片剪碎,进行混样,称取0.2 g 叶片鲜样.经少量石英砂、碳酸钙粉及乙醇研磨后,过滤,加乙醇定容至25 mL.采用普析TU-1810 型紫外可见分光光度计在波长665、649、470 nm 下测定吸光度,依据公式计算叶绿素a、叶绿素b、类胡萝卜素等色素含量.试验重复3次.
1.4 光合速率的测定
采用GFS-3000 光合荧光测定仪测定光合作用.设定气流流速750μmol·m-2·s-1,叶室30 ℃,CO2浓度400μmol·m-2·s-1,光照强度800μmol·m-2·s-1.夹取第5 片叶的顶生小叶中部,使用开放气路测定叶片光合速率等参数,每种材料随机选择5株.
1.5 叶绿素荧光参数的测定
采用Handy PEA型植物效率分析仪测定叶绿素荧光动力学参数.夹取顶端向下的第5片成熟叶的顶生小叶中部进行测定,测定前叶片至少暗适应20 min,然后暴露在饱和脉冲光1 s.每种材料测10片小叶.
1.6 数据统计与分析
通过软件Microsoft Excel 2013对试验数据进行统计分析;通过软件DPS 7.05对数据进行方差分析及显著性检验.样本间的比较采用Duncan新复极差法多重比较(P<0.05).
2 实验结果与分析
2.1 3个马拉巴栗叶色突变体的植物学性状
3 个叶色突变体的叶色与野生型有明显差异(图1).英国皇家园艺协会RHS 比色卡比对结果表明:Mu37 叶面比色卡数值颜色为155C,白色;Mu21 为156D,黄白色;Mu27 幼叶为144A,黄绿色,成熟叶为156D,与Mu21的叶色接近;Mu37在嫁接后3个月叶片表面逐渐出现褐色斑点,后逐渐扩大,直至整个叶片枯萎、脱落,部分植株出现死亡;Mu21在3.5个月开始出现与Mu37类似的情况;Mu27的幼叶由黄绿色逐渐转为黄白色,也逐渐出现早衰现象.在夏季高温、强光照的条件,早衰的现象更早出现、更为明显.3个突变体的所有嫁接植株均会出现叶片早衰的现象.表明3 个叶色突变体由于出现突变,导致生理特性改变,出现叶片早衰现象.

图1 马拉巴栗野生型与不同叶色突变体植株Fig.1 Plant of wild type and leaf color mutants of Pachira glabra
与野生型相比,各突变体植株矮小,枝条长度、掌状叶叶柄、顶生小叶叶长、叶宽、叶面积均显著性变小(表1);其中,Mu37 的各项性状为最小,与野生型差异大.结果表明3 个叶色突变体因突变显著影响了植株的生长,导致植株矮小,叶片等性状变小,且突变颜色越浅,受影响程度越大.
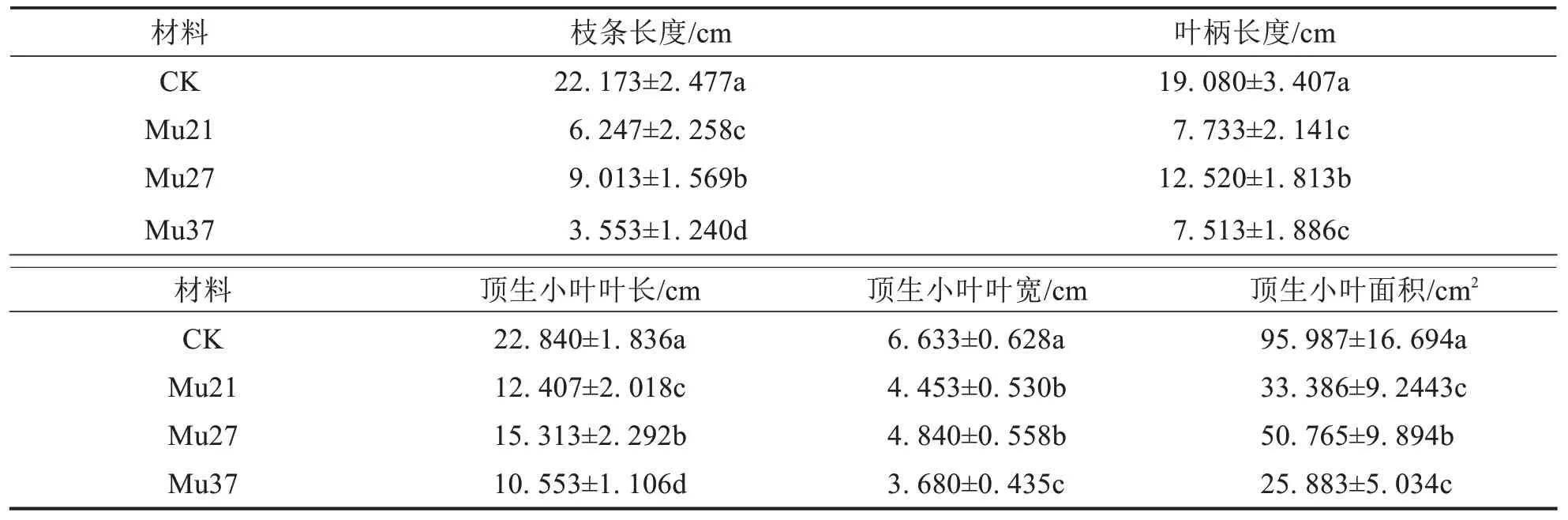
表1 3个马拉巴栗叶色突变体的植物学性状Tab.1 Botanical character of three leaf color mutants of Pachira glabra
2.2 3个马拉巴栗叶色突变体叶片的光合色素
表2结果表明,与野生型相比,3个突变体的叶绿素a、叶绿素b、类胡萝卜素和总叶绿素含量均显著降低.Mu21、Mu27和Mu37的叶绿素a含量分别为0.175、0.323、0.056 mg·g-1,仅为野生型的1.75%、3.22%和0.56%;叶绿素b 含量分别为0.100、0.215、0.070 mg·g-1,仅为野生型的2.68%、5.74%和1.87%;胡萝卜素的含量分别为0.071、0.121、0.040 mg·g-1,仅为野生型的3.61%、6.12%和2.03%;总叶绿素含量分别为0.275、0.538、0.126 mg·g-1,仅为野生型的2.00%、3.90%和0.92%.表明与对照植株相比,3 个突变体的叶绿素含量显著降低,叶绿素a 降幅最大,同时影响类胡萝卜素的合成.Mu27、Mu37 的叶绿素a/b 均显著下降,Mu21下降差异不显著,说明叶绿素b含量降低的幅度小于叶绿素a降低的幅度.各突变体的胡萝卜素/总叶绿素均较野生型大,除Mu37有显著差异外,其他差异均不显著.综上推断叶绿素与类胡萝卜素含量的降低可能是3个突变体叶色变化的主要原因.
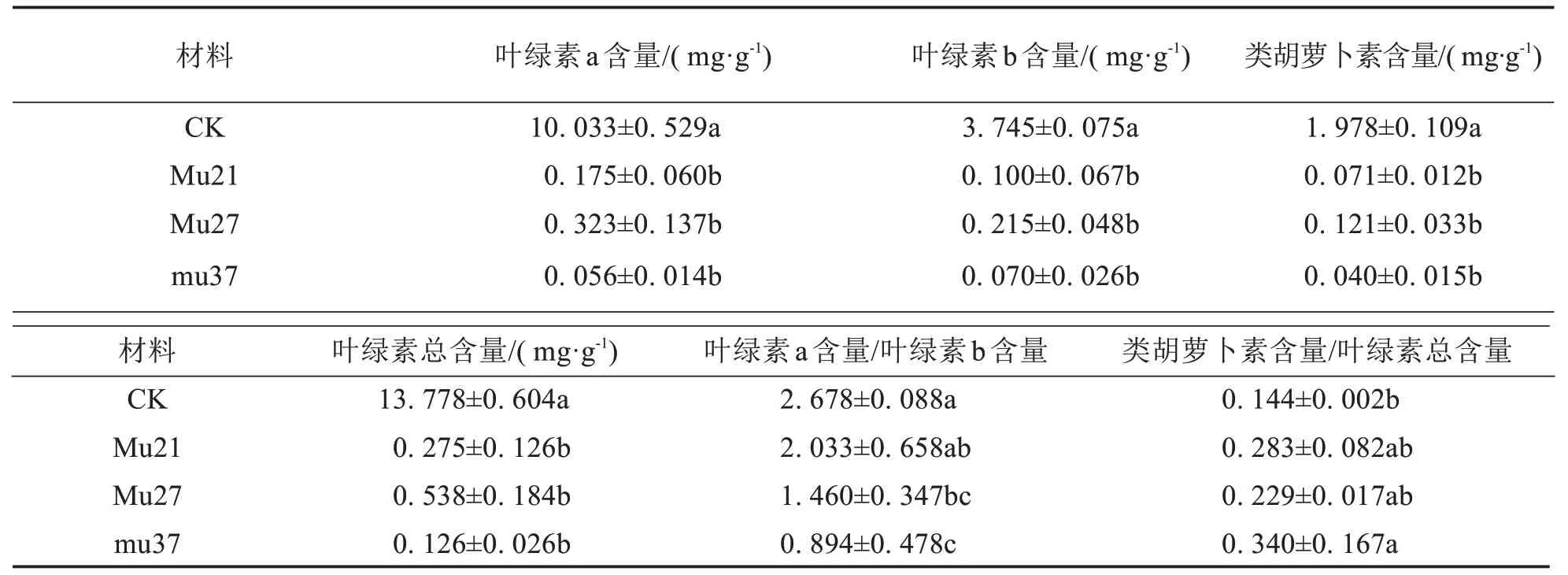
表2 3个马拉巴栗叶色突变体叶片的光合色素含量Tab.2 Photosynthetic pigment content in leaf of three color mutants of Pachira glabra
2.3 3个马拉巴栗叶色突变体叶片的光合参数
表3 结果表明,3 个叶色突变体的净光合速率(Pn)、气孔导度(Gs)、蒸腾作用(Tr)均显著低于野生型,胞间CO2浓度(Ci)显著高于野生型.Mu21 和Mu27 的净光合速率(Pn)分别为0.035 μmol·m-2·s-1和0.012 μmol·m-2·s-1,为对照的3.70%、1.27%;Mu37的净光合速率(Pn)为负值,表明其光合作用小于呼吸作用,处于消耗状态,相对应的是数据测量时突变体叶片开始出现褐色斑点等早衰现象.引起叶片光合速率降低的植物自身因素有叶肉细胞光合活性下降和气孔部分关闭两类,胞间CO2浓度(Ci)增加则是光合作用非气孔限制的最可靠的判据[21].由此推断,3个叶色突变体的净光合速率(Pn)下降是由于突变体叶肉细胞光合活性下降,而非气孔限制.
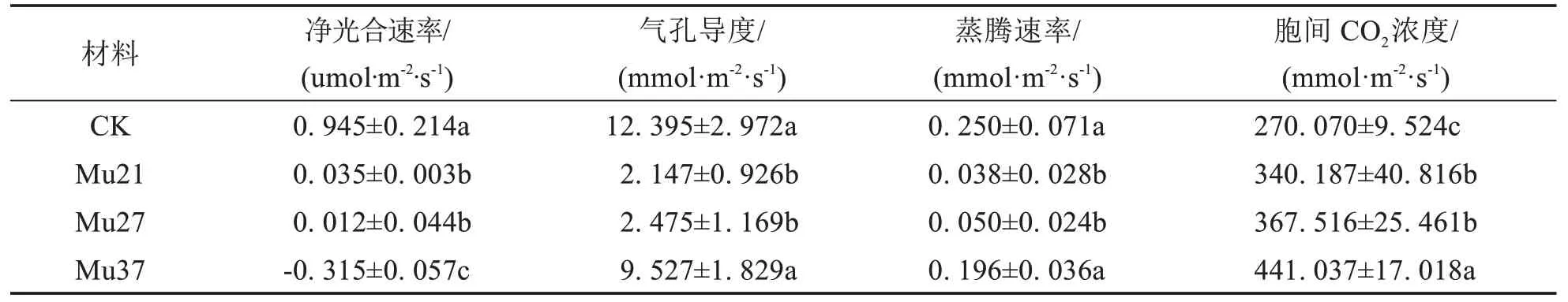
表3 3个马拉巴栗叶色突变体叶片的光合参数Tab.3 Photosynthetic parameters in leaf of three color mutants of Pachira glabra
2.4 3个马拉巴栗叶色突变体叶片的荧光动力学特性
初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv)和最大光化学效率(Fv/Fm)分别反映的是PSⅡ反应中心处于完全开放时的荧光产量、完全关闭时的荧光产量、原初电子受体QA的还原情况和内稟光能转换效率[21];PIabs为光化学性能指数,较Fv/Fm更好反映植物的光反应活性[22-23].
表4结果表明,突变体Mu21、Mu27、Mu37的初始荧光Fo、Fm、Fv、Fv/Fm、PIabs均显著较野生型小.其中,Mu21、Mu27 和Mu37 的Fo分别为55.000、185.400 和21.200,为野生型的15.33%、51.69%和5.91%;Fm分别为62.600、293.000 和23.500,为野生型的4.36%、20.39%和1.64%;Fv分别为7.600、107.600 和2.300,为野生型的0.70%、9.98%和0.21%;衡量植物抗逆性的参数PsⅡ最大光化学效率((Fv/Fm)分别为0.116、0.272 和0.096,为野生型的15.49%、36.32%和12.82%,表明3 个突变体的抗逆性下降,且突变颜色越浅,下降幅度越大;性能指数(PI abs)下降代表PsⅡ的光合结构、功能受到较大伤害[24],三个突变体的PIabs分别为0.007、0.197 和-0.004,为野生型的0.20%、5.58%和-0.11%,表明3 个突变体的PsⅡ的光合结构和功能受到了伤害,特别是Mu37出现负值,表明光合作用小于呼吸作用,与净光合速率为负值一致,比Fv/Fm能更好的反映植物的光反应活性.
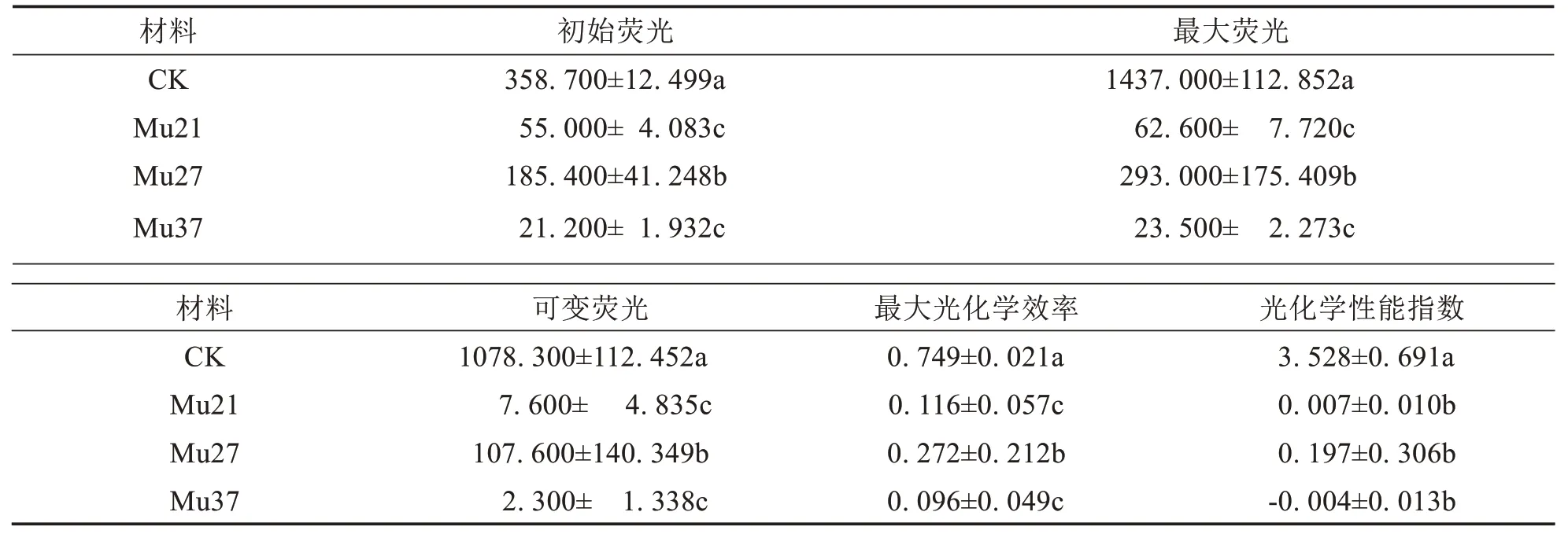
表4 3个马拉巴栗叶色突变体叶片的叶绿素荧光参数Tab.4 Chlorophyll fluorescence parameters in leaf of three color mutants of Pachira glabra
比活性参数能更确切反映植物对光能的吸收、转化和耗散等状况[25].ABS/RC、DIo/RC、TRo/RC、ETo/RC 和REo/RC 分别表示单位反应中心吸收的光能、单位反应中心耗散的能量、单位反应中心捕获的用于还原QA的能量、单位反应中心捕获的用于电子传递的能量和单位面积中活性反应中心的密度[26].
由表5可得,不同突变体的比活性参数表现不一致.Mu21、Mu27的ABS/RC 和DIo/RC显著高于野生型,但Mu37低于野生型,但差异不显著.Mu21、Mu27的TRo/RC 与野生型无明显差异,但Mu37的接近于零,与野生型差异显著.Mu21的ETo/RC显著高于野生型,Mu27与野生型无明显差异,Mu37为负值,显著低于野生型.Mu21、Mu27的REo/RC 与野生型无明显差异,但Mu37为负值,显著低于野生型.由此推断,突变体Mu21、Mu27 单位反应中心吸收的能量(ABS/RC)增加,较多的能量并没有用来捕获光能(TRo/RC)和推动电子的传递(ETo/RC),而是以荧光和热的方式耗散掉(DIo/RC),造成叶片光合能力降低;而处于衰退期的Mu37 突变体光合结构和功能受到了严重损伤,单位反应中心吸收的能量(ABS/RC)减少,但不显著,几乎丧失了捕获光能(TRo/RC)的能力,ETo/RC 和REo/RC 出现负值.Mu37 的多项比活性参数与Mu21、Mu27有明显的差异,可能与Mu37处于衰退状态有关.
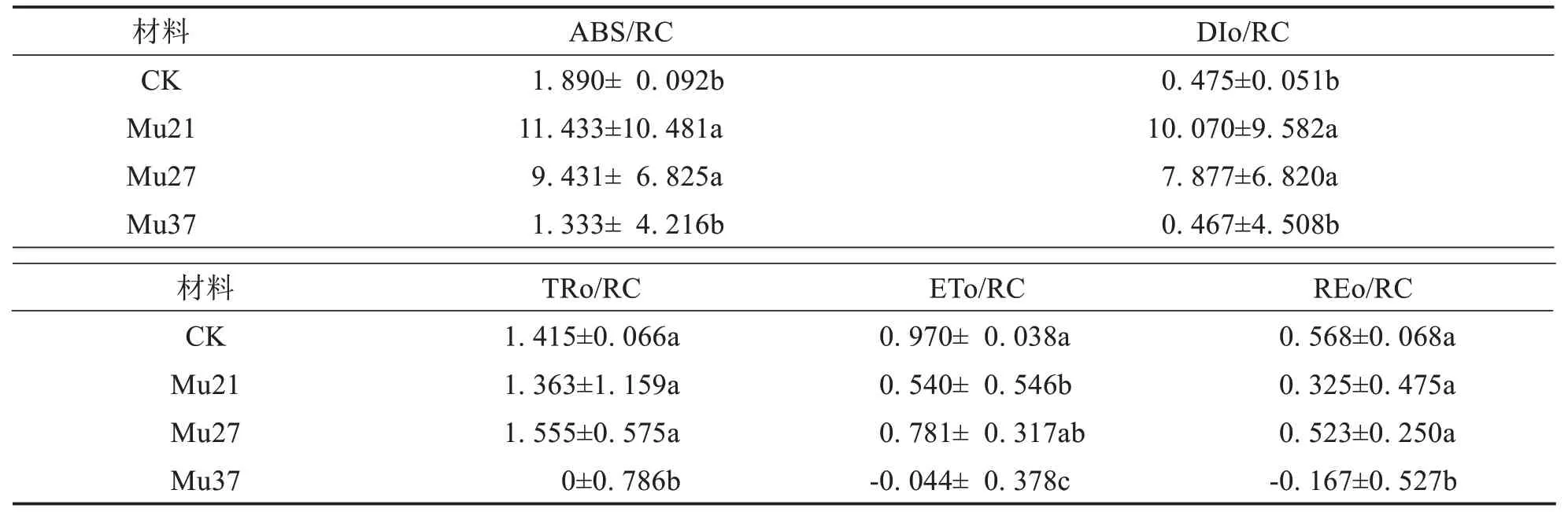
表5 3个马拉巴栗叶色突变体叶片的比活性参数Tab.5 Specific Activity Parameters in leaf of three color mutants of Pachira glabra
3 结论与讨论
光合色素含量直接或间接影响着植物的光合能力.在小麦[24]、番茄[25]和菜豆[26]等植物中,叶绿素缺乏会抑制光合作用,导致叶片光合能力下降,进而影响生物量的积累与植株的发育,植株往往矮小、长势弱.本实验中,3个马拉巴栗叶色突变体的叶绿素a、叶绿素b、胡萝卜素含量和总叶绿素含量较野生型均显著降低.叶绿素含量的降低,且胞间CO2浓度(Ci)增加,表明净光合速率(Pn)下降是突变体叶肉细胞光合活性下降,而非气孔限制.植株则表现矮小,枝条变短,叶柄长度、顶生小叶叶长、叶宽、叶面积均有不同程度的减小.
叶片早衰是指叶片在有效期的生理生化过程中的衰老比正常植株提前,叶片过早死亡的现象.玉米[27]、白桦[28]等存在叶色突变体叶片早衰的现象.马拉巴栗3 个叶色突变体Mu21、Mu27、Mu37 均出现早衰现象,严重影响观赏价值与观赏时长.今后可进一步研究叶片早衰机制,为培育耐早衰叶色突变优良品种提供借鉴.
三个马拉巴栗叶色突变体叶绿素荧光参数Fo、Fm、Fv、Fv/Fm、PIabs均显著下降,表明光合色素含量降低导致PSⅡ反应中心捕光能力弱和光化学转化效率低,叶片光合速率降低.Mu37的光化学性能指数(PIabs)为负值,与净光合速率为负值表现一致,表明测定时植株的状态处于表明其处于衰退状态,光合作用小于呼吸作用,比Fv/Fm能更好反映植物的光反应活性.
不同突变体植株的比活性参数表现不一样,不仅跟叶色突变有关,可能跟植株的状态有关.Mu37 的多项比活性参数与Mu21、Mu27存在显著性差异,且TRo/RC趋近与零,ETo/RC和REo/RC出现负值,这些是否可以作为突变体处于衰退状态的指标尚需进一步的讨论.

