基于高通量测序技术分析瓶装泉水中真菌生物多样性研究
王菁华,刘 威,李月兴,郭新明
(黑龙江省科学院自然与生态研究所,哈尔滨 150040)
真菌是异养类真核微生物的一种,主要包括单细胞酵母和多细胞丝状真菌两大类[1],其中丝状真菌常见于水源水体中,能够在适宜的环境条件下繁殖,并借助流水进行传播。如果真菌以水为媒介进入水处理和供水管道,极易附着在管道表面、接口处,形成生物膜或悬浮物长期生存并繁殖,导致水体污染,并通过生产环节污染瓶装水,尤其是丝状真菌肉眼能够观察到,形成沉淀,影响产品感官,甚至产生毒素对人体造成危害[2-6]。真菌具有广泛性,很多企业的生产、贮存及厂房车间都存在真菌污染的潜在隐患[7]。真菌孢子繁殖可引发包装物、墙壁等霉变,在瓶装水中产生絮状或丝状沉淀,导致感官指标不合格,存在安全隐患,造成企业经济损失[8-10]。
有关真菌在水中的生长繁殖研究主要集中在天然水体方面,瓶装水的相关研究较少。徐向前[11]对地下水中丝状真菌生长繁殖特性及二氧化氯灭火机制进行了研究,结果表明,水质指标中,pH值、碳氮比及温度是影响其活性的主要因素,而无机离子铁锰浓度对其影响较小。韩琳等[12]对瓶装薄荷水生产过程中的霉菌污染进行检测分析发现,霉菌类型并非全部是水生霉菌,导致这种问题发生的原因很可能与环境、包装物污染有关。Hageskal 等[13-14]研究发现,在地表水中,真菌能够大量繁殖且速度快,多样性程度高,这主要与地表水的水质尤其是有机物含量密切相关,同时无机钙离子也是影响真菌繁殖的重要因素之一。
高通量测序分析技术是目前应用较为广泛的一种微生物分析手段,可有效对样本进行真菌菌群的多样性分析[15]。真菌在水体中的繁殖研究尤其是在瓶装水中的污染并未引起足够的重视,本研究对市售的不同产区的瓶装泉水中的真菌菌落多样性进行分析,为掌握真菌分布规律和产品质量控制技术提供依据。
1 材料与方法
1.1 材料与试剂
瓶装水样品:分别采集自黑龙江省5个地区的市售瓶装水。1号样品采集自哈尔滨,2号样品采集自五大连池,3号样品采集自克东,4号样品采集自北安,5号样品采集自大兴安岭。
试剂:E.Z.N.ATMMag-Bind Soil DNA Kit(美国Omega生物科技有限公司生产),Qubit3.0 DNA检测试剂盒(美国赛默飞世尔科技有限公司生产),10105ES03 2×Hieff® Robust PCR Master Mix(翌升生物科技(上海)股份有限公司生产)。
1.2 仪器与设备
DYCZ-21电泳仪(北京市六一仪器厂生产),FR-1000凝胶成像系统(上海复日科技有限公司生产),Q32866 Qubit3.0荧光计(英杰生命技术有限公司生产),A00582 Illuminate MiSeq PE300测序仪(生工生物工程(上海)股份有限公司生产)。
1.3 方法
1.3.1 样品预处理
将采集的水样5 000 mL进行抽滤,抽滤膜选择孔径0.45 μm。将水样浓缩到抽滤膜上,按照水体基因组DNA提取试剂盒操作说明提取样品DNA。每次抽滤所需水样用量5 L,单个样品需要重复提取3次DNA。将提取的DNA样本进行充分混合,再取1份进一步检测。
1.3.2 Illumina MiSeq高通量测序
上述制得的DNA样本经检测合格后作为模板扩增18SV4区,扩增引物为18SV4F(GGCAAGTCTGGTGCCAG)和18SV4R(ACGGTATCTRATCRTCTTCG)进行第一轮扩增。PCR反应体系(30 μL):2×Hieff®Robust PCR Master Mix 15 μL,Bar-PCR primer F 1 μL,Primer R 1 μL,PCR products 10~20 ng,H2O 9~12 μL。使用移液器轻轻吹打或震荡混匀并短暂离心,将反应液离心至管底。PCR反应体系条件:94℃ 3 min、94℃ 30 s、45℃ 20 s、65℃ 30 s、94℃ 20 s、55℃ 20 s、72℃ 30 s、72℃ 5 min、10℃循环。之后引入Illumina桥式PCR兼容引物进行第二轮扩增,体系条件(30 μL):2×Hieff®Robust PCR Master Mix 15 μL,Primer F 1 μL,Index-PCR Primer R 1 μL,PCR products 20~30 ng,H2O 9~12 μL。使用移液器轻轻吹打或震荡混匀并短暂离心,将反应液离心至管底。将PCR管置于PCR仪中进行扩增,PCR反应条件:95℃ 3 min、94℃ 20 s、55℃ 20 s、72℃ 30 s、72℃ 5 min、10℃循环。利用IlluminaMiSeqTM/HiseqTM测序平台,对真菌18SV4区基因序列进行测序。利用USEARCH,将序列按97%相似度聚类为可操作分类单元(operational taxonomic unit,OTU)。利用基本局部比对搜索工具(basic local alignment search tool,BLAST),在Silva数据库(https://www.arb-silva.de/)对真菌序列进行分类注释,获得有效的OTU分类学信息。
1.3.3 数据分析
数据分析主要基于R语言,对其进行分析获得真菌门、纲、目、科、属的组成情况,再利用vegan包对主坐标(pricipal coordinates analysis, PCoA)进行分析,从而获得不同地区瓶装泉水样本中的真菌分布特征。
2 结果与分析
2.1 多样性分析
2.1.1 Alpha多样性分析
5份瓶装泉水样品的真菌18SV4区测序共获得121 766条真菌序列,按照97%相似度归类并进行Alpha多样性分析,可以反映微生物群落的丰度和多样性,结果见表1。
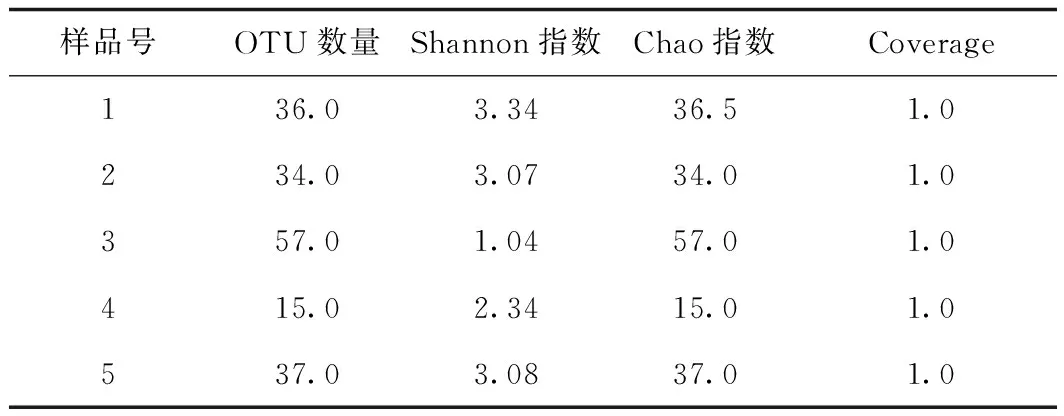
表1 5份瓶装泉水样品真菌菌群α-多样性指数统计表Tab.1 Statistical table of α-diversity index of fungal flora in 5 bottled spring water samples
α多样性指数主要对单个样本数据进行分析,再以统计学指数反映微生物群落的多样性和物种丰度。由表1数据可知,5份天然瓶装水样品累积获得179个OTU,样品3的OTU数最高,为57;样品4的OTU数最低,为15。Chao指数常用来估计物种总数、指示菌群丰度,与物种丰度成正比,5个样品的丰度最高为57.0,最低为15.0。Shannon指数从均匀度和丰富度两方面来体现菌群多样性,数值越大多样性越高,测试样品的Shannon指数1号最高,为3.34;3号最低,仅为1.04。Coverage指数常用作反映测序群落的覆盖率,数值越高,则样本中序列没有被测出的概率越低。5份样品的Coverage均为1.0,说明测序结果能够较好地反映样品中真菌的情况,所有提供的样本中真菌的物种信息基本全被覆盖。通过以上数据分析表明,不同产地的瓶装泉水中,真菌菌群多样性存在较大差异,这可能是生产工艺流程对水质处理能力和条件差异导致的,物种多样性越高,生产工艺对水质的作用越小,需加强对水质处理工艺的调整。
2.1.2 Beta多样性分析
PCoA(principal co-ordinates analysis)是一种研究数据相似性或差异性的可视化方法,通过一系列的特征值和特征向量进行排序后,可以用于显示个体和群体间的差异,样品距离越接近,表示物种组成结构越相似,因此群落结构相似度高的样品倾向于聚集在一起,群落差异很大的样品则会远远分开。为进一步揭示真菌菌群相似度,基于nuifrac距离,对测序获得的OTU进行主坐标分析,结果见图1。
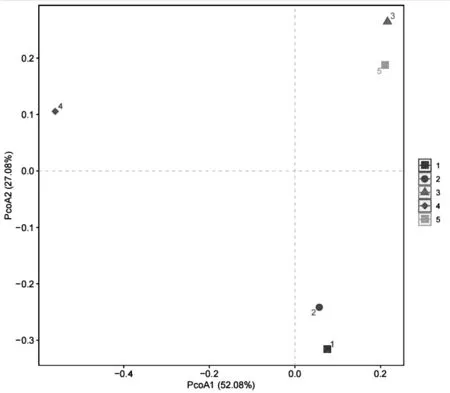
图1 基于OTU数据5份样品真菌菌群PCOA结果Fig.1 PCOA results of fungal community in 5 samples based on OTU
由图1可知,PCoA1和PCoA2对样品差异性方差贡献率分别为52.08%和27.08%,累积方差贡献率为79.16%,说明在5份样品中,真菌组成存在差异,但不显著。1号样品和2号样品距离较近,且更接近0,说明两个样品的群落进化分类更相似。3号样品和5号样品距离较近,说明两个样品的真菌菌群组成相似。4号样品与其他4个样品的距离比较远,相似程度较低。通过数据比对,说明不同产地的瓶装泉水真菌组成间在OTU水平上存在一定的差异性,但差异不显著。
2.2 样品真菌菌群结构分析
使用R软件,分析样本在不同分类水平上的群落结构,对比5个样品的结构,进一步对瓶装泉水中真菌菌落结构差异进行分析,基于门和属水平的5个瓶装泉水样品真菌群落结构见图2。
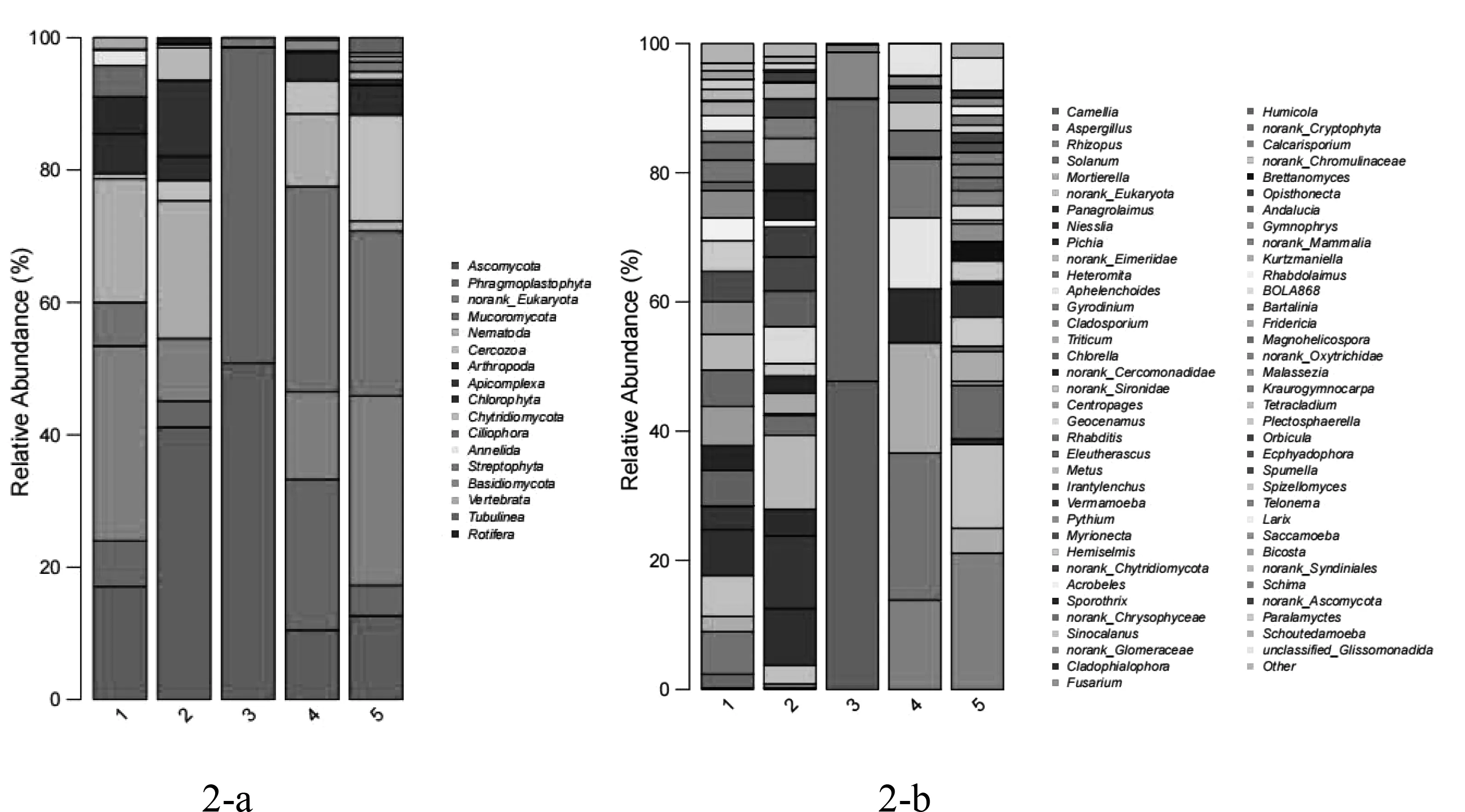
图2 基于门(2-a)、属(2-b)水平的真菌群落结构Fig.2 Fungal community structure at phylum(2-a) and genus(2-b) level
由图2可以看出,5份瓶装泉水样品检测到的179个OTU属于17个门71个属。在门分类水平上,丰度排名前5的分别为子囊菌门(Ascomycota)、拟杆菌门(Phragmoplastophyta)、未分类的真核(norank-Eukaryota)、毛霉门(Mucoromycota)和线虫门(Nematoda)。其中子囊菌门的丰度最高,在5份样品中的含量分别为17.11%、41.15%、50.87%、10.51%和12.64%。拟杆菌门在3号样品中的含量较高,达到47.67%。毛霉门在1、2和3号样品中有检出。
在属分类水平上,共检测到71个真菌属。由图2-b可以看出,5份样品水中真菌菌群在属分类水平上出现了较大差异。其中3号样品水中相对含量高于1%的真菌属只有4种,分别是山茶属Camellia47.70%、曲霉属Aspergillus43.71%、枝孢属Cladosporium7.06%和Schima1.13%。1号样品中含量高于1%的真菌属有26种,高于5%的真菌属共有7种,含量最高的是Panagrolaimus7.11%,其余6种分别是Solanum6.58%、norank_Eukaryota6.32%、Rhabditis5.66%、Metus5.53%和Chlorella5.53%。2号样品中含量高于1%的真菌属有24种,含量高于5%的真菌属有6种,分别为norank_Eimeriidae11.46%、Niesslia11.25%、Panagrolaimus8.80%、Geocenamus5.72%、Eleutherascus5.53%和Irantylenchus5.25%。4号样品中含量高于1%的真菌属有11种,含量高于5%的真菌属有6种,分别为Solanum22.74%、Mortierella17.11%、Rhizopus13.85%、Aphelenchoides11.00%、Gyrodinium9.13%和Pichia8.31%。5号样品中含量高于1%的真菌属有24种,含量高于5%的真菌属有4种,分别为Rhizopus21.09%、norank_Eukaryota12.98%、Heteromita8.24%和Vermamoeba5.05%。
数据表明,5份样品中,在门分类水平上检测到17个分类,共有的门类有5种:拟杆菌门、子囊菌门、Nematoda、Arthropoda、Chlorophyta。但是在属分类水平上没有一种真菌属同时存在于每份样品中,结合样本α多样性和β多样性分析可以看出,不同样本之间在属分类水平上多样性存在显著差异。
2.3 瓶装水中潜在致病菌的分布
对5份样本水进行高通量测序,共检测出3种潜在致病菌属,均是子囊菌门。其中,曲霉属真菌Aspergillus在3份样本中检测出,镰刀霉属Fusarium在1份样本中分离检测到,假丝酵母菌属Candida在1份样本中检测出。曲霉属真菌存在一些条件致病菌,如黑曲霉等常在饮用水中被检测出,而通常情况下,曲霉的污染很大概率是通过水源污染传播的。本次调查中的曲霉属主要是黑曲霉种。假丝酵母菌被认为在长期饮用后,会引起人体免疫力下降,导致脏器、黏膜、皮肤等急性或慢性炎症,而镰刀霉属也是引发饮用水污染的一种真菌。
3 结论
真菌广泛存在于水环境中,而饮用水供水系统经常受到环境真菌的污染,存在一定的安全风险。本项目对市售的瓶装水进行样品采集,共采集样品5份,通过高通量测序方法,对采集的样本进行了真菌在18SV4区基因序列检测分析,共计检测到17个门、34个纲、54个目、65个科和71个种,并对其多样性和潜在风险进行了分析和评估。
通过对群落组成进行分析发现,子囊菌门是包装饮用水的优势菌门,但是每个样品间优势菌属各不相同,没有一种菌属同属于5份样本中。结合α多样性和β多样性分析,不同地区采集的样本具有一定的差异,同时受到不同水处理工艺的影响,也可能导致瓶装水检测群落结构存在较大差异。在部分样品中检测到曲霉属、镰刀霉属和假丝酵母菌属的存在,表明其可能穿透水处理工艺的多级处理工艺屏障,最后在成品包装水中被检测到,这也反映出现有的净水工艺技术和部分厂家的工艺流程无法将其有效去除,这些菌属的存在可能导致一定的隐患,需要引起生产厂家和监管部门的注意。饮用水真菌的生物安全问题不容忽视,需要更多的研究发现其传播途径,找到合理有效的控制手段。

