红纤维虾形草(Phyllospadix iwatensis)种子形态及内部特征
韩通, 李晶晶, 刘正一, 刘凯, 张金浩, 秦松, 钟志海
1. 河海大学海洋学院, 江苏 南京 210098;
2. 中国科学院烟台海岸带研究所, 山东 烟台 264003;
3. 东营市海洋发展和渔业局, 山东 东营 257091;
4. 烟台市海洋经济研究院, 山东 烟台 264034
海洋植物的繁育方式具有高度多样性, 而延续海洋植物繁衍的遗传信息载体, 即生殖细胞或果实、种子等生殖器官是海洋植物发育生物学、遗传学研究的重要内容(徐少春, 2017; Iurmanov et al,2021)。目前对藻类等海洋低等植物的生殖过程研究相对较多, 如大型藻类的有性繁殖、营养繁殖等, 而关于海洋高等沉水植物海草繁殖过程研究则主要集中在繁殖器官如花、果实、种子及种子萌发相关内容。另外由于海草本身是较为稀少的海洋植物类群,全球分布的海草种类仅有74 种, 隶属于6 科13 属(Short et al, 2011), 相关研究数量远少于对于藻类生殖过程相关研究, 但海草对于海洋生态环境稳定、碳中和增汇和渔业资源维护有着重要意义(Orth et al,2006; 杨顶田 等, 2013; 陈启明 等, 2020), 同时海草床生态系统也作为捕获大气中CO2的蓝碳生态系统而受到更多关注(李捷 等, 2019), 而对于海草床生态系统的保护和修复势必需要对于种子等繁育载体进行更加深入的研究。
虾形草属于鳗草科(Zosteraceae)、虾形草属(Phyllospadix), 有异名虾形藻、虾海草等, 于2014年“第十一次国际海草生物学研讨会”(The 11th International Seagrass Biology Workshop)期间统一中文名为虾形草(黄小平 等, 2016)。在全球范围内, 虾形草属(Phyllospadix)有5 种, 在中国仅有2 种, 分别为红纤维虾形草和黑纤维虾形草。虾形草通常生长于潮间带和潮下带的岩石质海底, 能够为鱼类提供产卵、育幼和索饵场所。目前几乎所有的虾形草海草床都处于衰退状态, 山东半岛沿岸曾经十分丰富的虾海草资源也几乎消失殆尽(马瑞 等, 2019)。对于海草床的修复工作, 有赖于海草的繁殖载体——种子。海草作为高等植物, 果实和种子承载着其生活史中繁育阶段的主要任务, 同时也常被应用于海草床修复工作中, 具有与较高研究价值(于硕 等,2019)。目前, 我国对虾形草的研究尚少, 关于虾形草果实、种子的描述更为稀少。我国国内学者近年来对虾海草种子的研究只有曹政飞等对山东威海双岛湾的红纤维虾海草的形态特征及其对海洋环境的适应性进行了研究, 对其植株、根状茎、根、叶、花、果实和种子的形态进行了描述(曹政飞 等,2015), 但也仍未能具体对重要的繁育载体种子进行描述。
本研究从中国山东省烟台市南长山岛采集到虾形草植株和果序, 通过DNA 分子鉴定, 确定采集到的虾形草为红纤维虾形草(Phyllospadix iwatensis)。对红须根虾形草的果实、种子等虾形草主要繁育载体相关内容的详尽描述, 包括生长环境、种子外部特征、内部结构以及萌发幼苗等。希望为虾形草种质库保护与海草床修复, 以及海洋高等沉水植物的种子研究提供参考。
1 材料与方法
1.1 采集区域
本研究所用材料采集自中国山东省烟台市蓬莱区长岛海洋生态文明综合试验区南长山岛孙家村海岸潮间带(37°55'16.56"N, 120°45'33.02"E), 位于黄海和渤海交汇处(图1)。采集时间为2021 年7—8 月,水温为23~25 ℃, 盐度为31.5‰~33.5‰。采样地点研究区域为沿岸线2km 的潮间带, 虾形草海草床分布非连续分散随机, 在2km 范围内的潮间带各处散布, 取样时尽最大可能分散随机。共设计采样位点3处, 彼此距离超过50m, 为不同群体样本, 就局地物种特征而言具有一定代表性。
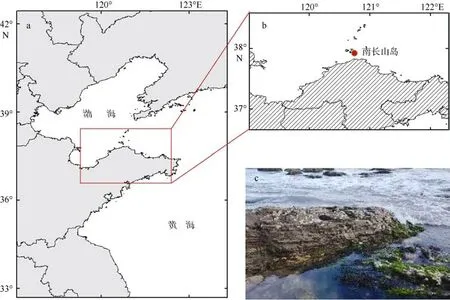
图1 山东省烟台市南长山岛的虾形草采样位点Fig. 1 The sampling sites for Phyllospadix iwatensis on the Southern Changshan Island, Yantai, Shangdong
1.2 植株分子鉴定
将虾形草植株叶片样本带回实验室后液氮低温研磨, 使用一步法多糖多酚植物基因组DNA 抽提试剂盒(北京诺贝莱生物科技有限公司)对其进行凝胶提取DNA, 设计引物完成PCR扩增与胶回收, 产物进行测序。引物合成与测序工作由青岛睿博兴科生物技术有限公司完成。用于扩增18s rRNA 和ITS-1 的寡核苷酸如下: 5′-TCCGTAGGTGAACCTGCGG(ITS1F); 5′-GC TGCGTTCTTCATCGATGC (ITS1R), 5′-CAACCTGGTT GATCCTGCCAGT (18SF); 5′-CTGATCCTTCTGCAGG TTCACCTAC (18SR) (Choi, 2010)。
1.3 种子的采集与保存
摘取果序, 内包被有种子, 置于海水中暂存,低温保存带回实验室。参考潘金华(2015)的海草种子保存办法, 除去果序外其他杂物, 将种子带荚保存于沙滤海水中, 盐度31‰, 保存温度为21 ℃, 并向海水中充入空气, 每5d 更换一次海水。
1.4 果实种子外观描述与测量
对果序、果实、种子各部分的长度、宽度、厚度及直径等进行测量, 并拍照。其中以果序尖端至荚柄处距离作为长度, 果序左右两侧之间距离作为宽度, 腹面与背面之间距离作为厚度, 另测量荚柄长度。果实呈翅果, 测量两翅长, 除两翅外整体正面近似圆形, 故直接测得直径作为正面数据; 果实平放时上下面之间距离作为厚度。剥皮后种子整体近球体, 仅测定球体直径。
1.5 种子切片鉴定
采用组织原形态、番红固绿染色和糖原PAS 染色法对种子内部组织进行染色。实验材料经多聚甲醛固定剂(上海阿拉丁生化科技)固定, 用轮转式石蜡切片机(Leica RM 2245)进行切片, 染色切片分别使用番红-固绿染色液(Solarbio G1375)、糖原PAS染色液(Solarbio G1281)进行番红固绿染色和糖原PAS 染色, 其中番红染料能显示植物木质化、木栓化和角质化组织, 固绿染料能够对纤维素细胞组织进行染色; 糖原PAS 染色液常用来显示糖原和其他多糖、中性黏液性物质和某些酸性物质, 以及色素、淀粉样物质等。切片和染色完成后在Leica DM1000 LED 生物显微镜下观察并拍摄。
1.6 虾形草种子萌发
将虾形草种子分别置于小烧瓶中, 设置盐度梯度4 个水平(5‰、10‰、15‰、20‰), 每个水平3个重复, 每个小烧瓶中各10 粒虾形草种子, 共计12组。充分铺开种子, 便于观察。每天观察记录每个组中种子的萌发情况。小烧瓶用封口膜进行密封以隔绝空气维持低含氧水平, 使用海水为天然海水和纯净水配置。培养箱内温度为 15 ℃, 光照强度为50μmol photons·m–2·s–1, 光暗周期设置12h。子叶长度超过1cm 的种子被认为成功萌发。
2 结果与分析
2.1 DNA 鉴定结果
结合形态学检索表和分子生物学手段, 与红纤维虾形草相关分子研究论文进行序列比对, 结果表明, 采集样本与参考文献(Kim et al, 2010)中ITS-1和18s rRNA 序列相似度分别为99.46%和99.43%,可以鉴定为同一物种, 即红纤维虾形草(Phyllospadix iwatensis)。
2.2 虾形草生长环境及形态
虾形草主要分布于风浪较大的开阔海域, 少数分布在封闭海域, 通常生长于潮间带和潮下带的岩石质基底上, 低潮时, 分布在较高位置的虾形草会露出部分, 在高潮位时植株完全淹没(图2a、b)。
植株本身根茎较为粗短(图2c、d), 匍匐, 茎直径4~5mm, 较短, 每节1 枚叶。在植株的基部位置常缠结有红棕色毛状纤维(图2c); 根系发达。叶互生, 具有叶鞘; 叶呈线形, 常 5 脉, 成熟叶宽1.0~1.4mm, 长80~130cm, 叶边缘有时呈锯齿状。繁殖期植株具果序 1 枚, 位于植株靠下接近根茎部的位置; 果序柄扁平, 果序由佛焰苞发育而成,整体呈弯虾形。

图2 红纤维虾形草生长环境及植株形态Fig. 2 The growing environment and shoot morphology of the surfgrass Phyllospadix iwatensis
2.3 果序形态
繁育期的红纤维虾形草在开花结果后具有明显的果序(图3、表1), 繁殖枝生长在接近虾形草根部的区域, 上有由单雌蕊发育而成的果序, 每株虾形草一般会形成1 个果序, 内含果实4~8 颗, 两排紧密交错组成, 外部包被有一个较大鞘状苞片, 果实占据果室内大部分空间。红纤维虾形草成熟果序呈深棕近黑色, 整体呈纺锤形, 中部膨大, 另有果序柄与植株茎部相连, 果序鞘长为2.6~4.0cm, 平均约3.4cm;鞘宽为0.5~0.7cm, 平均约0.6cm; 鞘厚0.3~0.5cm, 平均约0.4cm; 果序柄长1.9~4.2cm, 平均约2.8cm。
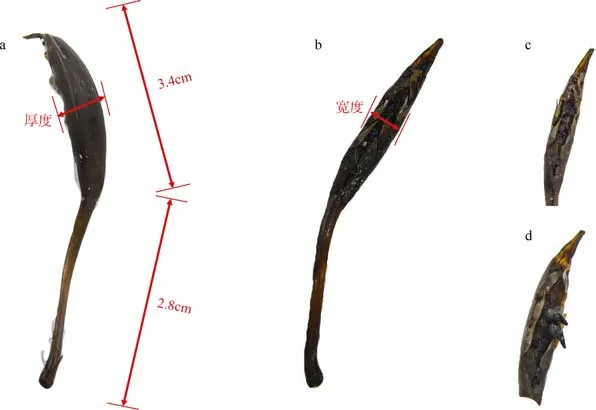
图3 红纤维虾形草(Phyllospadix iwatensis)果序形态Fig. 3 The shape of Phyllospadix iwatensis involucre

表1 23 粒红纤维虾形草果序外观描述数据统计结果Tab. 1 The statistical results of involucre shape
2.4 虾形草果实与种子形态
果实类型为小坚果, 较扁, 马掌形, 长2~3mm,宽达4~5mm, 具有短喙和中脊, 每边各有1 近轴的背沟, 从中间到侧边有极弯的刚毛, 果实成熟后可从残存的花序轴上脱落。果实前端具两翅, 翅内侧具有密生的长鬃毛, 能够辅助锚定在固着物上(图4a、b)。
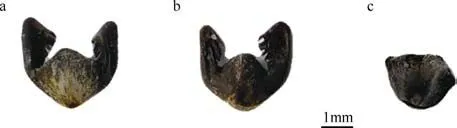
图4 红纤维虾形草(Phyllospadix iwatensis)果实及种子整体形态Fig. 4 The overall shape of the fruit and seed of Phyllospadix iwatensis
虾形草果实果皮与种子紧密贴合, 当剥去虾形草果实果皮后, 种子露出, 整体呈灰色, 形状近扁球状,原本果实两翅结构着生处仅余残留痕迹(图4c)。
2.5 虾形草果实种子内部结构
通过组织原形态切片(图5a—c)、番红固绿染色(图5d—f)和糖原PAS 染色(图5g—i)对种子内部组织进行染色, 其中番红染料能显示植物木质化、木栓化和角质化组织, 固绿染料能够对纤维素细胞组织进行染色; 糖原PAS 染色液常用来显示糖原和其他多糖、中性黏液性物质和某些酸性物质, 以及色素、淀粉样物质等, 可将虾形草种子内部结构分为种皮、胚、胚乳三部分。图5a、d、g 为沿两翅根部连线从果实腹面至背面的横向切面图; b、e、h 为从短喙尖至翅根部方向的纵向切面图; c、f、i 为经过种子中轴线两翅中间面方向的冠向切片图, 其中最大截面为纵切面, 截面积平均约12.5mm2。具体包括种皮、胚和胚乳等部分, 分述如下。
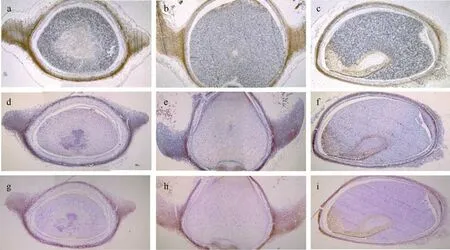
图5 红纤维虾形草(Phyllospadix iwatensis)果实切片染色结构Fig. 5 The sliced and dyed structure of the Phyllospadix iwatensis fruit
2.5.1 种皮
虾形草种子的种皮部分包被着种子的整个表面,厚度大致相同, 厚度平均约0.2mm, 腹面部分较厚。种皮部分自外而内, 可以分成角质透明层, 木质厚壁细胞层, 薄壁细胞层, 角质化细胞层。
2.5.2 胚
胚包括胚芽、胚轴、胚根和子叶等部分, 是虾形草作为单子叶种子植物所具有的种子重要组成部分。虾形草种子中胚为位于核心的染色结构, 具有细胞较小、细胞质浓厚、核大的特点, 其分裂能力较强。在糖原PAS 染色和番红固绿染色下均呈较深色, 即紫色和深紫色, 位于种脐附近, 子叶沿平行与种皮的方向展开包被胚芽、胚轴与胚根, 胚芽顶部较尖, 与另一端的胚根部分之间由伸长的胚轴相连接。
2.5.3 胚乳
虾形草种子的胚乳用于储存营养物质, 主要包括碳水化合物、蛋白质、半纤维素和脂质等贮藏物质, 占据了种子内的大部分空间。胚乳在糖原PAS染色下呈粉色, 在番红固绿染色下呈淡紫色。胚乳所占纵切面截面面积约1.5mm2, 估算胚乳占种子内全部物质的88%。
各部分具体结构如图6 所示。
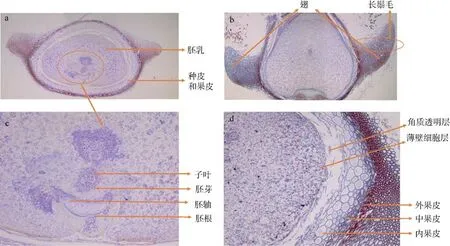
图6 果实切片各部分结构图Fig. 6 The structure of each part on the fruit slices
2.6 虾形草种子萌发形态
在温度15℃和盐度15‰条件下培养30d 后, 虾形草种子的真叶从两翅之间种子尖端开口伸出(图7a);44d 后, 真叶伸长, 叶鞘明显(图7b), 此时果皮仍未自然脱去, 从生长出真叶的方向向内可以看到种子(图7c)。剥去果皮后, 露出萌发有真叶的种子外部形态(图7d—f), 种子整体呈灰白色, 叶鞘部分较长(图7d), 底部有脐状结构(图7e), 真叶从顶种子端破开种子长出(图7f)。其他处理条件下的虾形草种子均未萌发。

图7 红纤维虾形草(Phyllospadix iwatensis)种子发芽发育Fig. 7 The sprout and development of the Phyllospadix iwatensis seeds
3 讨论
本研究通过对红纤维虾形草繁育期的生长环境、植株形态、果实种子解剖研究以及DNA 分析,认为红纤维虾形草种子的特殊结构具有以下特点和意义。
3.1 果实种子外部形态的特点与意义
虾形草通常分布于风浪较大的开阔海域, 低潮位时在较高位置的虾形草会部分露出。据报道, 1977年虾形草在我国的主要分布范围是辽东半岛南端、河北秦皇岛和山东半岛沿岸, 其中在山东半岛沿岸分布最广, 从北部的莱州湾、烟台、威海到青岛胶南沿岸均有发现(杨宗岱, 1979)。上述海域的岸线风浪较大, 而虾形草繁育期植株的果序和叶鞘的保护使虾形草果实得以安全发育(图2b、c), 并且虾形草果实独特的翅状结构和两翅内侧的长鬃毛(图2d、e)很好地完成了果实的固着及随固着物漂浮的基础准备, 使得虾形草果实能够完成海洋沉水高等植物的独特繁殖过程。关于虾形草果实的外部形态, Kuo 等(1990)在有关黑纤维虾形草(Phyllospadix japonica)的研究中将其描述为呈深褐色的菱形果实, 其特征是两臂带有坚硬的弯曲刷毛, 可以作为锚定系统,这样的结构特征是普遍存在的; 该研究中未给出具体测量数据, 但通过研究图片和比例尺可判断果实直径为2~3mm, 与本研究中测得的大致范围一致。Stephens 等(2019)对虾形草属的海草独特的硬底质生存环境, 即退潮时残留在岩石低洼处的潮水形成的潮间带水洼进行了研究, 描述了虾形草根茎对于锚定在底质的作用, 但其研究尚未涉及果实种子外部形态的锚定效应。翅状结构和内侧鬃毛使得虾形草在生活史初期即具有附着在漂浮物上传播, 后续遇到较稳定环境后固定于硬质岩石基底的能力, 二者为可能存在的根部分泌物质(Stephens et al,2019)、茎部团簇纤维(马瑞 等, 2019)等适应特征提供初始固定基础。
同时, Stephens 等(2019)发现托利虾形草(Phyllospadix torreyi)生长在加拿大不列颠哥伦比亚省、美国华盛顿以及美国加利福尼亚州的沉积物中。一般来说, 沙质生态型的虾形草生长在以较粗和压实的沉积物为特征的地点(固结砂, 有时带有卵石、砾石或鹅卵石), 并且可能受到较强的水动力影响,产生对应的结构特点。本研究中的虾形草果实外部形态同样有利于更好地适应其生长环境。
3.2 果实种子内部结构的特点与意义
虾形草种子的内部结构中, 胚乳占据空间较大(图4), 且通过2.6 中种子萌发实验可知虾形草种子极易进入休眠期, 这两点为长期的附着传播过程提供了营养物质基础。另外, 关于红纤维虾形草的植株组织解剖研究指出, 虾形草须根外皮层内侧机械组织形成区域, 此处有多层厚角细胞, 而表皮细胞的细胞壁同样具有类似六面加厚的情形(曹政飞,2015); 在本研究中所进行的果实种子切片也发现了类似的情形(图4), 果皮外部坚硬, 内部出现排列致密、细胞壁明显加厚的组织细胞, 同样为虾形草适应大风浪等恶劣生存环境所进化而来的特征。同时,对比几种陆地生长的高等植物种子内部结构(房丽宁 等, 1997; Castillo et al, 2020; Yang et al, 2020),发现红纤维虾形草果实、种子的内部结构更为复杂,仅果皮(图5)就分化为不均匀增厚的单层外果皮、多层中果皮和单层内果皮(Bobrov et al, 2019), 这样复杂的内部结构有利于虾形草适应相较于陆地环境更加复杂多变的海岸带潮间带环境。另外, Belzunce等(2005)研究了地中海地区的海草优势种大洋波喜荡草(Posidonia oceanica)的果实种子结构后发现,富含碳水化合物的胚乳将能够保证海草幼苗短期发育所需的充足营养供应。本研究的对象红纤维虾形草同为海草, 其种子中的胚乳占比较大, 可达约88%, 表明其幼苗期发育的营养储备也较为充足,有利于应对复杂多变的海洋环境, 为寻找适宜环境延长耐受时间。但本研究未能对胚乳的成分物质做定量分析, 这可作为后续对虾形草及其他海草种子深入研究的方向。
3.3 虾形草种子作为潮间带生态修复工具种的意义
基于以上特点, 虾形草果实种子具有外形结构特殊、易于附着、内部结构抗逆性强的优势, 可以作为潮间带生态修复的有效工具种, 并且可以结合能够提供附着基底的人工潮间带水洼和人造礁石等进行修复工程使用(Park et al, 2014)。
同时, 相比于已经投入海草床修复建设的外形类似米粒、仅有一层较薄果皮和种皮的鳗草种子(潘金华,2015), 虾形草果实有着果皮厚实、外皮结构复杂、抗逆性强的潜在优势, 有望成为新的海草资源修复工具种。Iurmanov 等(2021)对比虾形草属和鳗草属后指出,二者的果实为两种不同的类型, 能够适应不同环境。正是由于二者生存底质的差异, 虾形草修复的区域更偏向于岩石岸线和靠近潮上带部分, 而鳗草等海草更偏向泥沙质岸线和靠近潮下带区域(Blanchette et al,1999; Shelton, 2010), 二者的结合使用将有利于互相补足海岸带区域修复的整体性和协调性。
目前已经有将虾形草种子用于修复工程的研究实例, Park 等(2014)开发了一种使用人工造礁恢复黑纤维虾形草的播种方法, 在韩国东海岸种植了黑纤维虾形草种子, 密集地埋在人工鱼礁顶部的凹面上, 然后将人造礁安装在裸露的岩石海岸上, 2 年内幼苗/枝条的密度和枝条的形态特征表现良好。但海草床修复生态工程应用方面需解决虾形草种子休眠问题, 例如本研究后期室内培养的虾形草种子萌发率较低, 推测应是因种子进入休眠期。Pan 等(2012)的研究表明, 对鳗草种子外部环境条件的控制有助于打破休眠, 提高萌发率, 同样可以考虑应用于虾形草种子的萌发。
4 结论
本研究通过对红纤维虾形草繁育期环境、植株、果实、种子的全方位描述, 结合果实种子解剖结果与DNA 分子比对定种, 主要得出以下结论: 虾形草繁育果实种子及外部形态对于其生长环境适应有着较大贡献, 主要体现在保护器官和翅等独特结构的适应性; 虾形草果实种子的内部结构对于海洋高等植物繁育有着重要意义, 保护组织和营养组织保证了种子在脱离植株后到合适环境发芽这一过程中的生命维持; 基于虾形草果实种子的特殊结构, 将其作为潮间带生态修复工具种,可与目前主要工具种鳗草种子本身较脆弱、要求泥沙底质等特点互补,可用于修复不同的底质环境。虾形草的上述形态特征与内部结构具有重要的生态修复应用价值。

