BRAFV600E基因突变与PTC患者病灶数目及碘摄入量的相关性分析
李小妹,李 想,王利利,杜丽艳,宋爱林
甲状腺癌(thyroid cancer,TC)是临床多见的内分泌系统恶性肿瘤,且发病率呈逐年增加趋势,其中甲状腺乳头状癌(papillary thyroid of carcinoma,PTC)占80%~90%[1]。越来越多研究发现,PTC与鼠类肉瘤病毒癌基因同源物B1(v-raf murinesarcoma viral oncogene homolog B1,BRAF)基 因 突 变 存 在 相 关 性。随 着BRAFV600E基因突变研究的深入,该突变已被证实是影响PTC侵袭性的危险因素,且多中心临床研究结果显示,BRAFV600E基因突变与肿瘤侵袭性病理特征、复发、生存情况密切相关[2,3],因此研究BRAFV600E基因突变的相关因素对于临床治疗具有重要指导意义。流行病学研究表明,长期高碘摄入可增加PTC发生风险,而PTC中是BRAFV600E基因突变最常见、最有特异性遗传突变[4],故而可推测BRAFV600E基因突变与高碘摄入量存在相互关系。在临床实践发现仍有部分BRAFV600E突变型PTC患者有良好预后,表明BRAFV600E基因突变难以有效预测PTC患者预后情况[5]。PTC患者手术方式是影响预后重要因素,而病灶数目、病灶分布决定手术方式选择,如单灶或者多灶位于一侧腺叶者,以甲状腺患侧叶及峡部切除联合患侧中央区淋巴结清扫术为主;多灶位于两侧者,则需行甲状腺全切联合双侧中央区淋巴结清扫术[6]。目前,关于BRAFV600E基因突变与PTC患者病灶数目及碘摄入量关系尚不明确,因此笔者将通过实例进一步探讨和研究BRAFV600E基因突变与术后复发的关系,旨在为临床治疗提供指导。
1 材料与方法
1.1 实验材料
1.1.1 临床材料
选择2018年6月至2020年10月在邢台医学高等专科学校第一附属医院收治的248例PTC患者,其中男性68例,女性180例;年龄32~70岁,平均年龄52.28岁(标准差5.44岁);肿瘤T分期,T1期148例,T2期61例,T3期30例,T4期9例;病灶数目,单病灶176例,多病灶72例;淋巴结转移57例。
选择标准:①符合术后病理诊断为PTC,且接受碘放射治疗;②患者均接受BRAFV600E基因检测;③均初次接受甲状腺手术,术前未曾接受过放化疗及其他辅助治疗;④临床病理资料完整,且均完成3年随访;⑤患者均签署知情同意书,且该研究已获得伦理委员会批准。
排除标准:①复发后再次手术或者因残余癌灶而行二次手术;②合并其他部位非甲状腺转移性肿瘤;③合并有其他病理类型的TC;④头颈部放射治疗史及远处转移;⑤未行中央区淋巴结清扫。
1.1.2 主要试剂与仪器
BRAFV600E基因突变荧光试剂盒(检测灵敏度为1%。厦门艾德生物医药科技股份有限公司,中国)。7500型聚合酶链式反应(polymerase chain reaction,PCR)系统(Applied Biosystems,美国)。
1.2 方法
1.2.1 BRAFV600E突变基因检测
于PTC手术中获取PTC组织标本。
采用实时荧光定量PCR技术的扩增阻滞突变系统检测法进行BRAFV600E突变基因检测,实验过程按试剂盒操作步骤进行。借助Primer 5引物设计软件设计引物。
PCR反应体系共50μL,包括上、下游引物各2μL,0.25μL Taq酶,10μL 2×Taq PCR MasterMix,1μL DNA模版,2μL dNTP Mixture,无菌水定容至50μL。PCR扩增条件:95℃×10 min;92℃×15 s,60℃×60 s,共45个循环。PCR产物经纯化后,取5μL扩增产物经1%琼脂糖凝胶电泳分离,紫外灯检查扩增结果。根据突变情况分为突变组和未突变组。
1.2.2 观察指标
根据突变情况对患者进行分组后,统计两组癌灶平均大小、淋巴结阳性(指淋巴结清扫个数高于5个,检测到至少5个淋巴结发生转移)、T分期(tumor node metastasis classification)(参照第8版TNM系统[7],T1为原发灶最大径≤3 cm,T2为原发灶最大径3~5 cm,T3为原发灶最大径5~7 cm,T4为原发灶最大径>7 cm)、复发风险分级[高风险:肿瘤不完全切除,轻微腺外侵犯,远处转移淋巴结(>3 cm);中风险:轻微腺外侵犯,具有侵袭性组织学,血管侵犯或≥5个淋巴结(0.2~3.0 cm);低风险:局限于腺内的分化型甲状腺癌,<5个淋巴结微转移(<0.2 cm)[2]]、腺外侵犯(病理学检查报告显示肿瘤侵犯甲状腺外纤维脂肪组织)、病灶数目、碘摄入量。
1.2.3 肿瘤无复发生存分析
对PTC患者进行随访。分析病灶数目、碘摄入量、BRAFV600E基因突变与肿瘤无复发生存(relapse free survival,RFS)关系。根据病灶数目分组,分为单灶性组和多灶性组;根据突变情况分为突变组和未突变组;以尿碘值表示碘摄入量,采用过硫酸铵消化砷铈催化分光光度法检测尿碘值,以尿碘值中位数值为临界值,将患者分为高碘摄入组和低碘摄入组。
1.3 统计学方法
采用SPSS 20.0软件进行统计分析。连续型正态分布计量资料以均数±标准差表示,两组间比较采用独立样本t检验,计数资料以例数(%)表示,采用χ2检验。肿瘤RFS分析采用Kaplan-Meier检验,采用Cox多元回归分析BRAFV600E基因突变相关危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基线资料比较
248例PTC患者中BRAFV600E基因突变178例(71.77%),未突变70例(28.23 %)。两组患者的性别、年龄、癌灶平均大小、淋巴结阳性率比较,差异无统计学意义(P>0.05)。复发风险分级、腺外侵犯、T分期、病灶数目及碘摄入量与BRAFV600E基因突变有关(P<0.05)。见表1。
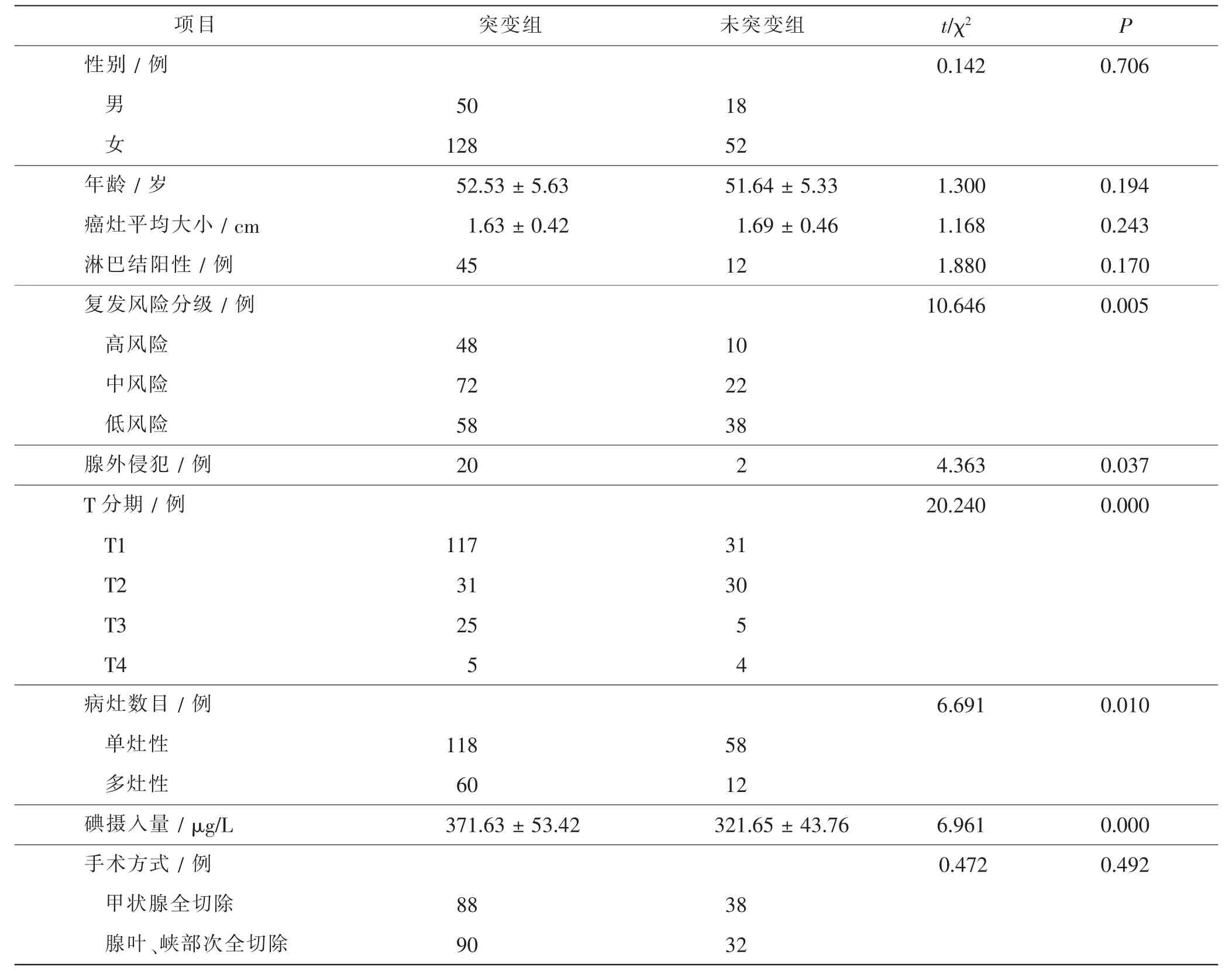
表1 两组患者基线资料比较Tab.1 Comparison of baseline data between 2 groups
2.2 BRAFV600E基因突变相关因素Cox多元回归分析
Cox多元回归分析显示,复发风险分级、腺外侵犯、T分期、病灶数目及碘摄入量均是BRAFV600E基因突变相关危险因素(P<0.05)。见表2。

表2 BRAFV600E基因突变相关因素Cox多元回归分析Tab.2 Cox multiple regression analysis of BRAFV600E gene mutation related factors
2.3 肿瘤无复发生存分析
2.3.1 基于BRAFV600E基因突变分层PTC患者的RFS分析
随访3年,共有54例患者复发。突变组与未突变组PTC患者的RFS曲线差异有统计学意义(χ2=4.295,P=0.038),突变组患者有更高的复发风险,风险比(hazard ratio,HR)(95 % CI)=2.095(1.034~3.330)。见图1。
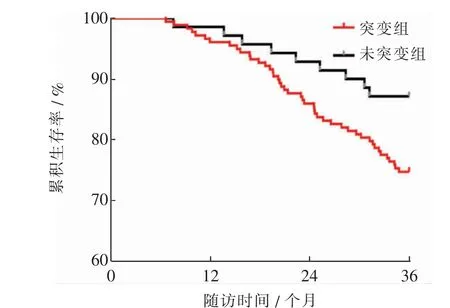
图1 突变组与未突变组PTC患者的RFS曲线比较Fig.1 Comparison of RFS curves between mutation group and non-mutation group of PTC patients
2.3.2 基于病灶数目分层PTC患者的RFS分析
病灶数目多灶性组与单灶性组PTC患者的RFS曲线差异有统计学意义(χ2=4.349,P=0.037),多灶性组患者有更高的复发风险,HR(95%CI)=1.775(1.040~3.488)。见图2。
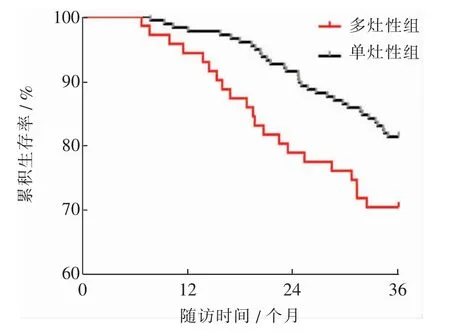
图2 多灶性组与单灶性组PTC患者的RFS曲线比较Fig.2 Comparison of RFS curves between multiple lesions group and single lesion group of PTC patients
2.3.3 基于碘摄入量分层PTC患者的RFS分析
高碘摄入量组(118例)与低碘摄入量组(130例)PTC患者的RFS曲线差异有统计学意义(χ2=4.602,P=0.032),高碘摄入量组患者有更高的复发风险,HR(95%CI)=1.804(1.052~3.065)。见图3。
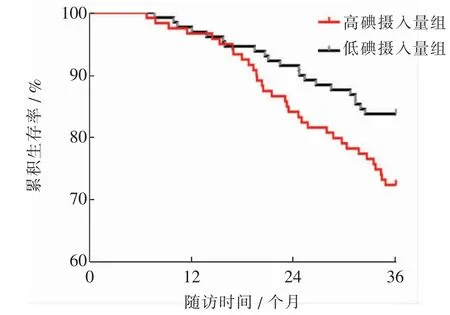
图3 高碘摄入量组与低碘摄入量组PTC患者的RFS曲线Fig.3 Comparison of RFS curves between high-iodine-intake group and low-iodine-intake group of PTC patients
3 讨论
PTC属于分化良好的恶性肿瘤,死亡风险较低,10年生存率高达90%,即使患者确诊时已发生颈部淋巴结转移,仍具有较好预后情况[8]。PTC中约40%~80%患者存在BRAFV600E基因突变,BRAFV600E基因突变是PTC中最常见的遗传学改变。BRAFV600E基因突变是PTC侵袭性分子机制的致癌基因,参与调控肿瘤侵袭性病理特征,影响肿瘤复发及预后,因此临床上可根据BRAFV600E基因突变情况筛选高危人群,从而指导临床精准治疗及预后评估。
笔者研究结果显示基因突变发生率为71.77 %(178/248例),与既往研究结果相近[9,10]。BRAF基因位于人类7号染色体,其作用是编码RAF家族丝氨酸/苏氨酸蛋白激酶,进而调控丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号通路,影响细胞的生长、增殖、分化、分裂等生物学过程。BRAF基因突变中T1799A点突变占90%以上,即第600位密码子的谷氨酸替代缬氨酸(V600E),进而导致编码的激酶活化,促进细胞的无限增殖、分裂,最终发生癌变,故而BRAFV600E基因突变对于PTC的发生、发展具有重要意义[11]。笔者研究结果显示,复发风险分级、腺外侵犯、T分期、病灶数目及碘摄入量与BRAFV600E基因突变有关(P<0.05),且通过Cox多元回归分析进一步证实以上临床病理特征均是BRAFV600E基因突变相关危险因素 (P<0.05)。Ayala MD等[12]研究表明,存在BRAFV600E基因突变的PTC患者,即使确诊时处于疾病早期阶段,肿瘤的复发风险也高于野生型(未发生基因突变),推测认为基因突变可降低对放射性131I的吸收率,进而影响PTC的预后,从而增加复发风险。另外,从分子水平上推测认为,长期的高碘摄入导致钠碘同向转运体mRNA表达降低,抑制甲状腺组织摄取碘及甲状腺激素合成,进而引起下丘脑过度分泌促甲状腺激素,使得发生甲状腺肿,引起甲状腺癌的发生,而PTC患者中多数存在BRAFV600E基因突变[13,14],故而笔者研究显示高碘摄入量是BRAFV600E基因突变相关危险因素。BRAFV600E基因突变在PTC癌组织中具有高度的特异性,是PTC侵袭性分子机制的致癌基因,进而增加腺外侵袭、淋巴结转移风险,增加肿瘤病灶数目,故而肿瘤病灶数目与BRAFV600E基因突变显著相关。
尽管PTC患者死亡风险较小,但疾病复发率仍然较高,特别是BRAFV600E基因突变的PTC患者,需要接受更彻底的治疗方案,且配合长期随访,从而降低疾病复发、死亡风险。国外很多研究表明BRAFV600E基因突变者预后较差[15],在中国PTC患者中BRAFV600E基因突变率较高,但并没有明确证据显示BRAFV600E变异型预后更差,因此该基因突变在评估PTC患者预后中的价值尚待确证。笔者研究结果显示,随访3年,共有54例患者复发,其中BRAFV600E基因突变组患者有更高的复发风险(P<0.05),与朱长雨等[5]研究结果相近,BRAFV600E基因突变加强PTC的侵袭性,是PTC复发的高危因素。研究认为BRAFV600E与老年PTC患者间存在更明显的相关性,相对年轻患者具有更差的临床结果,包括更高的PTC复发率和特异性死亡率[16],结合此次研究结果,进一步证实BRAFV600E基因突变可增加术后复发风险。Angell TE等[17]研究认为BRAFV600E基因与PTC患者的异常免疫反应有关,即突变型基因可能增加肿瘤免疫抑制,导致PTC预后不良。同时,笔者研究显示,高碘摄入量组患者有更高的复发风险(P<0.05),分析认为长期的高碘摄入一方面可通过“脱逸”现象、Wolff Chaikoff效应引起胶质性甲状腺肿,并诱发自身免疫反应、细胞凋亡,进而导致甲状腺细胞过度死亡;另一方面,还可以抑制钠碘同向转运体表达、转录,损伤甲状腺滤泡上皮细胞的摄取碘功能,进而减少甲状腺激素分泌,升高促甲状腺激素水平,促甲状腺激素的长期刺激引起甲状腺滤泡上皮细胞增生,最终增加TC发生风险[18]。BRAFV600E基因突变、高碘摄入均可降低钠碘同向转运体mRNA表达,进而降低甲状腺癌细胞摄碘能力,最终影响放射性碘的治疗效果,增加术后复发风险。另外,多灶性组患者有更高的复发风险(P<0.05),分析认为病灶数目影响手术切除范围的选择,多病灶手术切除相对复杂,特别是对于难以识别的微小肿瘤,往往容易忽视而导致肿瘤残留,增加复发风险,因此对可疑病灶进行基因检测[19],可为穿刺组织的病理诊断提供重要线索。
综上所述,PTC患者病灶数目及碘摄入量均是BRAFV600E基因突变相关危险因素,多灶性、高碘摄入量、BRAFV600E基因突变患者有更高的复发风险。

