人工周期和自然周期内膜准备在冻融胚胎移植患者中的应用效果
程婷婷
冻融胚胎移植(FET)常用于刺激周期但未获妊娠时,将多余胚胎冷冻储存,以便在人工周期或自然周期移植,提高累计妊娠率[1]。随着近年来玻璃化冷冻技术的不断发展,FET技术逐渐应用于临床中,通过一次取卵能达到多次移植,与新鲜胚胎移植周期的患者相比,接受FET周期时患者的高雌激素状态能够明显改善,其胚胎内膜容受性也有明显好转,这有利于增加妊娠成功率,获得更高的活产率,就围生期而言,更接近自然妊娠,前置胎盘、胎盘早剥的概率及子代出现低出生体重儿的风险明显低于新鲜周期,就远期疗效而言,通过FET技术出生的子代更接近自然妊娠子代的生长趋势,较新鲜周期而言不易出现追赶性生长,同时减少卵巢过度刺激综合征发生[2]。FET技术是治疗不孕症的重要辅助生殖技术,多项临床研究证据表明FET技术可辅助临床治疗、优化辅助生殖技术,保障母婴安全,目前通过FET技术出生的子代数量也呈现不断增加趋势。有研究发现,FET技术的成功率受胚胎因素及子宫内膜容受性等两种主要因素的影响,胚胎因素包括移植胚胎数量、质量、位置及移植时间等因素,子宫内膜容受性包括子宫内膜厚度、容积、血流情况、子宫内膜准备方案等因素,其中子宫内膜准备方案是影响FET技术成功的重要因素[3]。人工周期与自然周期是临床上常用的子宫内膜准备方案,但二者之间的应用效果研究报道较少,目前关于FET内膜准备方案的选择尚存在争议。因此,本研究比较冻融胚胎移植时采用人工周期与自然周期准备内膜对妊娠结局等的影响,现报道如下。
1 资料与方法
1.1 一般资料
回顾性选取2018年6月-2020年12月在徐州市妇幼保健院生殖中心行FET的76例患者作为研究对象。纳入标准:均符合文献[4]《妇产科学》中不孕症的诊断标准;处于生育期;具有生育意愿;丈夫生殖功能正常;临床资料完整。排除标准:伴生殖器官器质性病变(子宫严重畸形、宫腔粘连、输卵管积水);伴严重肝肾疾病;伴严重心脑血管疾病;伴精神系统疾病或认知障碍;伴恶性肿瘤;伴血液系统疾病。根据不同内膜准备方案将其分为A组(n=38)与B组(n=38)。A组:年龄21~39岁,平均(33.62±2.17)岁;不孕病程1~6年,平均(3.71±1.30)年。B组:年龄21~40岁,平均(33.55±2.09)岁;不孕病程1~7年,平均(3.68±1.28)年。两组年龄、病程一般资料比较差异均无统计学意义(P>0.05),有可比性。本研究符合《赫尔辛基宣言》原则,患者签署知情同意书。本研究经徐州市妇幼保健院医学伦理委员会批准。
1.2 方法
胚胎冻融与选择按照常规玻璃化胚胎冷冻法对胚胎进行冷冻及保存,此次冷冻胚胎均为体外培养第3天或第5天的胚胎,即D3(参照Thorir评分标准进行评估[4])或D5(参照Gardner囊胚等级评分系统进行评估[5])。
子宫内膜准备方案:A组给予人工周期内膜准备。于患者月经周期第2~3天进行B超检查,检测患者的卵泡大小及内膜厚度,若无直径≥10 mm的卵泡,内膜厚度<7 mm,患者需口服雌二醇片,2 mg/次,3次 /d,连续用药 10~14 d后复查 B 超测量子宫内膜厚度,并检测其血清E2水平,若患者的子宫内膜厚度 <8 mm,或者血清 E2水平 <200 pg/ml,则维持原剂量用药2 d,2 d后再次复查B超测量子宫内膜厚度,直至患者的子宫内膜厚度≥8 mm,或者血清E2水平≥200 pg/ml,则确定移植时期,在移植前 3~5 d 予以黄体酮肌肉注射 60 mg/d,移植D3胚胎者连用3 d,移植D5囊胚者连用5 d,后行解冻胚胎移植,并改为雌二醇地屈孕酮片口服,2/10 mg/次,3 次 /d,直到移植后 11~14 d,同时移植日开始均间隔2 d肌肉注射1次人绒毛膜促性腺激素(hCG),剂量为2 000 U/次,连续肌肉注射3次,移植后11~14 d行血清hCG检查确定是否妊娠再调整用药剂量直至孕10周停药。B组给予自然周期内膜准备。于患者月经周期第9~11天行初次超声检查,根据卵泡大小及血清LH、E2水平决定复诊时间,监测卵泡及内膜发育情况,若卵泡直径≥18 mm,血清 E2水平 >200 pg/ml,子宫内膜厚度≥8 mm,血清 LH 水平 <20 U/L,则于当日 20:00予以hCG 10 000 U进行肌肉注射以诱导排卵,于注射hCG后第3天予口服地屈孕酮20 mg/次,2次/d,服用2 d后即于注射hCG后第5天移植复苏的D3胚胎,或第7天移植复苏D5囊胚;若血清LH水平≥20 U/L,则于当日 15 :00 予以 hCG 10 000 U 进行肌肉注射以诱导排卵,于注射hCG后第2天予口服地屈孕酮20 mg/次,2次/d,服用2 d后即于注射hCG后第4天移植复苏的D3胚胎,或第6天移植复苏D5囊胚;移植后均间隔2 d肌肉注射1次hCG,剂量为2 000 U/次,连续肌肉注射3次,同时予以地屈孕酮片口服,20 mg/次,2次/d,直到移植后11~14 d行血清hCG检查确定是否妊娠再调整用药剂量直至孕10周停药。
1.3 观察指标及评价标准
(1)移植日情况:记录两组移植日情况,包括移植日子宫内膜厚度、移植日血清P水平、移植日血清E2水平、移植胚胎数。(2)胚胎复苏情况:记录两组胚胎复苏情况,包括胚胎复苏成功率(解冻后胚胎存活的卵裂球细胞数超过50%的总细胞数则认为胚胎复苏成功)、完整胚胎复苏率(解冻后胚胎的卵裂球全部存活则称为完整胚胎复苏)、优胚率(卵裂球大小均匀、外形规整,折光正常,透明带完整,没有或碎片量少于10%)。(3)妊娠结局:记录两组妊娠结局,包括生化妊娠率(于D3胚胎移植后第11天、D5胚胎移植后第9天,检测血清hCG 水平 >10 U/L)、临床妊娠率(移植后 14 d,经检测血清hCG水平>25 U/L,移植后28 d进行B超检查显示妊娠囊或流产物中可见绒毛则为临床妊娠)、多胎率、自然流产率及分娩率。
1.4 统计学处理
本研究数据采用SPSS 26.0统计学软件进行分析和处理,正态分布且方差齐性的计量资料以(±s)表示,两组比较行LSD-t检验,计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组移植日情况比较
B组移植日子宫内膜厚度显著大于A组,移植日血清E2水平显著高于A组(P<0.05),两组移植日血清P水平及移植胚胎数比较差异均无统计学意义(P>0.05),见表1。
表1 两组移植日情况比较(±s)

表1 两组移植日情况比较(±s)
组别 子宫内膜厚度(mm) 血清P(ng/ml) 血清E2(pg/ml) 移植胚胎数(个)A 组(n=38) 9.78±1.03 27.16±8.28 219.28±67.38 1.61±0.56 B组(n=38) 10.33±1.27 26.55±7.76 423.25±106.64 1.63±0.52 t值 2.073 0.331 9.967 0.161 P值 0.042 0.741 0.000 0.872
2.2 两组胚胎复苏情况比较
两组胚胎复苏成功率、完整胚胎复苏率、优胚率比较差异均无统计学意义(P>0.05),见表2。

表2 两组胚胎复苏情况比较(%)
2.3 两组妊娠结局比较
两组生化妊娠率、临床妊娠率、多胎率、自然流产率及分娩率比较差异均无统计学意义(P>0.05),见表3。
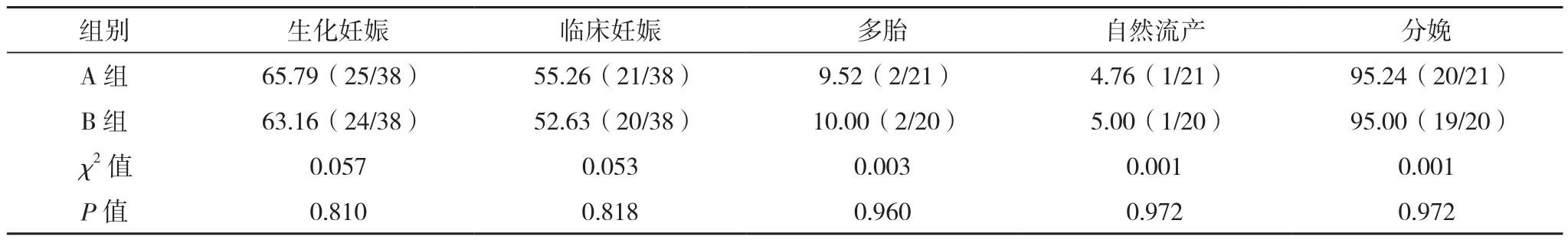
表3 两组妊娠结局比较(%)
3 讨论
随着FET技术的不断发展,其已经成为辅助生殖技术中的重要组成部分,不仅能够减轻不孕症患者多次取卵过程中的痛苦,减少取卵费用,还能够减少卵巢过度刺激综合征发生,有利于降低多胎率,提高一次取卵术后的累计妊娠率[6]。目前,人工周期及自然周期是FET中常用的内膜准备方式,其中人工周期方式以雌激素和孕激素的激素替代周期方式为主,自然周期是针对月经周期规律的患者检测子宫内膜情况,等待时机移植胚胎[7]。有学者认为,自然周期简单、方便,不需要使用GnRH-a、Gn等药物,治疗费用较少,减少药物使用给患者带来的痛苦及经济负担,且更符合生理状态及胚胎着床的生理要求,患者子宫内膜容受性好,可获得理想的妊娠率,多胎发生率较低,但存在不足之处,比如周期取消率较高[7-8]。也有部分学者认为,人工周期能够通过模拟生理状态变化让雌激素水平呈上升趋势,与内膜厚度的增加同步变化,将子宫内膜转化为接受状态,同步胚胎发育,能够获得与自然周期相似的妊娠结局[9-10]。目前,两种子宫内膜准备方案在FET技术中的应用效果尚存在争议,关于选择哪种作为方案尚无统一定论,所以通过比较两种方案对FET患者的影响,能够为临床工作提供参考依据。
本研究结果发现,B组移植日子宫内膜厚度显著大于A组,移植日血清E2水平显著高于A组(P<0.05),两组移植日血清P水平及移植胚胎数比较差异均无统计学意义(P>0.05)。两组胚胎复苏成功率、完整胚胎复苏率、优胚率比较差异均无统计学意义(P>0.05)。两组生化妊娠率、临床妊娠率、多胎率、自然流产率及分娩率比较差异均无统计学意义(P>0.05)。结果发现,FET技术治疗时采用人工周期与自然周期准备内膜,获得的妊娠结局无明显差异,但从既往研究结果可以看出,自然周期更接近人体的生理状态,对不孕症患者造成的身体损伤更小[11-12]。本研究也存在不足之处,首先笔者的研究是单中心、小样本研究,样本量较少,且样本多来自江苏徐州地区,样本量的代表性不佳,研究结果可能会存在偏差,在下一步研究中笔者将扩大样本量,开展多中心、大样本的随机对照研究,并观察两种内膜准备方案对FET结局的影响,以期进一步证实本研究结果的有效性。
综上所述,FET时采用人工周期与自然周期准备内膜的妊娠结局无明显差异,临床医生可根据患者的实际情况并综合多方面因素选择适宜的内膜准备方案,以增加患者的子宫内膜容受性,对于存在排卵障碍或月经周期不规律的患者,若无法确定患者移植时间,建议选择人工周期。

