木本植物光反应对重金属胁迫响应机制的研究进展
朱凡,雷佳奇,黄鑫浩,于志民
(湖南农业大学,湖南 长沙 410128)
快速的城市化与工业化致使土壤受到了严重的重金属污染[1],由于重金属具有毒性、持久性和累积性,在土壤之中不易降解[2],一旦达到一定浓度后,就可能威胁到人类健康,有学者总结了包括镉(Cd)、砷(As)、铅(Pb)、铬(Cr)、汞(Hg)、铜(Cu)、镍(Ni)及锌(Zn)在内的8 种重金属对人类健康的影响[3];也有学者通过研究发现,由采矿所导致的重金属污染已严重威胁到当地‘土壤-水-植物’生态系统[4]。因此,土壤重金属污染的修复与治理是一个迫在眉睫的问题[5]。植物修复技术因其经济实用、环境友好、原位修复的特点备受关注[6]。植物修复是指植物通过吸收、固定、根滤等功能,去除土壤中的重金属,或改变重金属的形态,降低其迁移性,最终达到修复污染土壤的目的[7-8],植物中能将土壤中的重金属吸收并固定于体内,且吸收的金属浓度比普通植物高100倍的则被称为超富集植物[9-10]。目前已被证实的超富集植物多为草本,如褐蓝菜Noccaea caerulescens对Ni、Zn 超富集;龙葵Solanum nigrum、油菜Brassica napus对Cd超富集;蜈蚣草Pteris vittata、凤尾蕨Pteris ensiformis对As 超富集;东南景天Sedum alfredii对Zn 超富集;商陆Phytolacca acinosa对Mn 超富集等[10-11]。但植物修复技术大规模工程不仅需要这些草本超积累植物,也需要耐性强的多年生植物,因此树木应用于土壤重金属污染的修复开始进入到人们的视野中,木本植物由于生长周期长,在各种复杂环境均拥有较大生长量,兼具经济和生态效益,具有广泛的应用前景[12-14]。
光合作用是植物获取物质和能量的基础。研究发现光合作用在重金属胁迫下的系统失调,是引起植物整体生长和产量下降的关键原因[15-16]。光合作用对重金属胁迫的响应非常复杂,特别是包含光吸收、能量转化和电子传递等阶段的光反应过程,更容易受到外界环境的干扰[16]。大量研究表明不同树种在重金属胁迫下光合适应性不同[17],不同重金属攻击的位点不同[18-19],而不同光合电子传递途径也具有保护作用[20],因此为了更好地利用木本植物去修复重金属污染土壤,本文综述了木本植物光反应过程对重金属胁迫的响应:1)重金属对木本植物光反应过程的影响,重点综述基于光合作用筛选的耐性强树种以及对光合色素系统、光系统(光系统Ⅱ(Photosystem Ⅱ,PS Ⅱ)与光系统Ⅰ(Photosystem Ⅰ,PS Ⅰ))、电子传递过程的影响;2)重金属胁迫下木本植物光反应过程的调节响应,主要是非光化学猝灭、循环电子流和水水循环等保护机制。以期从叶片光合作用的角度认识木本植物对重金属污染环境的生态适应,为重金属污染地的修复治理和植被重建提供科学依据。
1 木本植物对重金属胁迫的耐受性
长期以来,已有许多学者基于光合作用研究了木本植物对重金属的耐受性(表1),发现耐性强的树种有苦楝Melia azedarach、秋华柳Salix variegata、银 芽柳Salix leucopithecia、女贞Ligustrum lucidum、桑树Morus alba,较强的有榉树Zelkova schneideriana、栾树Koelreuteria paniculata、香樟Cinnamomum camphora、杨树、白桦Betula platyphylla、檫木Sassafras tzumu等。
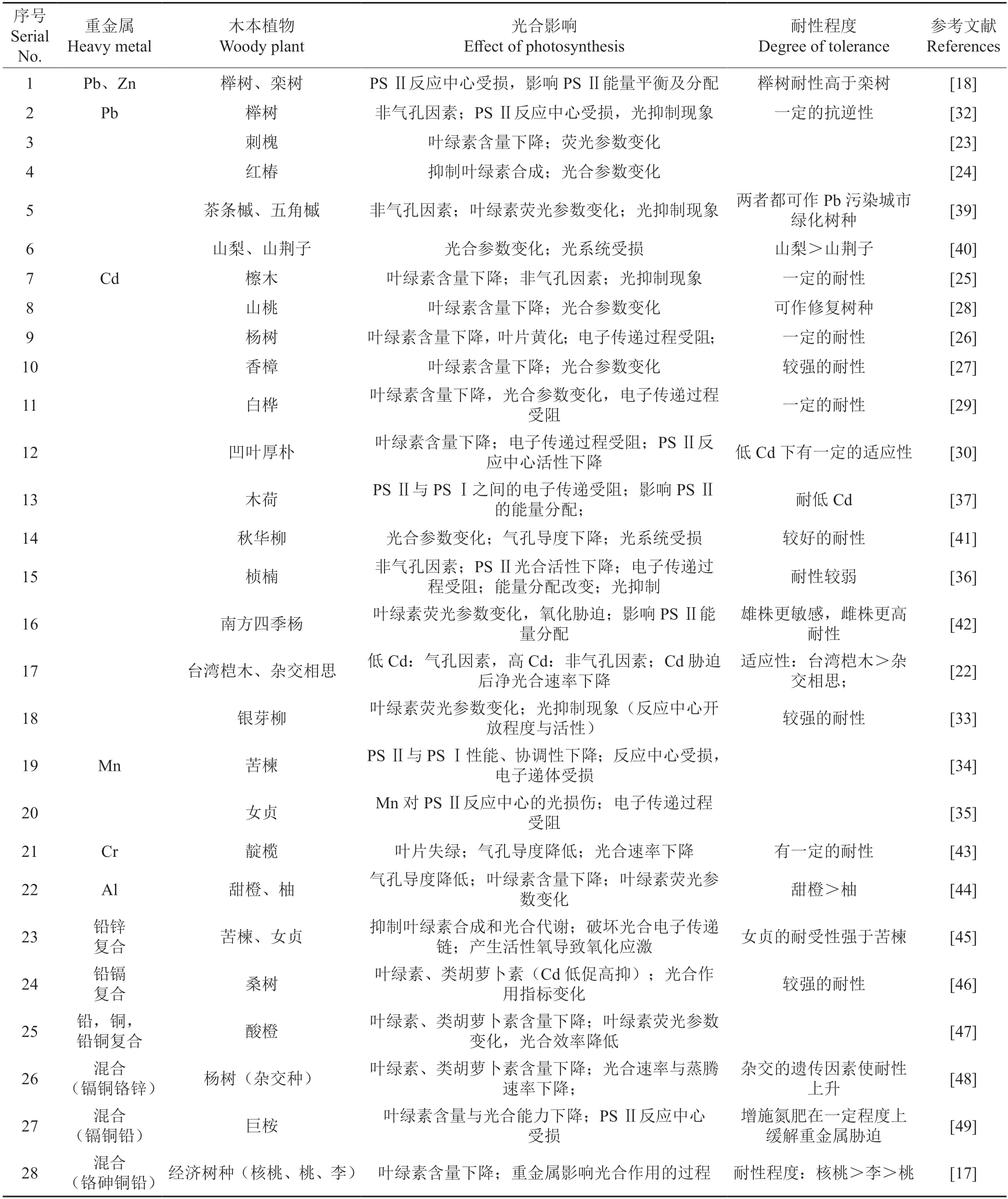
表1 基于光合作用统计木本植物对重金属耐受性的研究Table 1 Tolerance of woody plants to heavy metals based on photosynthesis
在重金属胁迫下,木本植物均表现出光合速率不同程度的下降,根据Faqruhar 和sharkeyt 的研究,胁迫环境抑制植物光合作用的原因可分为气孔因素与非气孔因素[21]。气孔因素主要是胁迫引起气孔导度下降,使CO2进入叶片受阻,导致光合速率下降[22];而非气孔因素较多,主要是由于胁迫损伤了光合机构或抑制了酶的活性,可总结为以下四点:
1)损伤叶绿体结构,影响基粒的形成以及其垛叠形式,破坏类囊体结构[23],降低光合色素含量[24-31];2)破坏光合机构,如使PS Ⅱ反应中心受损[18,32-35],降低PS Ⅱ活性[36],进而影响光化学反应;3)抑制光合电子传递,导致反应中心供体侧与受体侧电子传递不平衡,引起电子载体的过度还原,降低光合速率[26,29-30,34-37];4)使卡尔文(Calvin)循环中的一些关键酶失活,降低固定CO2的能力[38]。
2 重金属胁迫对木本植物光反应过程的影响
光合作用的光反应阶段包括光捕获、激发能转换、电荷分离、围绕PS Ⅰ与PS Ⅱ的电子传递、ATP 与NADPH 的合成等过程,主要在叶绿体的类囊体膜上进行。研究表明,重金属对植物光反应过程表现出多位点的损伤(图1A)。因为逆境会抑制植物叶片的光合速率,导致植物所捕获吸收的光能未被有效利用,造成激发能过剩,若过剩的能量未被及时清除,便会造成叶绿体中活性氧(Reactive oxygen species,ROS)的积累[50],叶绿体中过量的ROS 会抑制光合色素合成、加快光合色素降解,降低光合色素含量[51],进而影响光能的吸收、传递及转换效率[16](图1B);也会破坏蛋白质、DNA、RNA 等生物大分子,如降低蛋白质功能、加速蛋白质降解,破坏了类囊体膜上光系统复合体中的蛋白结构,致使光系统活性下降,从而抑制光反应各过程,降低植物光合速率[52](图1C)。
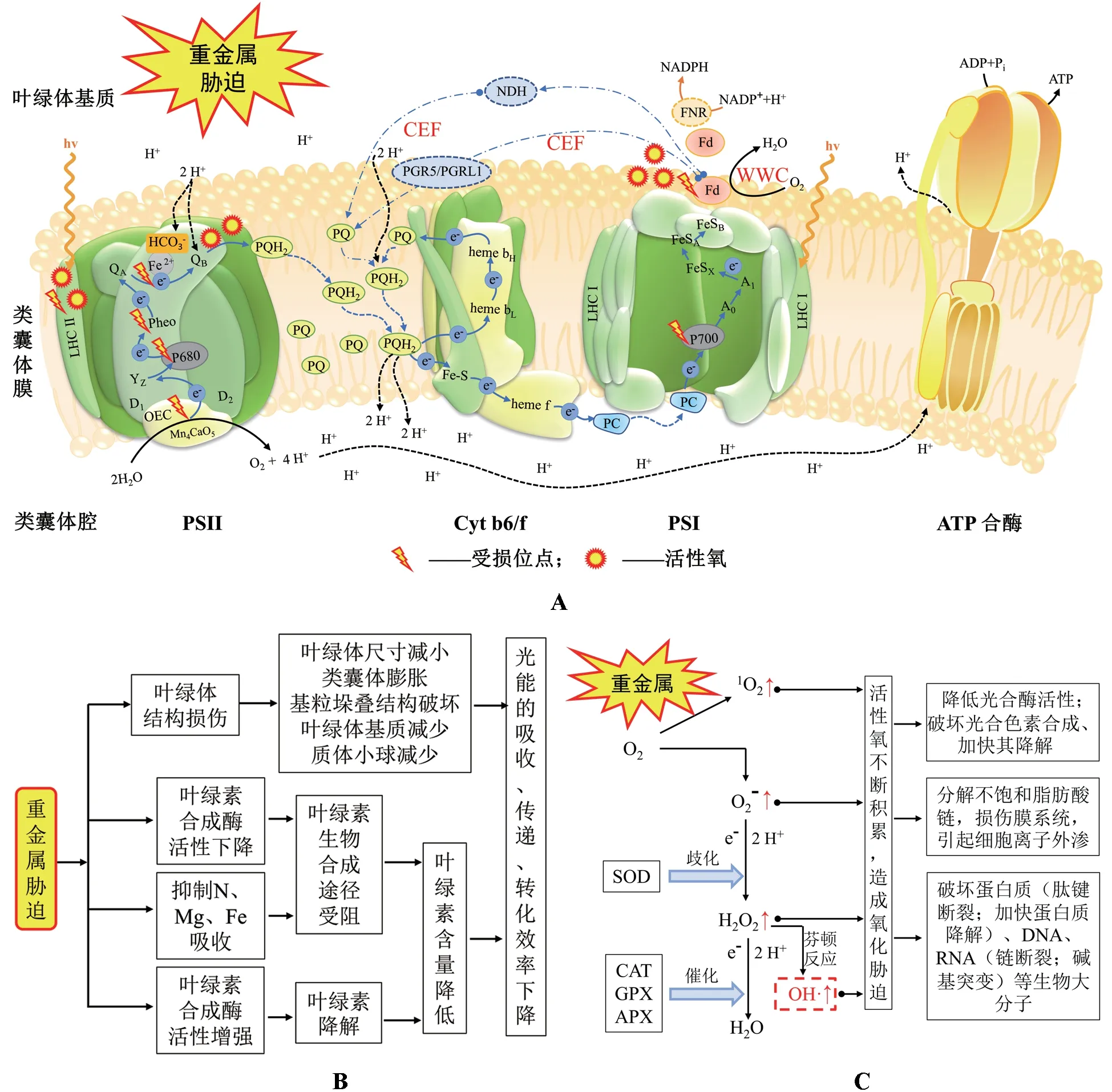
图1 重金属胁迫下的光反应过程Fig.1 The light reaction under heavy metal stress
2.1 对光合色素系统的影响
所有绿色植物都含有光合色素—叶绿素(Chlorophyll,Chl)和类胡萝卜素(Carotenoid,Car),Chl 包括叶绿素a(Chlorophyll a,Chl a)和叶绿素b(Chlorophyll b,Chl b),Car 包括胡萝卜素和叶黄素。Chl 主要进行光能的吸收与转换,Car 参与光吸收与光保护。
在重金属污染的环境中,植物叶片会发生退绿的现象[53]。研究表明重金属会影响光合色素的合成,如Cd(25 mg·kg-1)、Pb(750 mg·kg-1)复合胁迫下,显著降低了桑树光合色素含量,且程度强于单一胁迫[46]。Zhou等[23]研究Pb 对刺槐Robinia pseudoacacia幼苗光合作用的影响时,发现随着Pb 浓度的增加,叶肉细胞超微结构逐步发生改变,意味着Pb 损伤了叶绿体结构,抑制了Chl 的合成,致使其含量下降。重金属对植物的Chl 含量的影响还存在“低促高抑”的剂量效应,有研究表明在适当的Cd(20 mg·kg-1)胁迫下檫木叶片中Chl 含量有所增加,原因可能是Cd 的络合物会促使植物从土壤中吸取Mg、Fe、K、P等离子,加快叶片中卟啉环的形成[25];但高浓度重金属胁迫对Chl 合成的抑制就会制约其光合作用的正常进行[38,54]。重金属导致植物Chl 含量减少的原因,可能是Chl 中的Mg2+被Cu2+、Zn2+、Cd2+、Hg2+、Pb2+或Ni2+取代。有研究指出,重金属毒性与Chl 四吡咯环中Mg 的取代率成正比关系,这种毒性效应的大小可排列为Hg2+、Cu2+、Cd2+>Zn2+>Ni2+>Pb2+[55];或重金属取代Fe2+、Mg2+等离子或与叶绿体蛋白质的巯基(-SH)结合[56-57];也有学者认为是重金属离子影响了植物吸收矿质元素,如Cd,Cr 胁迫影响了Mn 和N 的吸收,间接抑制了Chl 的合成[26,28,58]。
Car 不仅可作为天线色素吸收光能并将其传递给Chl,还在保护Chl 和光系统方面发挥着重要作用,如Car 中叶黄素可有效猝灭光合机构吸收的过剩光能[59];它也是一类强活性的内源抗氧化剂,能有效清除叶绿体中产生的单线态氧(1O2)[60]。但重金属胁迫也会使Car 含量显著下降,且随着胁迫程度的加重,抑制作用更为明显[46],可能是因为重金属胁迫下Car 代谢期间玉米黄质环氧化酶(Zeaxanthin epoxidase,ZE)与紫黄质脱环氧化酶(Violaxanthin de-epoxidase,VDE)表达显著减少,意味着叶黄素循环与非光化学猝灭相关的能量耗散机制受到损害[38],进而引起更高程度的氧化损伤,破坏光系统结构,降低光合效率[61]。因此,Car 含量的高低也可反映植物光合机构在逆境下受损的程度[62]。
2.2 对光系统的影响
2.2.1 对PS Ⅱ活性的影响
PS Ⅱ-LHC Ⅱ超级复合体包含了由D1 和D2蛋白组成的反应中心,以及两个主要的内周天线蛋白CP43 和CP47[63],LHC Ⅱ是植物体中的捕光天线复合体,主要是与Chl b 结合[64]。PS Ⅱ复合体主要参与光合作用中光能的吸收、传递、转换,以及放氧等过程。
国内外通过研究PS Ⅱ反应中心的电子传递或能量平衡来了解PS Ⅱ活性受损状态[34,37,45],发现重金属胁迫下,PS Ⅱ反应中心会部分失活[65-66],而高浓度的重金属会导致PS Ⅱ反应中心不可逆的损伤[32-33]。这可能是由于重金属与PS Ⅱ供受体侧蛋白中的-SH 结合,破坏蛋白功能,阻扰PS Ⅱ中的电子传递,导致反应中心两侧不平衡的氧化还原状态,并产生过量的ROS攻击PSⅡ反应中心[65];还可能通过PQ 库直接损伤PS Ⅱ的功能,或通过抑制光合碳还原循环酶和ATP 含量变化的负反馈调节来间接损伤PS Ⅱ[67]。Deng等[65]认为PS Ⅱ反应中心受损主要是因为D1 蛋白的亏损、P680与Pheo 的降解,可能是因为重金属胁迫下的过量激发能导致1O2增多,干扰了蛋白质翻译的步骤,从而抑制D1 蛋白合成,破坏PS Ⅱ蛋白修复周期[68]。黄鑫浩[66]认为重金属胁迫下PS Ⅱ中心的D1蛋白的降解速度比D2 快,D1 蛋白是光损伤的主要靶点。还有研究者发现重金属会胁迫加快Chl降解,破坏PS Ⅱ-LHC Ⅱ复合体的稳定性,导致LHC Ⅱ捕光效率下降,抑制光能的吸收,影响原初光化学反应[16]。另外,重金属Cd 对PS Ⅱ活性的毒害机制也取决于光照辐射强度,高光强辐射下,Cd 会直接损伤PS Ⅱ反应中心;而黑暗时期,Cd2+会与Chl 中的Mg2+置换从而损坏LHC Ⅱ,引起PS Ⅱ活性下降[69]。在Cd 处理下的离体黑麦Secale cereale叶片中,Lhcb1 与Lhcb2 蛋白分子量减少,意味着Cd 也会通过抑制蛋白对LHC Ⅱ结构的修饰来影响LHC Ⅱ 聚集程度,进而干扰LHC Ⅱ的光保护能力,导致PS Ⅱ的光化学效率显著降低[19]。
2.2.2 对PS Ⅰ活性的影响
在PS Ⅰ复合体上,不仅含有11~12 个蛋白亚基,而且反应中心上结合着多个电子传递体,再加上原位测定技术的欠缺等原因,限制了学者们对非生物胁迫环境下PSⅠ活性及光抑制的研究。但随着活体测定技术的发展,逐渐有学者开始关注各种逆境环境下PS Ⅰ活性的响应、光抑制发生的条件以及光抑制的防御机制等方面[70-71]。
前人研究发现,在逆境下PS Ⅱ更容易发生光抑制,而PS Ⅰ在逆境下比较稳定。Bazzaz 和Govindjee 的试验表明,在Cd 处理下的离体玉米Zea mays 叶片中,其PS Ⅱ活性受Cd 胁迫的影响而显著降低,而PS Ⅰ的活性并未受到影响[72]。由于PS Ⅰ中蛋白质分布致密,PS Ⅰ复合体轻易不会受损,但当光反应过程受阻,电子传递体被过度还原时会产生ROS,如PS Ⅰ铁氧还蛋白(Fd)的过度还原,O2-在PS Ⅰ受体侧积累,破坏蛋白质结构并降低其功能,影响PS Ⅰ整体性能[73]。如Lysenko等[74]研究Cu 和Cd 处理下大麦Hordeum vulgare叶片PS Ⅰ的活性后发现,在80 μM Cd 处理下,大麦叶片的PS Ⅰ活性受到抑制,且PS Ⅰ反应中心的数量减少,可能是因为PS Ⅰ受体侧铁硫中心和叶绿醌遭受光破坏,进而导致反应中心Psa B 基因产物降解,使P700 失活[34];在80 μM的Cu 处理下,对大麦叶片PS Ⅰ的抑制主要出现在供体侧[74]。这与Deng等[65]在Hg 胁迫下铁皇冠Microsorum pteropus叶片中PS Ⅰ活性的研究结果相似。可能是重金属胁迫下PS Ⅱ中LHC Ⅱ尺寸大小发生改变,限制PS Ⅰ供体侧光吸收,进而影响PS Ⅰ光化学效率,而Parmar 和Kumari 认为Cd 会引起细胞器中铁元素的减少,可能是因为Cd抑制了根对Fe 的吸收,限制了叶绿体中Fe 的运输和Fd 的合成,进而导致PS Ⅰ复合体受损,也可能是因为长期缺铁会导致类囊体中产生ROS,会破坏铁硫蛋白及Lhca 蛋白,从而影响PS I 活性[69]。
2.2.3 对光合电子载体的影响
光合作用中通过非循环电子传递及其偶联的光合磷酸化形成同化力的过程,是类囊体膜上的两个光系统在电子传递体(PQ、Cyt b6/f、PC、Fd)的串联下协调完成。如图1A 所示,植物的光合作用对重金属胁迫表现出很高的敏感性,光合电子传递链上也具有多个重金属损伤位点,且不同重金属胁迫类型不同,受损位点也不一致。
通过快速叶绿素荧光动力学曲线可以清晰地了解胁迫下PS Ⅰ与PS Ⅱ间的电子传递变化[75]。在重金属胁迫后的OJIP 曲线中,O-J 段出现K-band意味着OEC 的失活[35],OEC 是重金属胁迫下发生损伤的首要位点,其原因可能是一些二价重金属离子会与OEC 簇中的Ca2+发生置换,导致OEC 结构变化[37](图2);Liang等[35]的研究中,Mn 胁迫之后也发现了OEC 的失活,这可能是由于Mn 的积累使Mn 在OEC 内Ca/Mn 簇的竞争中占据优势地位,影响其原本平衡状态,甚至可能导致Mn4CaO5解体。锰簇的破坏会对PS Ⅱ造成原发性的光损伤,因为胁迫阻断了OEC 与PS Ⅱ反应中心间的电子传递,极大地增加了由LHC Ⅱ所吸收光能对PS Ⅱ的损伤潜力[60]。Pb,Cu,Hg,Ni,Zn 和Al 会解离类囊体腔侧OEC 的外源多肽,取代Cl-和Mn,从而阻碍氧释放的过程[76-77]。
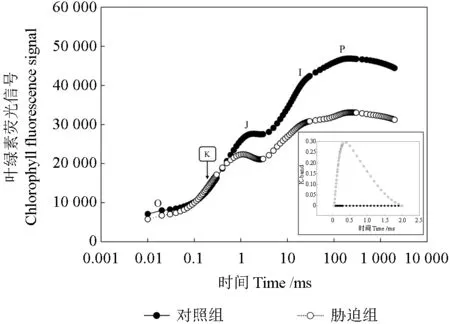
图2 重金属胁迫下快速叶绿素荧光(OJIP)瞬变Fig.2 A typical chlorophyll a fluorescence transient(OJIP curve) under heavy metal stress
重金属胁迫下OJIP 曲线中J-step 与I-step 的上升,意味着数量增多,表明重金属显著抑制PS Ⅱ受体侧电子传递,导致QA、QB过度还原,减少了活性QA、QB的数量,促使不断积累[78]。研究发现,Al 通过与QA、QB间的非血红素铁Ⅱ相互作用或置换,抑制了QA、QB间的电子转移[79];当QB下游电子传递受阻,QA、QB处累积大量电子,促使QA、QB不断还原,形成过量、QB-[35]。且有学者发现,在Mn 胁迫下,QB下游电子传递比QA、QB间电子传递受阻更严重[34],意味着Mn 会导致QA、QB过度还原并产生大量ROS 破坏光合机构,减少PS Ⅱ中活性反应中心数量[50]。Sm 是将OJIP 曲线和F=Fm 间面积标准化后所得数据,Sm 的下降表示PQ 库的尺寸变小,说明从QA处传来的电子变少,导致非还原性QA增多、QB-过量积累[37],这与PS Ⅱ受体侧QA、QB电子传递受阻结果一致。有研究报道Zn、Cu 等必需微量元素能破坏离体菠菜Spinacia oleracea的酪氨酸(TyrZ、TyrD)[80-81],但在木本植物中尚未发现重金属对酪氨酸的影响。目前重金属胁迫下光合电子的研究主要集中于PS Ⅰ与PS Ⅱ供受体侧之间电子传递效率的方面,对于其他的电子递体(如Cyt b6/f、PC)是否也在胁迫环境下受损失活目前尚未见研究报道。
3 重金属胁迫下木本植物光系统的保护机制
3.1 非光化学淬灭
非光化学淬灭(Non-photochemical quenching,NPQ),是指LHC Ⅱ将多余的激发能以“热”的形式耗散,也叫热耗散[82],是植物光保护机制中一种重要的、快速的防御措施。热耗散与LHC Ⅱ的结构变化息息相关[83],逆境下,胁迫会诱导跨类囊体膜质子梯度(ΔpH)形成,引起LHC Ⅱ质子化、紫黄质脱环氧化,使LHC Ⅱ从聚光状态转换到耗能状态,形成耗散中心,以热的形式耗散过量的激发光,其中Psb S 蛋白会增加类囊体膜的流动性,进一步促进LHC Ⅱ构象变化[84]。而依赖于叶黄素循环的热耗散也是植物抵抗光抑制的主要机制[85],主要以3 种机制来保护光合机构:1)缩短激发态叶绿素(*Chl)分子的存在周期,进而减少PS Ⅱ反应中心及LHC Ⅱ中1O2的产生;2)阻止类囊体的过度酸化和长寿命P680+的产生;3)降低PS Ⅰ还原O2的速率[86]。这一系列的耗散过程,使植物在面对胁迫环境时,能有效地通过自身调节,将过剩光能以热的形式耗散,减轻重金属对光系统反应中心的损伤程度[87]。近年来,研究者为进一步量化和区分NPQ 的过程,根据响应速度的不同,将其分为两部分,分别是快相弛豫(NPQf)和慢相弛豫(NPQs),其中NPQf也被称为能量猝灭,是一种无害的热能耗散过程,与ΔpH 诱导的叶黄素循环中,紫黄质向玉米黄质的光转化有关。NPQs是一种在黑暗中具有较慢的松弛动力学活性,与植物的光损伤或光抑制有关[88]。有研究发现,木本植物苦楝在低浓度的Zn胁迫下,NPQf高于NPQs,这表明基于热耗散的光保护反应使得苦楝的光合机构避免被损伤;但随着Zn 胁迫浓度的升高,NPQf低于NPQs,这说明无害的光保护过程已不能充分耗散多余的激发能,光系统间“满溢”的激发能只能通过NPQs耗散,损伤了苦楝的光合机构[66]。总体而言,植物在重金属胁迫下,基于非光化学猝灭的热耗散过程会被激活,使过多的激发能在到达反应中心前,通过捕光天线将过剩的激发能耗散,从而达到保护光合机构的作用。另外,这种猝灭状态的维持时间也吸引了很多研究者的关注。
2003 年,Öquist 和Huner 的一项关于常绿植物光合作用的综述中指出越冬的针叶树种会在冬季进入“持续淬灭”状态[89]。2020 年的一份研究便揭示了造成这种“持续淬灭”状态的发生机制:类囊体的垛叠形式会将PS Ⅱ与PS Ⅰ复合体混合,使PS Ⅱ与PS Ⅰ间发生直接能量传递[90]。有学者通过将拟南芥Arabidopsis thaliana野生型、stn7和tap38突变体植株与保留动态类囊体堆积但缺乏状态转换的PsaL突变体进行比较,证明了拟南芥动态类囊体堆叠和状态转换协同工作以避免PS Ⅰ受体侧限制[91]。由于重金属污染具有持久性,对木本植物的胁迫通常是长期的,因此在重金属胁迫下,木本植物是否具有这种“持续猝灭”的能力,也可以作为重金属胁迫下木本植物的光保护机制去探索。
3.2 环式电子流
环式电子流(Cyclic electron flow,CEF)是指光合电子传递链的电子在PS I 末端进入Fd 后,并未达到NADP+,而是经Cyt b6/f、PC 等复合体后又返回PS I 的循环过程。Miyake 根据电子通量大小将CEF 分为快相CEF(FCQ 与FCB,FCB 不产生ΔpH)与慢相CEF(FQR 与NDH),并表明CEF 必须在PS Ⅰ与PS Ⅱ协同作用下运行[20]。其中慢相CEF 的FQR,即PGR5/PGRL 1(质子梯度调节蛋白)途径与NDH(NDH 脱氢酶复合体)途径为CEF 主要途径(图1A)。据报道,CEF 可通过增加ΔpH,平衡ATP/NADPH、满足高效碳固定,诱导激发NPQ 保护PS Ⅱ,稳定OEC,调节LEF保护PS Ⅰ[92]。研究发现,Cd 胁迫下木荷PS Ⅰ受体侧电子还原效率增加,可能是通过PS Ⅰ的环式电子流的形式,让电子重新从Fd 回到PQ,加快PS Ⅰ受体侧处的电子还原[37],从而将累积于PS Ⅰ的电子传递给其他的电子载体,一定程度上缓解了PS Ⅰ反应中心的压力,进而维持光合作用继续高效进行。苦楝叶片在高浓度Zn 胁迫下,CEF 的光保护机制启动,随着Zn 胁迫时间的延长,低和中浓度下,CEF 也被激发,高活性的CEF 有利于ΔpH 的建立,从而诱导产生NPQ。在重金属胁迫下,CEF 对光系统的保护作用主要是下调从PS Ⅱ到PS Ⅰ的电子流,防止PS Ⅰ反应中心的过度还原,减少了类囊体膜内超氧自由基(O2-)和1O2的产生,避免ROS 攻击类囊体膜、减轻了光系统发生光抑制和光破坏的程度[92]。在干旱胁迫下,桑树的PGR5 途径和NDH 途径上电子流的显著增强也进一步说明了CEF 的激发可有效避免PS Ⅰ产生光抑制[93]。
NPQ 与CEF 两种保护机制都涉及重要因子—ΔpH,ΔpH 是调控热耗散的关键因子,CEF电子传递过程会形成ΔpH,因此在胁迫环境下NPQ 与CEF 会有机协调运转,保护PS Ⅱ、PS Ⅰ的活性与功能[66]。NPQ 与CEF 是植物在不利环境下缓解光抑制的两种主要方式,也是木本植物光合作用对重金属胁迫的调节方式,研究分析NPQ、CEF 与重金属胁迫下植物耐性体现的相关性,对于寻找耐性木本树种具有极大的理论价值。
3.3 其他机制(水水循环)
水裂解产生的电子经过PS Ⅱ到PS Ⅰ的末端Fd 后,传至O2并最终生成水的方式,称为梅勒反应,也叫水水循环(Water-water cycle,WWC)[94]。有学者指出,WWC 可以清除叶绿体中的ROS,可作为光合电子库分流PS Ⅰ末端电子促进P700再氧化、诱导非光化学猝灭并耗散多余的激发能以及供应ATP 以维持CO2的同化[20]。研究认为,逆境下植物体中高效运转的WWC 是保护光合机构免受光抑制破坏的重要机制。因为胁迫会导致光合电子传递受阻,引起电子载体过度还原形成ROS,而O2作为PS Ⅰ末端电子受体,会被氧化成继而被SOD 催化发生歧化反应,形成H2O2后继续被APX 催化形成H2O,有效抑制OH 的产生,因此WWC 在保护PS Ⅰ上有着不容忽视的功能[94]。Huang等[95]发现波动光下调节PS Ⅰ氧化还原状态在物种之间存在很大差异,如山茶Camellia japonica与蕨类植物Cyrtomium fortunei主要依赖WWC 途径实现PS Ⅰ快速氧化,可以通过分流PS Ⅰ末端电子或使O2快速光还原而实现P700 再氧化,减轻PS Ⅰ在波动光下的光损伤,这在波动光胁迫后的铁皮石斛Dendrobium officinale中也有类似结果[96]。但白芨Bletilla striata与拟南芥在波动光下发现PS Ⅰ过度还原时伴随着相对较低的ΔpH,意味着两者PS Ⅰ的氧化还原状态主要由ΔpH 调控[95]。
有学者探究了波动光下WWC 对温度的响应关系,发现WWC 在4℃时不能有效地耗散能量,导致ROS 积累[97]。在Sun等[98]的研究中也有类似结论,并表明在4℃时CEF 活性会有所增强进而补偿WWC 失活部分。Uzilday等[99]发现盐胁迫下条叶蓝芥Thellungiella parvula中编码WWC 中抗氧化酶与脯氨酸合成酶的基因上调,增强WWC中酶的活性及表达,有效地缓解了叶绿体中ROS积累,保护光合机构。但Driever 和Baker 认为,当CO2同化受到限制时,菜豆Phaseolus vulgaris与玉米叶片中WWC 不是耗散过量激发能的主要替代电子流[100]。而Cai等[101]通过假设与模拟计算,发现限制CO2同化后,山茶中的WWC 能平衡ATP/NADPH 能量需求。所以,WWC 在光合调节中的生理意义可能取决于植物种类和生长环境,重金属胁迫下木本植物叶片中WWC 缓解光抑制的生理功能也值得进一步研究。
4 结论与展望
光合作用是人类赖以生存和发展的物质基础,非生物胁迫对光合作用的影响是引起植物整体生长和产量下降的关键因素。目前关于非生物胁迫下光合作用的研究,多集中于干旱[102]、高光强[98]、波动光[103]、低温[104]、盐碱环境[105]等方面,然而光合作用特别是光反应过程对重金属胁迫的反应十分敏感,研究表明重金属对光反应过程的影响是存在多个作用位点的,主要是重金属离子可以取代叶绿素分子和PS Ⅱ放氧复合体中的基本元素,以及重金属产生的活性氧干扰了光合电子传输,造成了氧化损伤。那么,光合的调节机制如NPQ、CEF、WWC 会启动应对重金属胁迫。笔者认为NPQ 与CEF 能有效缓解重金属造成木本植物光损伤,但WWC 在木本植物应对重金属胁迫的保护程度大小有待进一步验证。另外,本研究基于光合作用的角度探知木本植物对重金属胁迫的耐受性,总结发现了如苦楝、秋华柳、银芽柳、女贞、桑树等耐性强的树种,榉树、栾树、香樟、杨树、白桦、檫木等耐性较强的树种。尽管植物光合作用对重金属胁迫反应已有广泛研究,但仍有一些问题制约人们对重金属胁迫下光反应过程的深刻认识,值得进一步研究:
1)目前多采用叶绿素荧光诱导动力学曲线研究胁迫环境下光反应过程的变化,如快速荧光动力学曲线OJIP 分析PS Ⅱ反应中心及围绕PS Ⅱ的电子传递,慢相荧光动力学曲线来分析PS Ⅱ的量子效率,但是关于在胁迫环境下关键制约因素的分子机理仍未有解释透彻,下一步需要在过剩光能耗散、电子传递分子机理上重点突破,从基因组水平确定受损的关键基因或位点。同时从光合蛋白质结构和功能入手,解析胁迫环境下植物蛋白质的构象变化和功能适应性。
2)采用建模模拟验证胁迫环境下植物光合作用过程已受到广泛关注,有学者强调正确、简化且完整的光合作用动态模型非常适合获取光合生物如何应对可变环境条件的信息[106]。因此,采用建模来模拟光合机构的运转机制及各种复杂过程,探究所研究植物在重金属胁迫下的耐性机制,也是未来研究的重点。

