垃圾焚烧炉CaO固氯反应动力学机理分析
黄声和,谢小明
(福建省特种设备检验研究院,福建 福州 350008)
根据灵动核心产业研究中心2020年公布的数据显示,至2019年底我国已正式投入运行的垃圾焚烧发电厂超600座。我国的垃圾焚烧发电厂主要集中在经济发达的华东和华南地区,其中华南地区的垃圾焚烧发电厂数量占我国垃圾焚烧发电厂总量的50%以上。这一现象表明,垃圾焚烧行业的发展与当地的经济发展有着密不可分的关系。
国家发展改革委发布的《“十四五”城镇生活垃圾分类和处理设施发展规划》[1]指出,未来15年内我国的城市垃圾资源化利用率将由目前的不足50%提高到60%,全国城镇生活垃圾焚烧处理能力与目前处理能力相比需要提高37.9%,城市生活垃圾焚烧处理能力占比需要提高到65%左右。
我国垃圾焚烧发电行业进入高速发展阶段,但是随着垃圾焚烧炉运行参数的不断提高,垃圾焚烧炉的受热面高温腐蚀现象也愈加严重。对此问题,国内外许多学者进行了大量的研究,研究表明,垃圾焚烧炉的受热面的高温腐蚀主要集中表现为氯、硫、碱金属和氧腐蚀。
在当前垃圾焚烧发电的研究中,关于抑制垃圾焚烧炉高温氯、硫腐蚀的问题是热点,其重点是对高温氯、硫腐蚀腐蚀机理以及预防措施的研究。关于钙基脱氯的研究较少,已构建的钙基固氯模型未能考虑实际固氯过程中CaO颗粒的孔隙会受吸附产物CaCl2的影响[2-5]。为了分析CaO-HCl的反应机理,使垃圾焚烧炉钙基脱氯成为可能,本文通过理论分析CaO-HCl反应的吉布斯自由能和反应平衡常数,在构建CaO固氯缩芯模型时,充分考虑CaO颗粒孔隙因吸附产物CaCl2造成的孔隙减小,并通过模拟修正的CaO固氯缩芯模型,考察分析各因素对固氯反应的影响,根据化学反应动力学规律探讨提高固氯反应速率和效果的技术途径。
1 CaO-HCl反应的吉布斯自由能
1.1 CaO-HCl反应路径
吴畏等[6]提出CaO-HCl的主要反应路径为:
CaO+HCl→CaClOH,CaClOH+HCl→CaCl2·H2O→CaCl2+H2O.
其反应简化为
CaO+2HCl→CaCl2+H2O.
1.2 CaO-HCl吉布斯自由能和反应平衡常数
(1)
式中:νf为CaO-HCl反应的生成物的化学计量数;νr为参与CaO-HCl反应的反应物的化学计量数。
CaO-HCl反应为恒温过程,则有
(2)
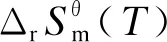
(3)
根据基尔霍夫方程、热效应与反应温度的关系,可得:
(4)
式中Cp,m为摩尔定压热容。由于Cp,m受反应温度的影响比较小,对式(4)进行整理可得
(5)
(6)
式中r为理想气体的气体常数,J/(mol·K)。
1.3 CaO-HCl反应热力学计算及结果
CaO-HCl反应化学物质CaO、HCl及生成物CaCl2、H2O的热力学常数见表1[7]。
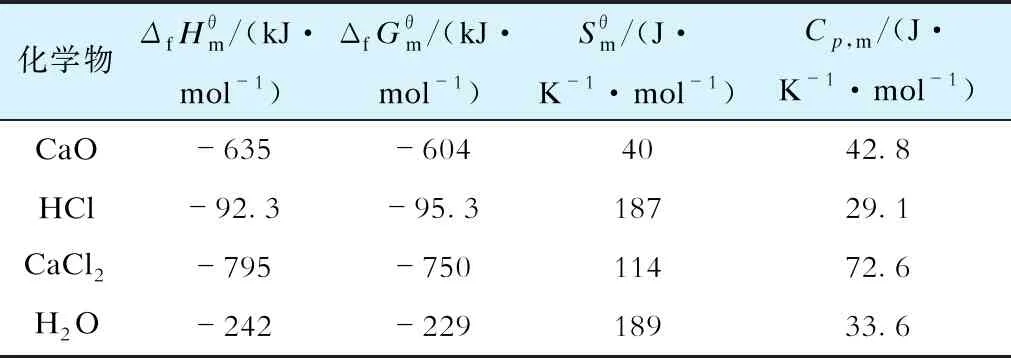
表1 热力学常数(T=298.15 K,标准状况)
基于模型计算结果可知,反应温度在800~1 200 K时,CaO-HCl反应的吉布斯自由能为-128.60~-84.20 kJ/mol,反应平衡常数为2.49×108~4.63×103。上述计算结果与万旦[8]的研究结果基本一致。CaO-HCl反应热力学计算结果如图1所示。
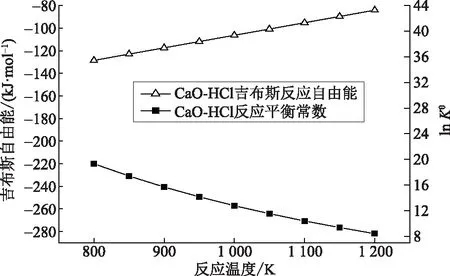
图1 CaO-HCl反应的吉布斯自由能和反应平衡常数

2 CaO固氯反应缩芯数学模型
CaO-HCl反应过程中的CaO颗粒为多孔介质,HCl气体通过传质扩散在CaO颗粒表面发生反应,反应生成的CaCl2会附着在CaO颗粒表面,形成CaCl2产物层。虽然CaCl2的分子量比CaO分子量大,但CaCl2产物不会造成CaO颗粒外径发生变化。因此,对于CaO-HCl的反应过程作如下假设:
a)反应初期CaO颗粒为规整的球体;
b)HCl气体通过CaCl2产物层传质扩散到未反应的CaO颗粒的外表面;
c)扩散的HCl气体与CaO颗粒反应,反应生成CaCl2不断附着在CaO孔隙上,由于CaCl2摩尔体积更大,CaO颗粒孔隙变小;
依据上述假设,构建如图2所示的CaO-HCl反应模型,其中:cBg为烟气中HCl气体质量浓度,g/m3;cBs为CaO颗粒中CaCl2产物层表面的HCl气体质量浓度,g/m3;cBc为CaO固体颗粒孔隙内部HCl气体质量浓度,g/m3;cB为CaCl2产物层中的HCl气体通过传质扩散到CaO颗粒孔隙内部的HCl气体质量浓度,g/m3;Rc为CaO-HCl反应进行时扣除CaCl2产物层的CaO固体颗粒孔隙内部反应芯半径,m;RC为CaO-HCl反应开始时CaO颗粒原始半径,m;R为至CaO颗粒中心的距离。
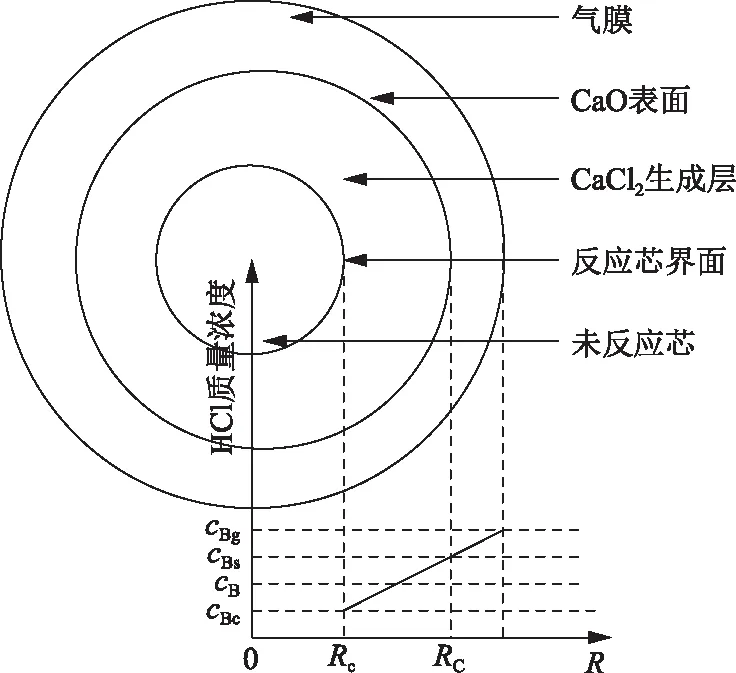
图2 CaO固氯反应动力学模型
HCl气体由烟气中传质扩散到CaO固体颗粒表面和颗粒内部的阻力不同,造成不同反应界面中的HCl气体质量浓度存在差异,其大小依次为:CaO固体颗粒周围的烟气中的HCl气体质量浓度、CaCl2产物层表面的HCl气体质量浓度和CaO固体颗粒孔隙内部HCl气体质量浓度。因此,将CaO-HCl的整个反应过程分为气膜扩散控制、灰层扩散控制和化学动力学控制。
2.1 CaO-HCl宏观反应动力学
假定CaO-HCl反应整个过程温度不变,在一定的反应时间t内HCl气体的反应速率计算如下[13]:
(7)
(8)
(9)
式中:nB1为烟气中的HCl气体通过传质扩散到CaO固体颗粒表面的CaCl2产物层表面的HCl气体的物质的量,mol;nB2为CaO固体颗粒表面的CaCl2产物层中的HCl气体通过传质扩散到CaO固体颗粒孔隙内部HCl气体的物质的量,mol;nB3为扩散到CaO固体颗粒孔隙内部的HCl气体的物质的量,mol;kg为HCl气体在CaO颗粒中的传质系数,m2/s;De为HCl气体在CaO固体颗粒中的有效扩散系数,m2/s;ks为CaO-HCl反应的表面反应速率常数,m/s。
目前,工业上采用干法脱硫的CaO颗粒粒径为微米级[14]。CaO颗粒为多孔介质,其孔隙分布为对数正态形式分布,CaO的孔隙分布大体上都是微孔孔隙(小于2 nm),孔径范围在5~20 nm[15]。烟气的HCl分子的平均自由行程λ为1×10-5cm。CaO颗粒的比表面积Sg范围在10~30 m2/g,孔容积Vg范围在0.17~0.22 ml/g[16],则CaO颗粒的孔径d0=2Vg/Sg,其范围在1.1×10-6~4.4×10-6cm。由此可知λ/d0>10,CaO-HCl的反应碰撞主要发生在HCl分子与CaO孔壁之间,这种扩散称为努森扩散。
当HCl分子与CaO反应生成CaCl2时,由于CaCl2摩尔体积更大,生成的CaCl2附着在CaO孔隙上,使CaO颗粒孔隙变小,影响HCl分子扩散。修正后的扩散系数为[17]:
(10)
(11)
式中:ε为CaO固体颗粒孔隙率;τtor为CaO颗粒孔隙迁曲度;MHCl为HCl气体相对分子质量;Dp为CaCl2产物层的扩散系数,m2/s;RV为CaO固体颗粒的孔隙半径,m;Dk为颗粒内部气体努森扩散系数,m2/s;ε0为CaO颗粒初始孔隙率;Z为CaCl2与CaO的摩尔体积比;τ0为CaO颗粒初始孔隙迁曲度;XC为反应物CaO的转化率。
在缺少抗病品种或原有抗病品种抗锈性丧失,又无接班品种的麦区,需要进行药剂防治。我国先后使用对锈病有效的杀菌剂有敌钠酸、敌锈钠、氟钡制剂、氨基碘酸钙、氟硅脲、萎锈灵、灭菌丹、代森锌等。近年主要推广三唑酮(粉锈宁)、特谱唑(速保利)等。
基于流体-固体界面的传质关系式(球形周围强对流)有
(12)
式中:dC为CaO颗粒直径,m;v0为CaO颗粒流速,m/s;μ为烟气动力黏度[18],m2/s;
根据稳态连续方程和式(8),在位置R处CaO固体颗粒表面的CaCl2产物层的内径向CaO固体颗粒孔隙内部方向取微量厚度dR,依据反应中反应物料平衡,则有
(13)
dR的数量级很小,因此忽略其对于反应的影响,根据边界条件R=RC、cB=cBs和R=Rc、cB=cBc,对式(13)进行二次积分后,再对R求导可得
(14)
由于式(14)中的cBs和cBc无法测量,对式(14)和式(7)—(9)进行整合处理以消除cBs,得到
(15)
将式(9)代入式(15),整理可以得到CaO-HCl反应中CaO颗粒固氯反应速率为
(16)
由式(16)可知,CaO颗粒固氯反应速率随着反应时间的变化而变化,所以对式(16)进行处理使之转变成关于反应时间t的函数式。
(17)
式中:nC为反应中反应物CaO物质的量,mol;MC为反应物CaO的摩尔质量,g/mol;ρC为反应物CaO的密度,mol/m3。
将式(17)代入式(16),整理可得
(18)
式(18)即为CaO-HCl反应的宏观速率方程式,反应开始的初期反应条件为:t=0,R=RC。对式(18)进一步整理可得:
(19)
将CaO-HCl反应开始时的初期反应条件代入式(19),整理可得
(20)
反应物CaO的转化率
(21)
整理式(20)、(21)可得
(22)
2.2 气膜扩散控制
当HCl气体从烟气中扩散到CaO固体颗粒表面的扩散阻力远远大于其他阻力时,cBg≫cBs,该过程属气膜扩散控制。CaO固氯反应为可逆反应,有cBs≈cBc≈cBe(cBe为反应温度下的平衡浓度)。外扩散时ks≫kg,De≫kg。忽略式(21)、(22)右边的第1项和第3项,整理可得
(23)
2.3 灰层扩散控制
当HCl气体从烟气中扩散到CaO固体颗粒表面的扩散阻力和HCl气体在CaO颗粒孔隙中的扩散阻力远小于HCl气体在CaO颗粒表面的CaCl2产物层中的扩散阻力时,De≤kg,De≤ks。忽略式(21)、(22)右边的第1项和第2项,整理可得
(24)
2.4 化学动力学控制
当HCl气体的速率较大,CaO颗粒表面的CaCl2产物层和CaO颗粒的孔隙很大时,CaO-HCl化学反应阻力远比其他过程大,此时,De≥ks,ks≤kg。忽略式(21)、(22)右边的第2项和第3项,整理可得
(25)
3 CaO-HCl反应模型计算结果
3.1 宏观反应控制
CaO-HCl宏观反应模拟结果如图3、4所示。
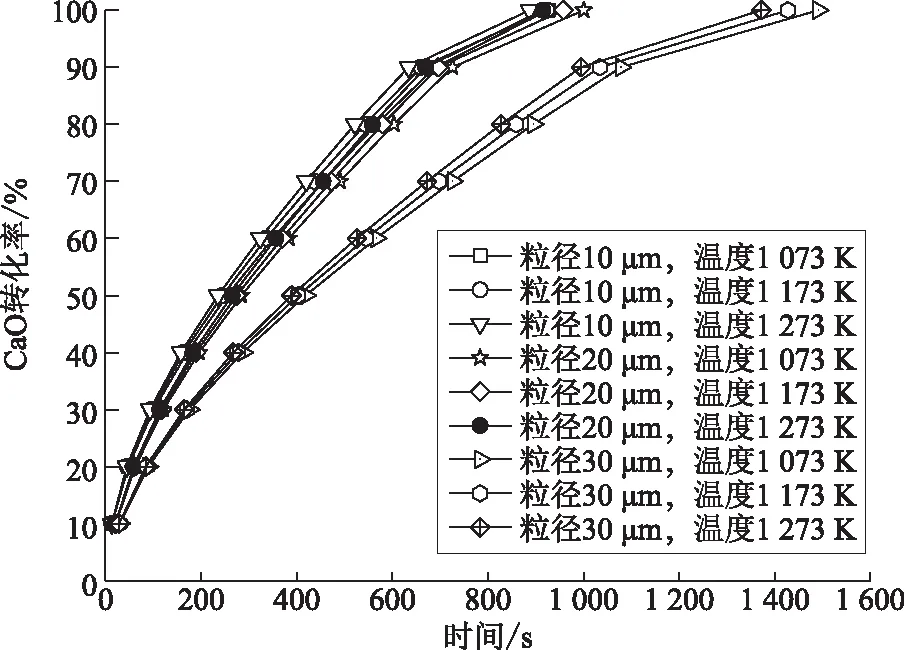
图3 温度、CaO粒径对CaO转化率的影响
由图3可知,减小CaO的粒径对CaO转化率的提高幅度很大,例如在反应温度1 073 K、反应时间600 s、CaO的粒径由30 μm减小到10 μm时,CaO转化率由63%提高到82%。在反应时间方面,CaO转化率随反应时间的增加而增加,但在反应初期增加较为明显,反应温度的提高对于CaO转化率的影响较小。该模拟结果与文献[19]的结果一致。
由图4可知,反应温度的提高对CaO转化率的影响较小。根据阿伦尼乌斯理论、活化能与化学反应临界能关系及微观可逆性原理,CaO转化率随反应温度的提高而增加,温度的提高能同时提高反应速率和HCl气体通过CaCl2产物层的扩散速率。但在计算温度范围内,随着反应温度提高,CaO转化率的提高幅度不是很大。在反应时间方面,CaO转化率随反应时间的增加而增加,但是随着反应进程的深入,CaO-HCl反应逐渐变缓。这是因为反应初期HCl气体通过CaO颗粒孔径扩散的阻力较小,随着反应的进行,HCl分子与CaO反应生成的CaCl2不断附着在CaO孔隙上,使CaO颗粒孔隙变小,进而影响HCl分子在CaO颗粒内部的扩散,CaO转化率曲线变缓。这一现象在大粒径的CaO颗粒上表现的更为明显,这是因为大颗粒的孔隙更容易吸附CaCl2而被堵塞,影响固氯反应。
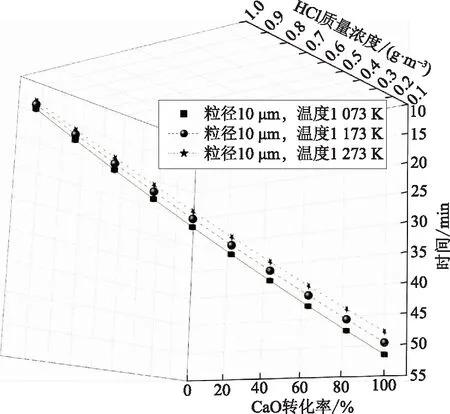
图4 温度、HCl质量浓度对CaO转化率的影响
3.2 不同温度、粒径CaO外表面固氯效果分析
基于上述气膜扩散控制动力学模型,拟合结果如图5所示。由图5可知,减小CaO颗粒粒径,有利于CaO-HCl反应,反应温度的提高对于CaO-HCl反应的影响较小。CaO颗粒粒径为10 μm和20 μm时,在相同的温度和反应时间下,CaO转化率差别不大,但是随着粒径的不断提高,CaO转化率迅速降低。这是因为影响固氯反应的主要因素是HCl分子的扩散传质,小颗粒相对于大颗粒具有更小的质量和体积,在烟气中的颗粒平均速率和与HCl分子碰撞频率均大于大颗粒,因此颗粒粒径为30 μm时,反应到470 s时,CaO颗粒转化率仅为40%。因此,在实际钙基固氯反应中,CaO粒径应尽量控制小于20 μm。

图5 温度、CaO粒径对CaO颗粒外表面转化率的影响
3.3 反应初期CaO中间区域固氯效果分析
基于上述化学动力学模型,拟合结果如图6所示。由图6可知:粒径为10 μm和20 μm时,提高反应温度,有利于提高CaO固氯效果;粒径为30 μm时,反应温度的提高对于CaO固氯效果的影响很小。减小CaO颗粒粒径有利于提高CaO转化率,相比于提高反应温度,减小CaO颗粒粒径对于CaO固氯效果的影响更大。这是因为反应初期,HCl分子通过CaO颗粒孔隙扩散到CaO颗粒内部进行反应,相对于CaO颗粒外表面,HCl分子的扩散传质系数较小,CaO粒径固氯效果同时受CaO-HCl反应速率和CaO颗粒内部HCl分子含量的影响,随着反应的进行,反应生成CaCl2不断附着在CaO孔隙上,使得CaO颗粒孔隙变小,扩散到CaO颗粒内部的HCl分子量变少,CaO-HCl反应受阻。因此,在CaO颗粒固氯反应中,CaO粒径小于20 μm、反应温度在1 073~1 273 K时,CaO颗粒固氯效果比较理想。
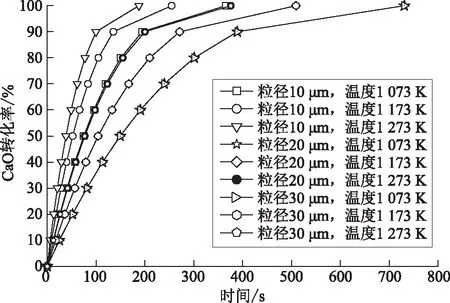
图6 温度、CaO粒径对反应初期CaO中间区域转化率的影响
3.4 反应后期CaO中间区域固氯效果分析
基于上述灰层扩散控制动力学模型,拟合结果如图7所示。由图7可知,反应温度的提高对于CaO-HCl反应的影响很小,减小CaO颗粒有利于提高CaO颗粒固氯效果。造成这一现象的原因是,随着反应的不断进行,越来越多的CaCl2产物附着在CaO孔隙上,使CaO颗粒孔隙不断变小,HCl分子在CaO颗粒内部的扩散阻力不断增加,CaO颗粒内部的HCl分子量进一步减少,即CaO-HCl反应中HCl分子不足。这一现象在大粒径的CaO颗粒上表现更为明显,这是因为大颗粒的孔隙更容易吸附CaCl2而堵塞,HCl分子扩散内部的阻力大幅增大,进而影响固氯反应。
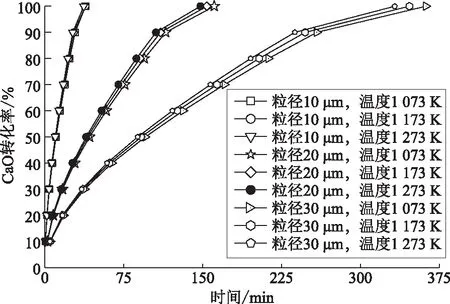
图7 温度、CaO粒径对反应后期CaO中间区域转化率的影响
4 结论
本文对CaO-HCl反应的吉布斯自由能和反应平衡常数进行理论计算,并对所构建的CaO-HCl缩芯反应模型进行修正,分析各因素对固氯反应的影响,主要结论如下:
a)CaO-HCl的吉布斯自由能和反应平衡常数的理论计算结果表明,在800~1 200 K温度范围内,CaO-HCl的反应能自发进行,800~1000 K为CaO固氯反应的理想温度范围。
b)考虑生成物CaCl2对CaO颗粒孔隙的影响,对构建的CaO-HCl反应缩芯模型进行修正,可以较好地描述固氯反应的宏观动力学,预测反应温度、颗粒粒径对固氯反应的影响。计算结果表明,CaO颗粒粒径小于20 μm、反应温度在1 073~1 273 K范围内时,CaO颗粒固氯效果较为理想。
关于SO2分子如何影响CaO颗粒固氯效果,以及烟气中HCl、SO2含量在什么范围内时可以忽略SO2对CaO颗粒固氯效果的影响,还需要进一步研究。

