纳米甲强龙脂质体对类风湿关节炎大鼠TNF-α、IL-1β和Ang-1的影响*
段卫峰,卢岩岩,张景伟
[河南省洛阳正骨医院(河南省骨科医院),河南 郑州450000]
类风湿性关节炎(rheumatoid arthritis,RA)是一种常见的自身免疫性疾病,病理表现以关节滑膜组织及血管翳增生、骨质破坏为特征,临床症状主要表现为四肢关节进展性、对称性的关节炎。本病的主要病理表现为关节滑膜细胞的异常增生,滑膜血管翳形成并逐步侵蚀关节周围结构,破坏关节软骨及软骨下骨,导致关节畸形并最终带来关节功能的丧失,严重影响患者的生活质量[1]。类风湿关节炎的发病机制尚不明确,因此临床上缺乏特异性的治疗措施,主要以改善症状、延缓关节破坏为治疗目标[2]。糖皮质激素具有强效抗炎和调节免疫效果,可快速控制RA 患者关节炎急性发作,对关节修复有一定的作用,但长期大量应用糖皮质激素会带来严重的不良反应。随着纳米技术的发展,纳米载药系统为复杂的、难治性的自身免疫或炎症性疾病的治疗带来一场新的技术革命,与传统给药方式相比,纳米载药具有靶向性、减少药物用量、提高药效、降低毒副反应等多种优势[3]。本研究旨在探讨纳米甲强龙脂质体抑制类风湿关节炎大鼠模型滑膜细胞的增殖,探讨其治疗类风湿关节炎的机制,并为该方法治疗类风湿关节炎提供理论依据。
1 资料与方法
1.1 实验动物
48 只SPF 级雌性健康SD 大鼠,6~7 周龄,体质量(150±20)g,购自河南省动物实验中心提供(许可证号:SYXK(豫)2015-0001),喂养于河南省洛阳正骨医院实验动物中心SPF 级实验室,恒温(23℃~25℃)恒湿(60%~65%)环境下喂养,自由饮用洁净饮用水及标准饲料。
1.2 实验药品和试剂
甲强龙注射液(美国Prizer Manufacturing Belgium NV),甲强龙纳米脂质体(上海舜纳生物科技有限公司),免疫源性牛Ⅱ型胶原(美国Chondrex 公司,批号:150521),完全弗氏佐剂,血管生成素1(Ang-1)ELISA 试剂盒,肿瘤坏死因子-α(TNF-α)ELISA 试剂盒,白细胞介素-1β(IL-1β)ELISA 试剂盒。高速冷冻离心机,电泳仪,电泳槽,凝胶成像仪,分光光度计。
1.3 实验方法
1.3.1 动物造模及分组 48 只健康SD 大鼠适应性喂养1 周后进行实验,随机选取10 只纳入正常组,剩余大鼠纳入造模组进行造模。造模方法选用Ⅱ型胶原诱导[4],选取适量Ⅱ型牛胶原溶液(2 mg/mL)和同等比例的完全弗氏佐剂,在冰浴环境下,均质仪充分混合均匀,并乳化至油包水状,最终制备成的乳剂中牛Ⅱ型胶原的浓度为1 mg/mL。于造模组每只大鼠尾根部皮下注射0.3 mL 该胶原乳剂,并在首次免疫后第7 天进行加强免疫,于造模组每只大鼠尾根部皮下注射0.2 mL 该免疫原。造模14 d 后,以造模组大鼠关节出现明显发红、肿胀、畸形等,即为造模成功。剔除造模未成功的模型,将造模成功的SD 大鼠采用完全随机分组法将大鼠分为模型组、纳米甲强龙(NMP)组、甲强龙(MP)组,每组10 只。
1.3.2 动物给药 自免疫第1 天开始即给药,NMP 组按照0.1 mg/kg 甲强龙纳米脂质体尾静脉注射,MP 组按1 mg/kg 甲强龙注射液尾静脉注射,正常对照组与模型组注射2 mL 生理盐水,均每天1 次,连续21 d。
1.4 观测指标
1.4.1 体质量及脏器指数观测 分别于给药前和给药第7、14、21 天使用电子秤测量大鼠体质量并记录。药物注射21 d 后处死动物,解剖分离处胸腺和脾脏并进行称重。各组大鼠的胸腺指数、脾脏指数按照以下计算公式进行计算并记录。
胸腺指数=大鼠胸腺质量(mg)/大鼠体质量(g)。
脾脏指数=大鼠脾脏质量(mg)/大鼠体质量(g)。
1.4.2 足跖肿胀度及关节炎AI 指数评分 分别于给药前和给药第7、14、21 天观测大鼠四肢关节症状,如关节红肿、畸形等表现,并拍照记录。使用足跖容积仪测定足跖肿胀程度,按照以下公式进行计算:足跖肿胀度=(Vn-V0)/V0×100%,Vn=7、14、21 d 足跖容积,V0=0 d 即造模成功当天的足跖容积。
初次免疫两周后,采用关节炎指数(arthritis index,AI)评估造模大鼠的关节红肿程度、范围以及关节肿大和变形情况,按0~4 级进行评分。0 分:关节无红肿;1 分:小趾关节有红色斑点且轻度肿胀;2 分:小趾关节及足跖关节有红斑且肿胀;3 分:踝关节以下足跖关节肿胀;4 分:踝关节及全部足跖关节肿胀。分别于给药前和给药第7、14、21 天对造模大鼠进行关节炎AI 指数评分,并记录。
1.4.3 标本采集 在大鼠造模成功后,各组大鼠目内眦取血大约2 mL。给药第21 天,腹腔注射4%水合氯醛麻醉各组大鼠,腹主动脉取血约8 mL,血样标本室温下静置1 h,2 500 r/min 离心机离心15 min,取上层血清,置于-80℃冰箱内保存。无菌条件下,取膝关节前正中切口,分离出膝关节滑膜层组织,部分组织置于脱钙液中脱钙,行HE染色。剩余部分置于-80℃冰箱内保存备用。
1.4.4 滑膜病理及免疫组化 取脱钙处理后的膝关节滑膜组织,放置于4%多聚甲醛溶液内,室温下固定24 h,梯度乙醇脱水,常规石蜡包埋,切片,常规行滑膜组织HE 染色,在高倍显微镜下观察各组大鼠滑膜微血管密度及滑膜组织病理变化情况。
1.4.5 血清TNF-α、IL-1β 和Ang-1 含量检测 于造模前、造模成功后及用药治疗后,取适量大鼠血清,严格按照ELISA 试剂盒说明书操作步骤,测定各组大鼠血清中TNF-α、IL-1β 和Ang-1 水平。
1.5 统计学方法
所有数据均采用SPSS 19.0 进行统计学处理。计量资料以均数±标准差()表示,多组间均数比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 体质量比较
给药前,各组大鼠体质量比较,差异无统计学意义(P>0.05)。给药1 周、2 周、3 周后,各组大鼠体质量均较给药前明显增加,给药2 周、3周后,模型组和给药组体质量明显低于正常组,甲强龙组和纳米甲强龙组大鼠体质量均明显高于模型组,差异有统计学意义(P<0.05)。而甲强龙组与纳米甲强龙组之间比较,差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠体质量比较(n=10,,g)

表1 各组大鼠体质量比较(n=10,,g)
注:1)与正常组比较,P<0.05;2)与模型组比较,P<0.05。
2.2 胸腺指数、脾指数比较
与正常组比较,其余各组大鼠胸腺指数、脾指数均明显升高,差异有统计学意义(P<0.05)。与模型组比较,甲强龙组和纳米甲强龙组大鼠胸腺指数、脾指数明显降低,差异有统计学意义(P<0.05);但甲强龙组与纳米甲强龙组之间比较,差异无统计学意义(P>0.05)。见表2。
表2 各组胸腺指数、脾指数比较(n=10,,mg/g)

表2 各组胸腺指数、脾指数比较(n=10,,mg/g)
注:1)与正常组比较,P<0.05;2)与模型组比较,P<0.05。
2.3 足趾肿胀度比较
与正常组比较,其余各组大鼠在初次免疫后1周、2 周、3 周足趾肿胀度明显升高,差异有统计学意义(P<0.05)。与模型组比较,甲强龙组和纳米甲强龙组大鼠2 周、3 周足趾肿胀度明显降低,差异有统计学意义(P<0.05)。甲强龙组与纳米甲强龙组之间的比较,差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠足趾肿胀度比较(n=10,,mL)
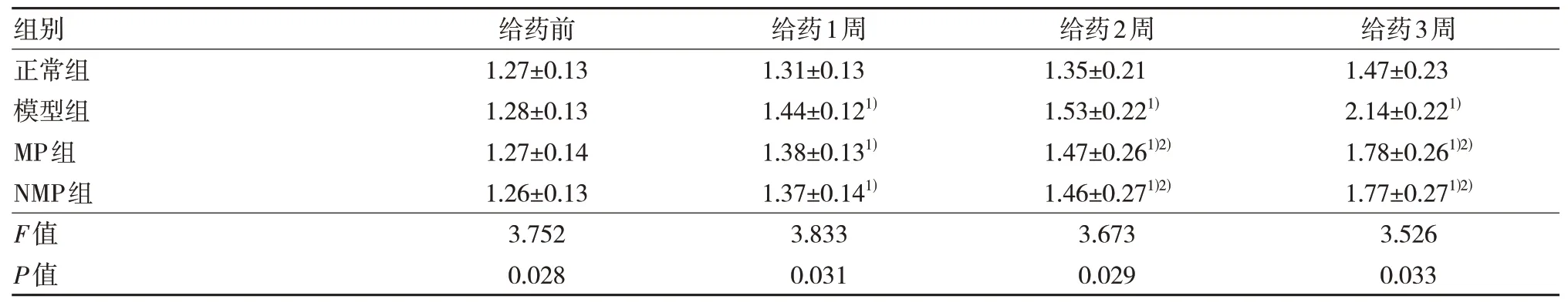
表3 各组大鼠足趾肿胀度比较(n=10,,mL)
注:1)与正常组比较,P<0.05;2)与模型组比较,P<0.05。
2.4 关节炎指数
与正常组比较,其余各组在给药前、给药1周、2 周、3 周大鼠关节炎指数明显更高,差异有统计学意义(P<0.05)。与模型组比较,甲强龙组和纳米甲强龙组大鼠在给药1 周、2 周、3 周关节炎指数明显更低,差异有统计学意义(P<0.05)。甲强龙组与纳米甲强龙组比较,差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠关节炎指数的比较(n=10,,分)
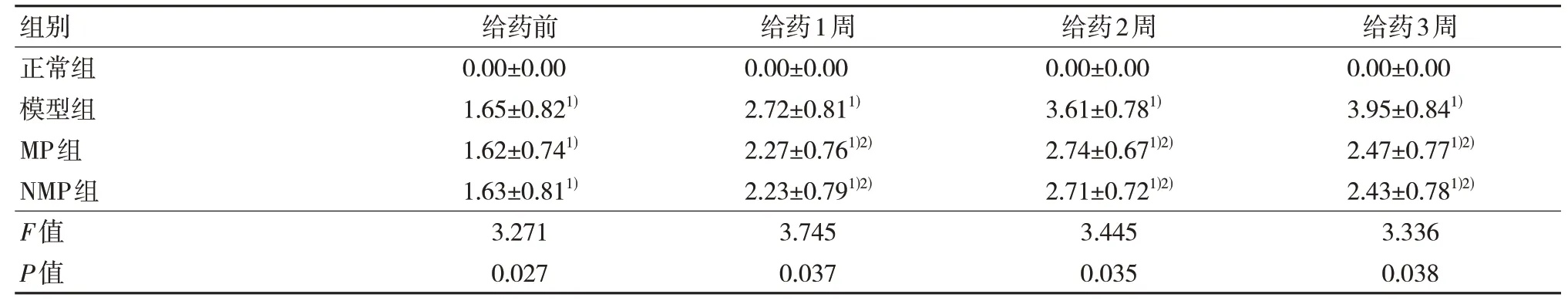
表4 各组大鼠关节炎指数的比较(n=10,,分)
注:1)与正常组比较,P<0.05;2)与模型组比较,P<0.05。
2.5 血清TNF-α、IL-1β 和Ang-1 含量比较
与正常组比较,其余各组大鼠血清TNF-α、IL-1β 和Ang-1 含量明显升高,差异有统计学意义(P<0.05)。与模型组比较,甲强龙组和纳米甲强龙组大鼠关节炎血清TNF-α、IL-1β 和Ang-1 含量明显降低,差异有统计学意义(P<0.05)。甲强龙组与纳米甲强龙组比较,差异无统计学意义(P>0.05)。见表5。
表5 各组大鼠血清TNF-α、IL-1β 和Ang-1 含量的比较(n=10,,pg/mL)

表5 各组大鼠血清TNF-α、IL-1β 和Ang-1 含量的比较(n=10,,pg/mL)
注:1)与正常组比较,P<0.05;2)与模型组比较,P<0.05。
3 讨论
在过去的20 年中,RA 的治疗革命已经开始,在疾病早期通过规范化治疗可取得良好的治疗效果,在缺乏正规治疗或失去最佳治疗时机的情况下,疾病可发展为严重的关节畸形、功能丧失,甚至致残。由于RA 的发病机制尚未完全明确,临床治疗上还缺乏特异性、针对性的方案。目前治疗RA 的主要目标就是控制及延缓症状,预防关节破坏、关节功能的丧失。根据欧洲抗风湿病联盟最新发布的指南,强调了疾病早期干预在类风湿关节炎治疗中的重要性[5]。
糖皮质激素(GC)是目前作用最强的抗炎药物,用于治疗RA 至今已有60 余年历史,具有强效的抗炎和调节免疫的功效,可快速控制RA 急性发作,改善RA 临床症状,对关节修复有一定的作用,降低系统损害的风险,是治疗RA 的一线药物。糖皮质激素通常用于缓解急性疼痛,但随着身体逐渐适应,此类药物可能变得耐受或无效。同时,长期高剂量应用会增加骨质疏松、心脏病、糖尿病和肥胖的风险[6-7]。副作用的出现极大地限制了糖皮质激素药物在RA 治疗中的应用[8],目前针对糖皮质激素副作用的方法通常包括药物替代治疗、改变剂量或对症治疗。近年来,具有主动/被动地靶向炎症部位的纳米制剂引起了大家的关注,纳米制剂的表面积和纳米尺寸的改变产生了有益的物理和化学性质,以获得更好的药理活性。纳米材料药物递送系统克服了传统药物水溶性差、生物利用度低以及在体内非特异性分布的问题,从而提高药物效率和治疗活性[9-10]。纳米材料药物递送系统可以通过靶向配体的表面修饰来实现主动靶向性,将药物输送到靶区,对病变部位产生特有的各种刺激,甚至可以添加造影剂来监测其生物分布、药物累积或治疗效果。
脂质体是一种新型有效的纳米载药传递系统,它是一种厚度为5~7 nm、直径为25~500 nm 的人工膜,具有良好的生物相容性,可以提高药物的靶向率,减少非特异性扩散,并易于对其进行合理修饰。ALDAYEL 等[11]采用酸敏感脂质体纳米复合物,对TNF-α siRNA 的负载率超过90%,实时成像系统证实该药物具有良好的靶向性和释放特异性。SONG 等[12]报道了负载靶向巨噬细胞IL-1β 的siRNA 脂质聚合物杂化纳米颗粒治疗大鼠类风湿模型,结果表明,经尾静脉注射后,FS14-NP/siRNA 将在巨噬细胞中迅速积聚,并降低巨噬细胞中炎性细胞因子的表达,显著降低脚踝肿胀、骨侵蚀和软骨破坏的程度。因此我们设计了负载甲强龙的脂质体纳米载体,对Ⅱ型胶原蛋白诱导的CIA 大鼠模型进行静脉注射,检测模型大鼠血清TNF-α、IL-1β 和Ang-1 含量检测,观察该脂质体对RA 的治疗作用。
多种炎症细胞(如CD4 辅助性T 细胞、B 细胞、树突状细胞、巨噬细胞和肥大细胞)的浸润和激活,以及基质金属蛋白酶和细胞因子(如肿瘤坏死因子TNF-α、IL1、IL6)的释放,在RA 的发生中起主要作用[13]。TNF-α、IL-1β 具有较强的促炎活性,参与多种免疫应答,可诱导多种促炎介质,如细胞因子和趋化因子,通过NF-κB 通路激活内皮细胞,调节血管新生因子的繁殖,为各类炎性介质提供充足的氧,促使炎症反应的快速进展[14]。IL-6 是一种多效性细胞因子,IL-6 表达升高导致多种自身免疫性和炎症性疾病的发生,可刺激中性粒细胞迁移,促进破骨细胞和血管内皮生长因子(VEGF)生成,诱导炎性细胞浸润,从而导致关节滑膜炎症,进而形成关节破坏[15]。而TNF-α 和IL-6 受体阻断剂,则可阻止相应通路,抑制炎症因子释放和破骨细胞生成,从而减缓RA的骨破坏[16]。本实验结果表明,甲强龙和纳米甲强龙脂质体均可显著降低CIA 大鼠足跖肿胀度和踝关节AI 评分,降低血清中TNF-α、IL-1β 和Ang-1 水平,该作用的发挥可能是通过阻断NF-κB通路,减少促炎因子释放,抑制滑膜血管新生完成的,但纳米甲强龙用量更少,且靶向性、安全性更高。
综上所述,负载甲强龙的纳米脂质体载药系统可显著减轻CIA 模型大鼠炎症反应,缓解关节局部肿胀症状,其可能的作用机制与抑制滑膜组织中NF-κB 信号通路的激活有关。纳米载药系统可显著减少药物用量,减少毒副作用,同时还可负载靶向RNA 制备复合载体,更加准确的将药物传递至病变部位,实现精准医疗,也为治疗RA 提供了一个新的思路和方法。

