PTEN C末端对鼻咽癌细胞迁移及增殖能力的影响
张军军,梁乐平
(空军军医大学唐都医院耳鼻喉科,陕西 西安 710038)
人类第10号染色体缺失与磷酸酶和张力蛋白同源基因(gene of phosphate and tension homology deleted on chromsome ten,PTEN)作为一个重要的抑癌基因,其编码的蛋白具有脂质磷酸酶和蛋白磷酸酶活性[1]。PTEN具有多种突变形式:PTEN C124S是PTEN磷酸酶区域124位点发生点突变,使得半胱氨酸成为丝氨酸,从而导致编码的PTEN蛋白缺失脂质磷酸酶和蛋白磷酸酶活性;PTEN G129E为129位点的点突变,导致甘氨酸转变为谷氨酸,该突变体编码蛋白的脂质磷酸酶活性消失,仅保留蛋白磷酸酶活性;PTEN Y138L是138位点的突变导致络氨酸转变为半胱氨酸,该突变体编码蛋白仅具有脂质磷酸酶而缺乏蛋白磷酸酶活性;PTEN 1-353是保留PTEN的双重磷酸酶活性而缺乏C末端的突变体[2-3]。据文献报道,PTEN蛋白可分为以下部分:PB区域(PIP2-binding domain,PBD)、磷酸酶区域(phosphatase domain,PD)、C2结构域(C2 domain)以及C末端(C-tail)结构。其中,PD区是PTEN蛋白的磷酸酶活性功能区,是发挥抑癌功能的重要部位。C2结构域介导PTEN与质膜的结合。C末端调节PTEN与其他蛋白的结合[4-5]。PTEN 1-353具有PTEN的PD区域,但因缺乏C末端,其对PTEN PD区的抑癌能力是否产生影响,鲜见报道。众所周知,PTEN通过其PD区抑制鼻咽癌细胞的转移和增殖能力[6],为了解PTEN C末端是否也参与鼻咽癌细胞上述功能的调节,本研究在鼻咽癌细胞5-8F和HONE1中转染PTEN WT(野生型)和PTEN 1-353(突变体),应用Transwell实验及CCK-8(cell counting kit-8)法细胞增殖实验,探讨PTEN C末端对于鼻咽癌细胞迁移及增殖能力的影响。
1 材料与方法
1.1 主要材料
鼻咽癌细胞株HONE1、SUNE1、CNE1、CNE2、5-8F和鼻咽上皮细胞NP69来源于南方医科大学肿瘤研究所。RPMI 1640培养基和胎牛血清、双抗均购自BI公司;胰酶、D-Hanks等试剂均自行配制。Lipofectamine 2000购自Invitrogen公司;TGF-β1购自Proteintech公司;蛋白裂解液RIPA Lysis buffer(Strong)购自翌圣生物科技(上海)股份有限公司。阴性对照(NC)和PTEN WT、PTEN 1-353质粒购自美国Addgene公司。CCK-8试剂盒购于东仁化学科技(上海)有限公司。培养瓶、培养皿、6孔板、24孔板以及96孔板、Transwell小室等来自美国Corning公司和Crystalgen公司。逆转录试剂盒来自于PrimeScript®RT reagent Kit with gDNA Eraser、荧光定量PCR试剂盒SYBR®Premix Ex TaqTM均购于TaKaRa公司。PCR引物应用Primer 5软件进行设计,经Oligo 7进行比对评分后,由广州艾基生物技术有限公司合成。Western blot、BCA蛋白浓度测定试剂盒购自Thermo Fisher公司。内参GAPDH抗体购于Bio-world公司,PTEN抗体购于CST公司。
1.2 细胞培养
将5种人鼻咽癌细胞系及NP69置于含有5 ng/mL TGF-β1(实验前按说明书配制)的RPMI 1640培养基(6~8 mL,含10%胎牛血清)中进行细胞培养。培养箱条件设置为:37℃,CO2及湿度适宜。选择细胞汇合度80%~90%及生长状态良好的细胞用于后续实验。
1.3 荧光定量PCR检测鼻咽癌细胞中PTEN mRNA的表达水平
当各鼻咽癌细胞及永生化鼻咽部上皮细胞的汇合度达90%左右时,提取细胞总RNA进行实验。具体过程如下:按SYBR®Premix Ex TaqTM说明书,以逆转录反应获得的cDNA为模板,GAPDH为内参。检测上述细胞中PTEN mRNA的相对表达水平,引物序列如下:GAPDH,正向5′-ATGGGGAAGGTGAAGGTCGG A-3′,反向5′-TTACTCCTTGGAGGCCATGTGGG-3′;PTEN,正向5'-TGACCAGGGATGAGACCAAC-3′,反向5′-CAGCACATCCTTGGTATGGC-3′。配制如下反应液:在10μL SYBR®Premix Ex TaqTM中加入0.4μL正向引物、0.4μL反向引物、1μL总RNA,再加入ddH2O,调整反应液总体积为20μL。在避光条件下配制上述PCR反应液,注意须在冰上进行,轻轻混匀离心后,使用PCR反应仪(Bio-Rad)进行荧光定量PCR反应。根据引物的退火温度及产物长度设置反应条件如下:95℃、30 s,95℃、5 s,55℃、30 s,72℃、1 min,共40个循环。检测各反应孔的CT值,重复3次,无模板对照以DEPC水为模板。应用2-ΔΔCT法计算数据。
1.4 细胞瞬时转染
为验证PTEN C末端对鼻咽癌细胞迁移及增殖能力的影响,需将NC、具有C末端的PTEN WT及不具有C末端PTEN 1-353质粒转染5-8F和HONE1细胞。瞬时转染过程如下:收集对数生长期的5-8F和HONE1细胞接种于6孔板,当细胞汇合度达70%左右时,按Lipofectamine 2000说明书分别将质粒NC、PTEN WT和PTEN 1-353转染至上述两种细胞,待转染48 h后,利用Western blot验证转染效率,并进行Transwell实验及CCK-8法细胞增殖实验。
1.5 Western blot实验检测质粒在鼻咽癌细胞中的转染效果
选择生长状态良好的5-8F和HONE1细胞,用胰酶消化约3 min后,进行离心、计数、铺板,待48~72 h后提取细胞总蛋白。利用BCA试剂盒测定蛋白浓度,依照标准曲线公式,算出各蛋白样品的浓度。将5×加样缓冲液及RIPA裂解液加入蛋白抽提物中,配成等体积样品以保证后续实验各蛋白上样量相同,95℃以上变性5 min。常规电泳、转膜、孵育抗体(包括一抗、二抗)后,按照GAPDH和PTEN蛋白相对分子质量裁剪不同的条带在曝光仪中显影。利用ImageJ测定不同条带灰度值,重复3次并统计结果。
1.6 Transwell实验检测PTEN C末端对鼻咽癌细胞迁移的影响
收集转染质粒NC、PTEN WT及PTEN 1-353的5-8F和HONE1细胞,制备成1×106个/mL的重悬液接种于Transwell小室,待24 h后,将小室用甲醇固定10 min,按照Giemsa染色试剂盒提供的说明书染色,清洗小室后封片,并在显微镜下统计结果。实验重复3次。
1.7 CCK-8法细胞增殖实验检测PTEN C末端对鼻咽癌细胞增殖的影响
收集转染质粒NC、PTEN WT及PTEN 1-353的5-8F和HONE1细胞,配制成单细胞悬液,用计数板在显微镜下计数细胞,按1.5×104个/mL的浓度加入96孔板中,每株细胞设3个实验组,分别为阴性对照组(NC),转染PTEN WT及PTEN 1-353组,每组设5个复孔(分别于第0、1、2、3、4天各测1次吸光度值),并设1个仅有细胞培养液的空白对照组。按照CCK-8试剂盒说明书,每孔加入CCK-8试剂10μL,孵育4 h后终止培养,避光振荡10 min,使结晶充分溶解。使用酶标仪,选择450 nm波长,检测各孔D(450)值,并以此绘制各组细胞的增殖曲线。
1.8 统计学方法
采用SPSS 20统计软件进行数据分析。PTEN mRNA的表达水平、Western blot条带采用ImageJ测定灰度值、Transwell实验的计数结果,均采用两独立样本的t检验。细胞增殖实验结果采用One-way ANOVA检验分析,组间比较采用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 PTEN WT及PTEN 1-353在鼻咽癌细胞中过表达
我们采用荧光定量PCR实验检测了鼻咽癌细胞系HONE1、SUNE1、CNE1、CNE2、5-8F以及鼻咽上皮细胞NP69中PTEN mRNA的表达水平,如图1所示,可见上述5种鼻咽癌细胞株中PTEN mRNA表达明显低于NP69细胞(P<0.01)。
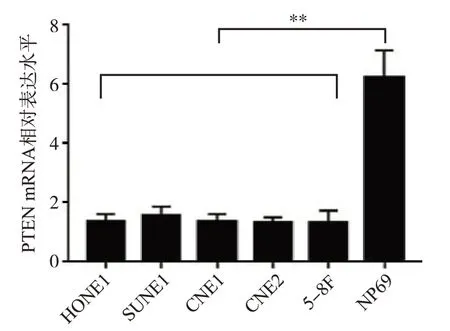
图1 荧光定量PCR法检测鼻咽癌各细胞株中PTEN mRNA的表达情况
由此可见,PTEN mRNA在鼻咽癌细胞中的表达水平较低。因此,我们将PTEN WT和PTEN 1-353质粒分别转染5-8F和HONE1细胞,拟获得PTEN高表达的鼻咽癌细胞。转染后的细胞采用Western blot实验进行验证,结果见图2,可见与阴性对照组比较,转染PTEN WT和PTEN 1-353质粒的两种鼻咽癌细胞PTEN蛋白表达水平均显著增加(P<0.01)。
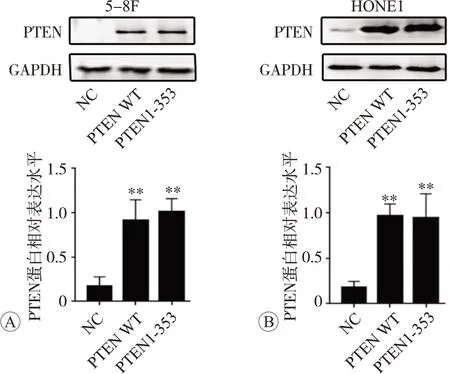
图2 Western blot法验证在5-8F和HONE1细胞中瞬时转染PTEN WT及PTEN 1-353的效率
2.2 PTEN C末端不能调节鼻咽癌细胞的迁移能力
为了明确PTEN C末端是否参与鼻咽癌细胞的迁移过程,我们在5-8F和HONE1细胞中,瞬时转染NC、PTEN 1-353和PTEN WT质粒48 h后,在5 ng/mL的TGF-β1刺激下,进行Transwell实验。结果如图3所示,PTEN 1-353、PTEN WT组与NC组相比,可以明显抑制鼻咽癌细胞的迁移能力(P<0.01),但缺乏C末端的PTEN 1-353和具备C末端的PTEN WT的抑制能力并无明显差异(P>0.05)。因此,我们认为PTEN C末端结构可能未参与鼻咽癌细胞的迁移过程。
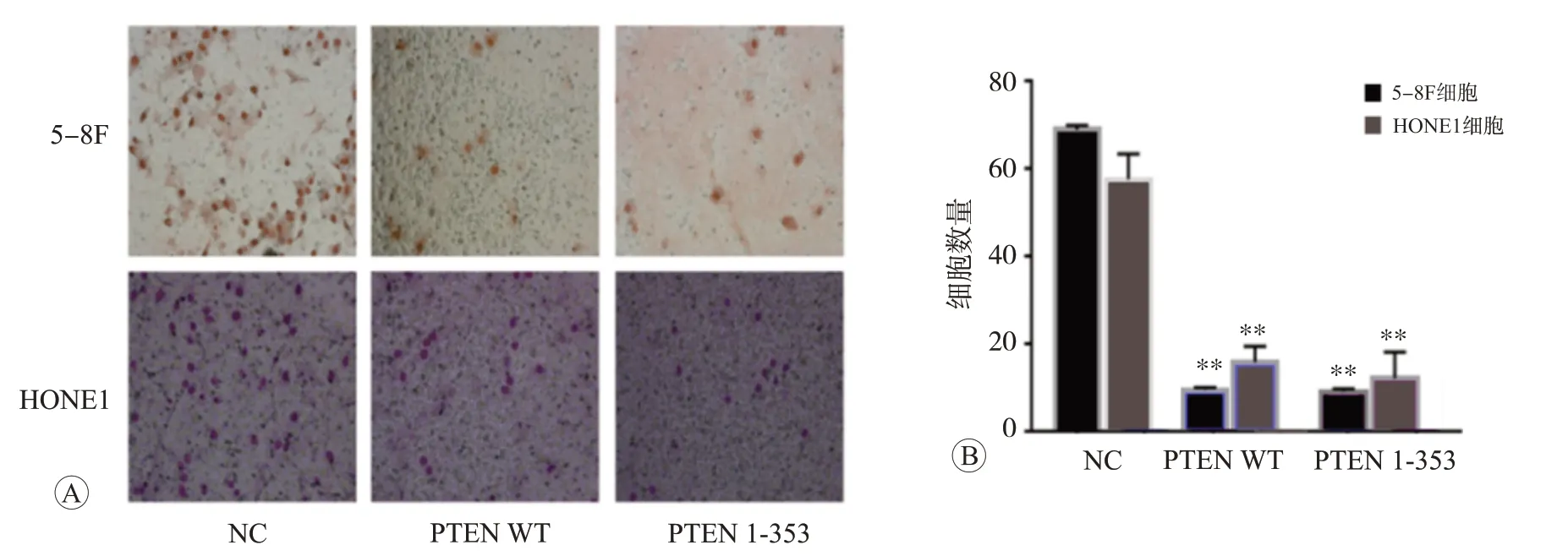
图3 Transwell实验检测分别在5-8F和HONE1细胞中瞬时转染质粒NC、PTEN WT和PTEN 1-353后鼻咽癌细胞的迁移情况
2.3 PTEN C末端可能参与鼻咽癌细胞的增殖过程
为了明确PTEN C末端是否参与鼻咽癌细胞的增殖过程,我们在HONE1和5-8F细胞中,瞬时转染NC、PTEN 1-353和PTEN WT质粒48 h后,在5 ng/mL的TGF-β1刺激下,进行CCK-8法细胞增殖实验。结果如图4所示,相比于NC组,缺乏C末端的PTEN 1-353突变体和具有C末端的PTEN WT均可以抑制鼻咽癌细胞的增殖(P<0.05)。但PTEN 1-353组与PTEN WT组相比较,PTEN 1-353抑制鼻咽癌细胞增殖的能力比PTEN WT减弱,差异具有统计学意义(P<0.01)。因此,PTEN C末端可能影响了鼻咽癌细胞的增殖过程。
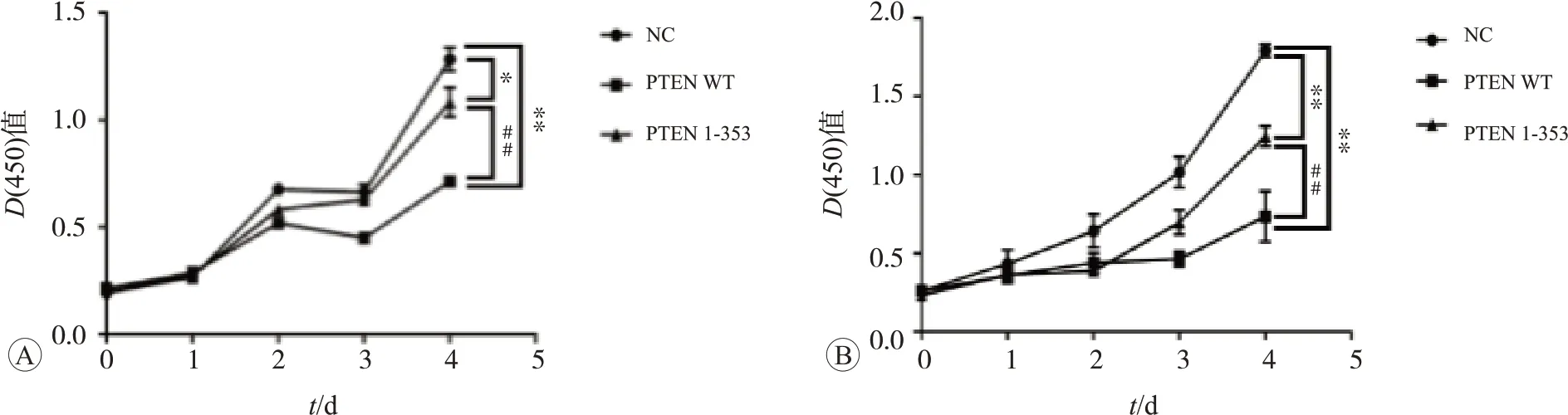
图4 CCK-8法细胞增殖实验检测瞬时转染质粒NC、PTEN WT和PTEN 1-353后鼻咽癌细胞的增殖情况
3 讨论
鼻咽癌是我国常见的头颈部恶性肿瘤之一[7],而PTEN蛋白依赖于PD区域可以调控PI3K/AKT等信号通路,影响鼻咽癌细胞的增殖、转移、凋亡等细胞功能[8-12]。有报道称,鼻咽癌组织中PTEN蛋白的表达与肿瘤分期相关。Ⅰ期、Ⅱ期鼻咽癌患者的PTEN蛋白表达阳性率为55%,而Ⅲ期、Ⅳ期患者的阳性率仅为25.5%,这表明鼻咽癌的分期可能与PTEN蛋白的表达缺失有关[13]。另有报道称,PTEN基因突变所编码的蛋白,也与鼻咽癌的发生、发展具有非常密切的关系[14]。相比于PTEN PD区,关于PTEN C末端的报道并不多,主要集中在PTEN C末端可以调控PTEN蛋白的结构稳定性、活性以及细胞内转运[15-16]。也有研究发现,PTEN C末端的多位点(Ser380、Thr382、Thr383和Ser385)磷酸化可能调节PTEN的功能[17]。而PTEN C末端对于鼻咽癌细胞功能的影响鲜有报道。本研究通过Transwell实验发现,PTEN蛋白C末端可能不影响鼻咽癌细胞的迁移过程。通过细胞增殖实验,我们将缺失C末端的PTEN 1-353与NC、PTEN WT分别比较,发现PTEN 1-353可以抑制鼻咽癌细胞的增殖,但抑制能力明显弱于PTEN WT。换言之,PTEN C末端可能具有增强PTEN PD区域对于鼻咽癌细胞增殖的抑制能力。因此,我们推测,PTEN C末端或许影响了PTEN蛋白的活性,但是具体的机制如何,仍未可知。或许,PTEN C末端本身可能对鼻咽癌细胞的增殖能力具有一定的抑制作用;又或许,PTEN C末端可能通过调控自身蛋白的稳定性而发挥抑制鼻咽癌细胞的增殖作用,我们将在后续实验中完善。

