脱水淫羊藿素维持人尿源性干细胞干性的作用研究
张忆雪,周 明,谯英固,王呈谕,孙震晓
(北京中医药大学生命科学学院,北京 102488)
人尿源性干细胞(human urine-derived stem cells,hUSCs)是从人尿液中分离培养出的一种具有良好增殖活性和多向分化能力的细胞亚群[1]。研究表明,hUSCs具有间充质干细胞(mesenchymal stem cells,MSCs)的多种生物学特征,且取材方便、无创、成本较低,在组织修复、疾病治疗等领域均有重要的研究价值[2-5]。然而,hUSCs与其他干细胞一样,也存在随着继代培养次数的增加,细胞干性逐渐减弱的问题,一定程度上影响了hUSCs的有效应用[6]。
Bharadwaj等[7]研究发现,来自不同个体所培养的hUSCs均高表达肾脏及肾小球足细胞的特异基因和蛋白标志物,揭示hUSCs可能来源于肾脏。淫羊藿作为补肾中药的代表,具有补肾阳、强筋骨、祛风湿等功效[8]。淫羊藿苷(icariin,ICA)是淫羊藿的主要活性成分,口服后经肠道细菌分解能够产生脱水淫羊藿素(dehydrated icaritin,DICT)等多种代谢产物[9-10]。研究发现,DICT能够有效促进骨髓间充质干细胞成骨分化,修复裸鼠临界性颅骨缺损[11-12]。此外,基于课题组前期利用中药系统药理学(traditional Chinese medicine systems pharmacology,TCMSP)数据库和分子对接技术对维持hUSCs干性的小分子化合物进行筛选所得到的结果来看,DICT可能具有潜在的维持hUSCs干性的作用(数据未发表)。因此,本研究以hUSCs为研究对象,探讨DICT对其干性的影响,为后续开展hUSCs相关研究与应用奠定基础。
1 材料与方法
1.1 药品
脱水淫羊藿素,纯度≥99%,购自上海源叶生物科技有限公司(批号YA0903SA13)。
1.2 主要试剂与仪器
角质细胞无血清培养基(keratinocyte serum free medium,KSFM)培养基、高糖-DMEM培养基、胰岛素-转铁蛋白-硒(ITS)细胞培养添加物购自Gibco公司;Ham’s F12培养基购自Corning公司;青霉素-链霉素购自Amresco公司;胎牛血清购自Biological Industries公司;人表皮生长因子EGF购自美国Peprotech公司;胰蛋白酶、乙二胺四乙酸二钠(EDTANa)购自北京拜尔迪生物科技有限公司;四甲基噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)购自北京兰博利德生物技术有限公司;PE-Cy7鼠抗人CD31、PE鼠抗人CD34、FITC鼠抗人CD44、APC鼠抗人CD90抗体均购自BD Pharmingenn公司;大容量多管离心机(LXJ-IIB)购自安徽安科生物工程(集团)股份有限公司;MCO-18AIC(UV)细胞培养箱购自Sanyo公司;ECLIPSE TE2000-S倒置相差显微镜购自Nikon公司;酶标仪购自Bio-Tek公司;流式细胞仪(Beckman CytoFLEXS)购自美国Beckman公司;实时荧光定量PCR仪(QuantStudioTM6 Flex)购自美国Thermo公司。
1.3 实验方法
1.3.1 hUSCs的分离与培养无菌条件下收集健康志愿者新鲜尿液样本200~300 mL至无菌烧杯中。参照文献[13],室温下以1 000 r/min离心10 min,弃上清,用1 mL PBS缓冲液洗涤沉淀,室温下再以1 000 r/min离心5 min,弃上清,用1 mL hUSCs培养基轻柔重悬细胞后将其均匀接种在24孔板中,置于CO2体积分数为5%、37℃条件培养箱内培养,记为P0代。培养后第3天补500μL培养基,第5、6天分别半换液,之后每48 h进行一次半换液,待细胞长至汇合度为90%~100%时用胰酶消化传代。通过倒置相差显微镜观察hUSCs的细胞形态,并拍照记录。
1.3.2 MTT法检测hUSCs生长曲线及DICT对hUSCs活力的影响取生长状况良好的P2代细胞,经0.25%胰酶消化制成单细胞悬液,细胞以1 000个/孔的密度接种在96孔板中,每孔200μL培养基,设6个复孔,培养7 d。每天在铺板同一时间点前4 h更换为100μL MTT工作液,继续在CO2体积分数为5%、37℃条件下孵育4 h,弃去MTT培养基,每孔加入150μL DMSO,震荡10~15 min至MTT代谢产物蓝紫色甲瓒结晶完全溶解,用酶标仪在570 nm波长处检测吸光值,并绘制hUSCs的时间-吸光度生长曲线。DICT处理组细胞接种培养方法同上,培养24 h后显微镜下观察细胞贴壁并且生长良好时,去除培养基,分别加入含有0、0.5、1.0、1.5、2.0、2.5、3.0μmol/L脱水淫羊藿素的培养基200μL,在细胞培养箱中培养,作用时间为1~7 d。后续处理同上。按下列公式计算细胞活力。
细胞活力=D(570)DICT药物组/D(570)对照组×100%
1.3.3 流式细胞术检测hUSCs表面标志物取生长状况良好的hUSCs的P2代细胞,经0.25%胰酶消化制成单细胞悬液,PBS缓冲液洗涤重悬细胞,将细胞浓度调整为6×105个/mL,分别取200μL细胞悬液于两个5 mL EP管中,并加入小鼠抗人抗体CD34-PE、CD31-PE-Cy7及CD44-FITC、CD90-APC,4℃、避光条件下孵育30 min,再加500μL PBS缓冲液重悬细胞,室温下以300 g离心5 min,弃上清,加入200 μL PBS缓冲液重悬细胞,过滤后上流式细胞仪检测[14]。
1.3.4 实时荧光定量PCR检测干性相关基因OCT-4、C-MYC的表达经文献挖掘,与间充质干细胞干性相关的基因包括OCT-4、C-MYC、SOX2、NANOG、REX1等。Sato等[15]发现BIO能通过激活Wnt信号通路促进胚胎干细胞干性相关转录因子OCT-4、REX1和NANOG的表达,从而维持胚胎干细胞干性和自我更新能力。李佳玮等[16]发现人参皂苷Rg1能够促进骨髓间充质干细胞中OCT-4、SOX2、NANOG、C-MYC等转录因子的表达,提高细胞的干性水平。课题组前期研究表明,作为成体干细胞,hUSCs中的OCT-4、C-MYC基因表达较稳定,与其干性相关性强。因此,本研究首先选择OCT-4、C-MYC两种基因作为判断hUSCs干性强弱的检测指标。OCT-4、C-MYC与干细胞的干性维持密切相关,一般随着干细胞继代次数增加表达下降[17-19]。取生长状况较好的P4代细胞,经0.25%胰酶消化制备成单细胞悬液,细胞以1×104个/孔的密度接种于6孔板中,每组平行设置2个复孔,每孔加入1.5 mL培养基,在CO2体积分数为5%、37℃培养箱中培养24 h,倒置显微镜下观察细胞贴壁并且生长良好时,去除培养基,加入含有2.0 μmol/L脱水淫羊藿素的培养基2.5 mL,置于培养箱中培养3 d,倒置显微镜下观察细胞生物学形态,并拍照记录。先按照RNA pure Total RNA Kit说明书提取各组细胞的总RNA,再按照Evo M-MLV反转录试剂盒说明书方法将总RNA反转录为cDNA,最后进行实时荧光定量PCR(quantitative real-time PCR,qPCR)对基因表达水平进行分析。β-肌动蛋白(β-actin)基因作为内参基因。实验中所用引物的序列信息见表1。
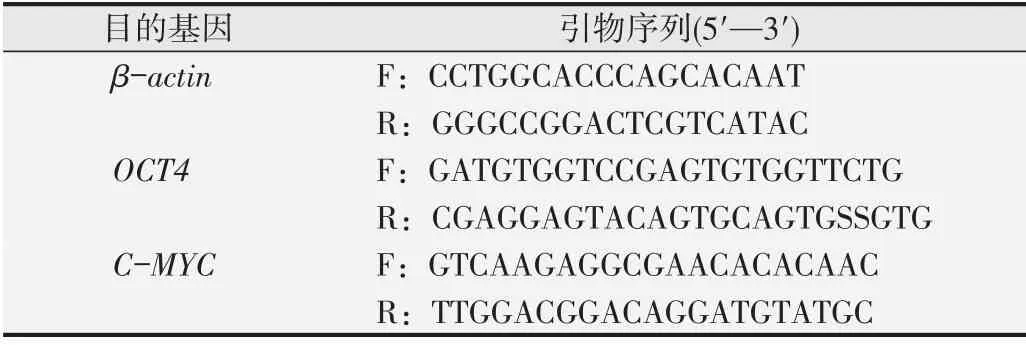
表1 引物序列信息
1.4 统计学方法
数据应用SPSS Statistics 20.0和Graphpad Prism 8软件进行统计学分析,采用t检验对两样本均数进行比较,采用单因素方差分析对多样本均数进行比较,P<0.05为差异具有统计学意义。
2 结果
2.1 原代培养及继代培养hUSCs的形态学观察
见图1。从健康志愿者新鲜尿液中分离培养的hUSCs于接种后24~72 h后开始贴壁(图1A),大约6~8 d后细胞逐渐形成集落(图1B),8~12 d后细胞开始呈克隆状生长(图1C),大约16 d后细胞扩增达到约90%~100%的汇合度(图1D)开始进行第1次传代培养,23 d后P2代细胞仍保持活力,形态呈饱满的梭形(图1E),35 d后P4代细胞形态仍保持良好(图1F)。

图1 hUSCs原代及继代培养细胞形态学观察
2.2 hUSCs细胞生长曲线
MTT法检测hUSCs细胞体外生长曲线,结果如图2所示,基本呈S型曲线,1~4 d hUSCs增殖较快,细胞生长进入对数生长期,5~7 d细胞生长进入平台期。
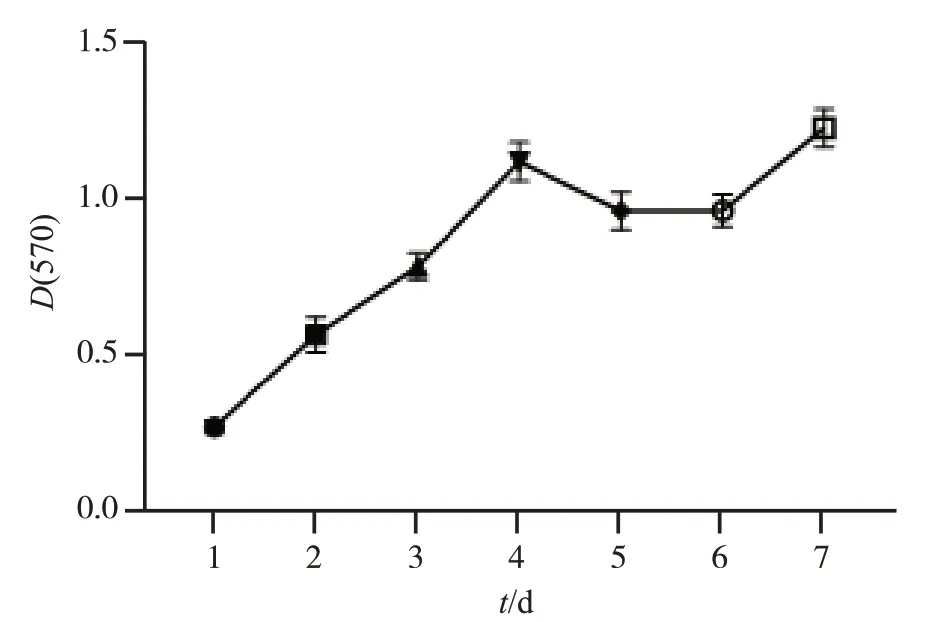
图2 hUSCs生长曲线
2.3 hUSCs的表面标志物鉴定
流式细胞术测定hUSCs表面标志物结果如图3所示,实验所用P2代hUSCs细胞表面标志物CD44阳性率为74.10%,CD90阳性率为99.94%,CD34阳性率为2.12%,CD31阳性率为0.10%,表明hUSCs表达间充质干细胞表面标志物CD90和CD44,几乎不表达造血干细胞表面标志物CD34和内皮细胞表面标志物CD31。

图3 hUSCs表面标志物抗原表达
2.4 DICT对hUSCs活力的影响
MTT检测0.5、1.0、1.5、2.0、2.5、3.0μmol/L DICT对hUSCs细胞活力的影响,结果如图4所示,6个浓度的DICT作用于hUSCs 3~6 d后,均有维持其细胞活力的作用。与对照组比较,DICT给药浓度为2.0 μmol/L时,第3~6天细胞活力均明显升高,差异均有统计学意义(P<0.01);给药浓度为1.5和2.5μmol/L时,第3~5天细胞活力均明显升高(P<0.01),第6天差异仍具有统计学意义(P<0.05)。第7天时细胞活力均处于较低水平。综合考虑,实验选用2.0μmol/L的DICT进行后续干性基因表达实验。
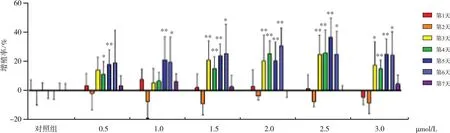
图4 DICT对hUSCs细胞活力的影响
2.5 DICT作用后hUSCs细胞形态学观察
对2.0μmol/L DICT分别作用3 d和7 d后的P4代hUSCs进行形态学观察,结果如图5所示,与对照组相比,2.0μmol/L DICT作用hUSCs 3 d后的生物学形态和细胞数量基本无明显变化;作用7 d后,hUSCs虽形态上变化不大,但细胞数量有所增加。

图5 DICT作用于hUSCs的形态学观察
2.6 DICT对hUSCs干性基因OCT-4、C-MYC mRNA表达的影响
qPCR结果如图6所示,与对照组对比,2.0μmol/L DICT组hUSCs干性基因OCT-4和C-MYC的mRNA表达量均显著升高(P<0.01),表明2.0μmol/L DICT可使hUSCs干性基因OCT-4和C-MYC的表达上调。

图6 DICT对hUSCs干性基因OCT-4、C-MYC mRNA表达的影响
3 讨论
人尿源性干细胞作为一种来源广泛、可在体外大量增殖的成体干细胞,现已在心血管、皮肤、骨骼修复以及疾病细胞造模等方面得到广泛应用[20-22],但也存在着传代过程中随代数增加细胞出现衰老、分化等问题[23]。本研究基于课题组前期筛选结果、实验研究及相关文献调研[24-26],推测DICT可能具有维持hUSCs干性的作用,并选择OCT-4、C-MYC两种基因作为判断hUSCs干性强弱的检测指标,在细胞及分子层面上分别探究DICT对hUSCs干性的影响。通过常温离心法成功培养出形态良好、具有间充质干细胞生物学特征的hUSCs,离心这一过程可将尿液中脱落的上皮细胞及杂质去除,随着继代培养过程,尿液中其他存活的细胞不再增殖,仅hUSCs仍保持旺盛的增殖能力。此外,通过MTT实验结合形态学观察确定DICT增强hUSCs活性的最适浓度,通过qPCR进一步探究了DICT对hUSCs干性基因OCT-4和C-MYCmRNA表达的影响,结果表明,DICT在一定浓度下具有维持hUSCs干性的作用。
研究表明,影响间充质干细胞干性的相关基因除OCT-4、C-MYC外还有NANOG、SOX2、REX1等,我们之前对这些基因在hUSCs中的表达及其与干细胞干性的相关性做过一些探索,发现SOX2和NANOG基因在hUSCs中低表达且表达不稳定,REX1表达变化较小指示性较弱,而OCT4和C-MYC基因表达较稳定且指示性强(结果未列出),因此在本文研究DICT对hUSCs干性基因的影响中首先选择这两种基因作为研究对象。后续我们需要进一步扩大标志性基因的检测,如对一些干细胞分化相关基因如ALP、SOX9、PPAR-γ2等表达的检测,并借助生物信息学、网络药理学及分子生物学等技术手段深入阐明其相关作用机制,以进一步确认促进hUSCs干性的小分子化合物,为hUSCs的研究与临床应用提供支持[27]。
中医经典著作内经《素问·六节藏象论》中有记载“肾者,主蛰,封藏之本,精之处也”。中医学认为“精”是生命的起源,主要储存在肾中,因此被称为肾精[28]。干细胞作为形成机体和各器官组织的原始细胞,在生命起源及生理功能上与“肾精”有较多共性,是肾精的重要细胞生物学基础[29]。如前所述,淫羊藿是中医临床重要的补肾中药之一[30],据文献报道,淫羊藿苷及其他淫羊藿成分也具有一定的促间充质干细胞增殖分化作用[31-33]。此外,有关淫羊藿主要成分与其他药物联用对间充质干细胞的影响也逐渐被关注:有实验表明,淫羊藿苷与雌激素联用较单用显著促进骨髓间充质干细胞增殖,且能够规避雌激素替代疗法的副作用[34];淫羊藿苷与白藜芦醇联合应用比单用促进诱导性多能干细胞向心肌细胞分化的效果更好[35]。今后有关DICT及其他淫羊藿成分对干细胞增殖、分化及干性维持的研究还可以在多药联用、3D模型构建等领域继续探索,这对解析淫羊藿的补肾阳、强筋骨、祛风湿等功效作用具有重要意义。

