精研十年真题,剖析“硼及其化合物”的考点考向
河北 马俊斌
元素周期律及物质结构基础相关知识是近年来高考选择题的高频考点,常以相关元素化合物为载体对其框架主体知识进行综合考查。2022年全国乙卷,11题中,从试题素材选取到问题设置,均以硼及其化合物为载体,试题以元素的位构性相关关系为突破点,推断出硼元素之后,进一步考查单质硼、硼酸、硼酸盐的性质。既对学生的基础知识掌握情况做出考查,也对学生在能力层面综合运用元素周期律及硼酸盐的热失重曲线计算分析进行了测评。
【真题再现】化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。YZ2分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图1所示,在200℃以下热分解时无刺激性气体逸出。下列叙述正确的是

图1
( )
A.W、X、Y、Z的单质常温下均为气体
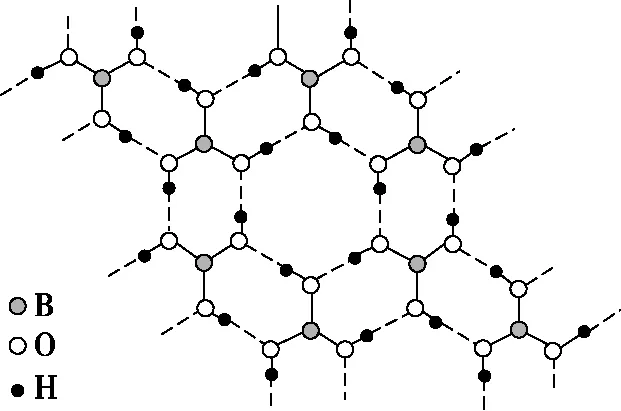
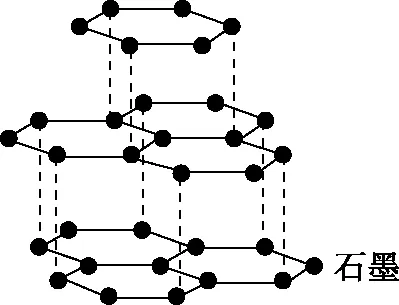
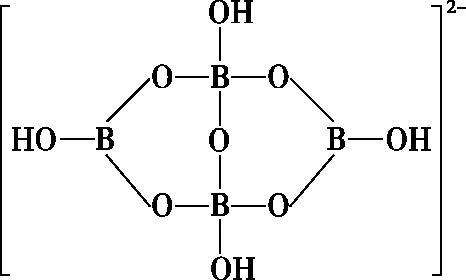
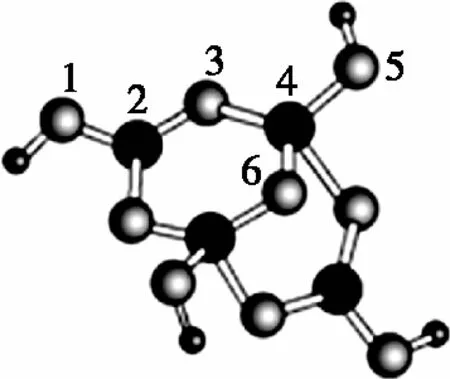
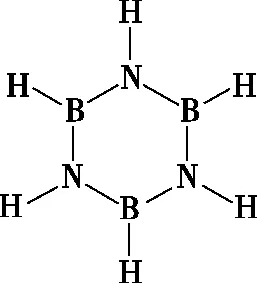
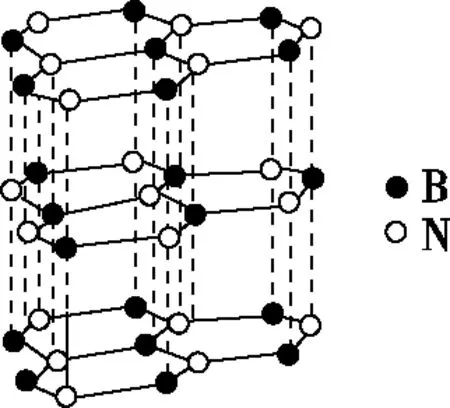
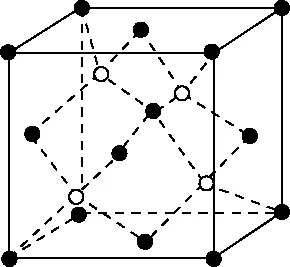
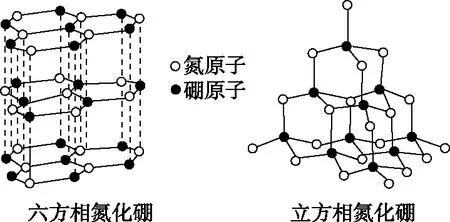
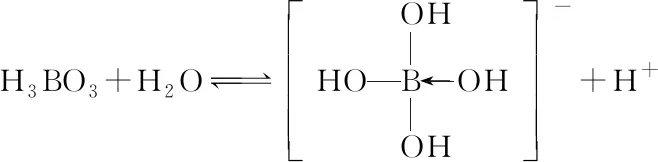
B.最高价氧化物的水化物酸性:Y C.100~200℃阶段热分解失去4个W2Z D.500℃热分解后生成固体化合物X2Z3 【答案】D 《中国高考评价体系》中也明确提出,高考的核心功能为“立德树人、服务选材、引导教学”,对于广大教学工作者,“引导教学”这一核心功能便要求我们研究高考,从高考中吸取经验,优化教学。硼,在高中化学作为一种小众元素,却在2022年高考全国乙卷中高调出现,因此,笔者对2012—2021十年内“硼及其化合物”在高考中的具体考查形式及考点分布进行梳理,统计如表1所示: 表1 总结近十年与“硼及其化合物”相关的高考试题,我们可以发现,“硼及其化合物”的相关考查由来已久,新课程标准改革(2017年)前后均有不同类型题目涉及,而考查题型主要集中在选择题和物质结构综合题中,热点考查内容主要以硼及其化合物为载体综合考查元素周期律及物质结构基础等相关知识,所以此类问题的解决,关键在于基础理论框架的构建,当然对硼及其化合物结构的熟悉及掌握也能够提高解题效率,也是本文的主要意义所在。 近十年高考试题涉及对硼及其化合物性质与用途的考查,但考查知识点比较单一,主要为硼酸及硼氢化钠的性质。另外,硼及其化合物的考查在工业流程、原理综合、电化学中也都有涉及,都是以其为载体或素材进行相关综合考查。 综上分析,本文重点对考题中涉及的硼及其化合物的结构与性质进行分类梳理。 【例1】(2014年福建卷,31题节选)基态硼原子的电子排布式为________。 【答案】1s22s22p1 【例2】(2020年全国Ⅲ卷,35题节选)H、B、N中,原子半径最大的是________。根据对角线规则,B的一些化学性质与元素________的相似。 【答案】B Si 【例3】(2013年山东卷,32题节选) (3)第一电离能介于B、N之间的第二周期元素有________种。 (4)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是________。 【答案】(3)3 (4)X 在近10年高考题中出现的含硼化合物主要有H3BO3、B3N3H6、NH3·BH3、BN、NaBH4、Na2B4O7·10H2O等,现将其结构特点进行逐一梳理。 1.硼酸及硼酸盐 正硼酸 H3BO3或B(OH)3为白色结晶性粉末,晶体中的基本结构单元为平面三角形结构的B(OH)3,每个硼原子用3个sp2杂化轨道与羟基中的氧原子形成σ键,每个B(OH)3通过氢键分别与另外三个B(OH)3相连,在平面内无限连接成层状结构(如图2),层间以范德华力维系。 图2 在此,我们可以结合我们所熟知的石墨的结构进行对比学习。 图3 硼砂 Na2B4O7·10H2O是无色半透明晶体或白色结晶粉末,在其晶体中,[B4O5(OH)4]2-(结构如图4)离子通过氢键连接成链状结构,链与链之间通过Na+以离子键结合,水分子存在于链之间,所以硼砂的分子式应写为Na2B4O5(OH)4·8H2O。 图4 【例4】(2016年上海卷,3题)硼的最高价含氧酸的化学式不可能是 ( ) A.HBO2B.H2BO3C.H3BO3D.H2B4O7 【答案】B 【例5】(2012年福建卷,30题节选)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图5所示,在Xm-中,硼原子轨道的杂化类型有________;配位键存在于________(填原子的数字标号)原子之间;m=________(填数字)。 图5 【答案】sp2、sp34,5 2 2.含氮硼化物 无机苯(B3N3H6) 图6 氨硼烷(NH3·BH3) NH3·BH3分子可视为NH3分子提供孤电子对,而BH3分子提供空轨道形成的配合物,所以NH3·BH3分子中B原子与N原子均采用sp3杂化方式成键,与乙烷(C2H6)互为等电子体。 氮化硼(BN) 层状六方氮化硼具有石墨型晶体结构(如图7),俗称白石墨,晶体中的硼原子和氮原子均采取sp2杂化方式成键。虽然其结构与石墨相似,但六方氮化硼却不导电,因为氮的电负性较大,π键上的电子很大程度上定域在氮的周围,不能自由流动。 图7 高温、高压下六方氮化硼可转化为立方氮化硼,与金刚石结构相似(如图8),晶体中的硼原子和氮原子均采取sp3杂化方式成键,但其硬度大于金刚石,是特殊的耐磨和切削材料。 图8 综合三类含氮硼化物的结构特点,不难发现其中两条相似之处:其一,硼原子提供空轨道与氮原子提供的孤电子对或形成离域π键,或形成配位键;其二,其等电子体均为碳及其化合物。 【例6】(2020年山东卷,7题)B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是 ( ) A.其熔点主要取决于所含化学键的键能 B.形成大π键的电子全部由N提供 C.分子中B和N的杂化方式相同 D.分子中所有原子共平面 【答案】A 【例7】(2020年全国Ⅲ卷,35题节选)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题: (2)NH3BH3分子中,N—B化学键称为________键,其电子对由________提供。 (3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是________。与NH3BH3原子总数相等的等电子体是________(写分子式)。 【答案】(2)配位 N (3)N>H>B C2H6 【例8】(2014年福建卷,31题节选)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图9所示。 图9 (2)关于这两种晶体的说法,正确的是________(填序号)。 a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软 c.两种晶体中的B—N键均为共价键 d.两种晶体均为分子晶体 (3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________,其结构与石墨相似却不导电,原因是_____________________________________。 (4)立方相氮化硼晶体中,硼原子的杂化轨道类型为________。 (5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有________mol配位键。 【答案】(2)bc (3)平面三角形 层状结构中没有自由移动的电子 (4)sp3(5)2 3.硼氢配合物 【例9】(2015年全国Ⅰ卷,27题节选)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为________。 硼及其化合物性质及用途的考查主要集中在硼酸(H3BO3)与硼氢化钠(NaBH4),现将其梳理如下: 硼酸(H3BO3) 硼的含氧酸有正硼酸H3BO3、偏硼酸HBO2、焦硼酸H4B2O5和四硼酸H2B4O7,其中H3BO3为常考点。 H3BO3的酸性可结合元素周期律的相关内容进行对比分析,元素的非金属性越强,其最高价氧化物的水化物的酸性越强;B元素的非金属性弱于同周期的C元素,C元素的最高价氧化物的水化物碳酸为弱酸,由此可知H3BO3为弱酸;其电离方程式可结合氨水的电离方程式对比学习理解(如图10),不同之处在于B为缺电子体,接受水分子中羟基的孤电子对而释放质子,使溶液呈酸性,而氨水中的N易提供孤电子对与水提供的质子结合为铵根离子,从而释放氢氧根离子使溶液呈碱性。 图10 另外,H3BO3受热时会逐渐脱水,随着温度的升高,由正硼酸生成偏硼酸,再到四硼酸,最后还可转化为硼酐(如图11)。 图11 硼氢化钠(NaBH4) 硼氢化钠,是硼氢配合物中重要的一种,由于硼的电负性小于氢,所以硼氢化钠中氢为-1价,有极强的还原性,被认为是有机化学中的“万能还原剂”。 【例10】(真题汇编)判断下列说法是否正确。 (2012年浙江卷,10D)受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理。 ( ) (2020年浙江1月卷,11A)碱液不慎溅到手上,先用大量水冲洗,再用饱和硼酸溶液洗,最后用水冲洗。 ( ) (2021年河北卷,5A)H3BO3可用于中和溅在皮肤上的NaOH溶液。 ( ) 【答案】× √ √ 【例11】(2019年全国Ⅰ卷,26题节选) (3)根据H3BO3的解离反应: 【答案】一元弱 【例12】(2015年安徽卷,27题节选) (2)请配平第①步反应的化学方程式: (4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气(g),在25℃,101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是_____________________________________。 【答案】(2)1 2 4 2 1 2 【例13】(2016年江苏卷,20题节选) 中国高考评价体系中创造性地提出了高考命题的理念要从“知识立意、能力立意”向“价值引领、素养向导、能力为重、知识为基”转变。基于此,情境化试题应运而生,不仅是工业流程或物质结构基础等题,即使选择题,也很少以单纯的元素化合物知识考查命题,更多的是以基础元素化合物相关为载体,综合考查学生所学化学核心概念,运用相关化学原理进行有效知识迁移,解决问题。元素化合物是化学理论之根本,相关化学原理又辅助元素化合物知识的理解深化,这也就更加要求我们在复习备考中,既要注重化学原理等相关知识的理解应用,更要扎实元素化合物的基础必备知识。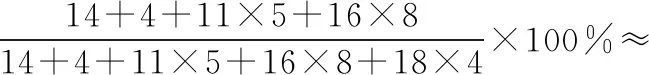
一、硼及其化合物的结构特点
(一)原子结构
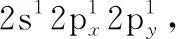
(二)分子及晶体结构
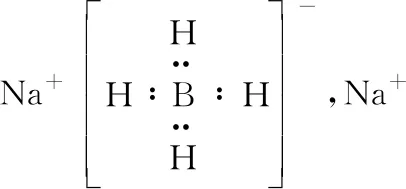
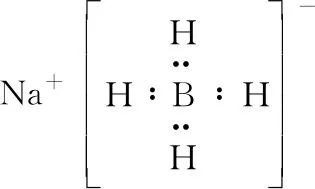
二、硼及其化合物的性质与用途

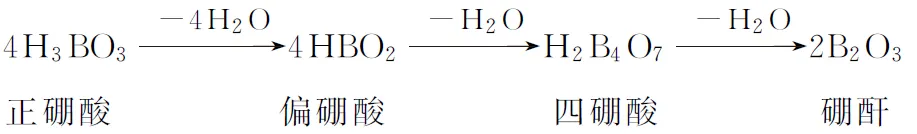
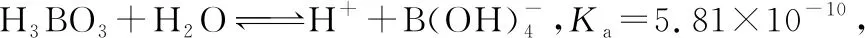


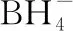
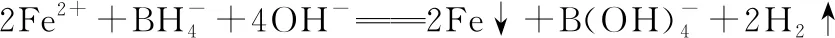
三、结语

