浅析高考中的物质制备实验
——以2022年高考真题为例
北京 陈建托
《普通高中化学课程标准(2017年版2020年修订)》明确了化学实验主题的学业要求:认识化学实验是研究和学习物质及其变化的基本方法,是科学探究的一种重要途径。初步学会物质检验、分离、提纯和溶液配制等化学实验基础知识和基本技能。学习研究物质性质,探究反应规律,进行物质分离、检验和制备等不同类型化学实验及探究活动的核心思路与基本方法。体会实验条件控制对完成科学实验及探究活动的作用。
物质制备实验是中学化学实验教学的重要组成部分,也是高考考查学生综合实验分析能力的重要载体。近年来高考命题青睐于考查基于真实情境的陌生物质的制备,方法、装置均具有一定的陌生度,题型多变,考点繁多,涉及知识面广,思维发散空间大,充分考查学生学科核心素养,具有良好的区分度和选拔功能。
该题型综合考查维度如图1所示。
笔者梳理近几年全国卷、地方卷关于物质制备实验的考点,并浅析几道2022年高考真题,希望可以为考生高考复习提供一定的帮助。
1.物质制备实验考点归纳
物质制备实验主要以气体、无机物、有机物的制备为载体,考查常见化学仪器的使用、物质的分离与提纯操作、实验条件的控制、定量计算等。
近几年物质制备实验高考题考点汇总如表1、表2。

表1
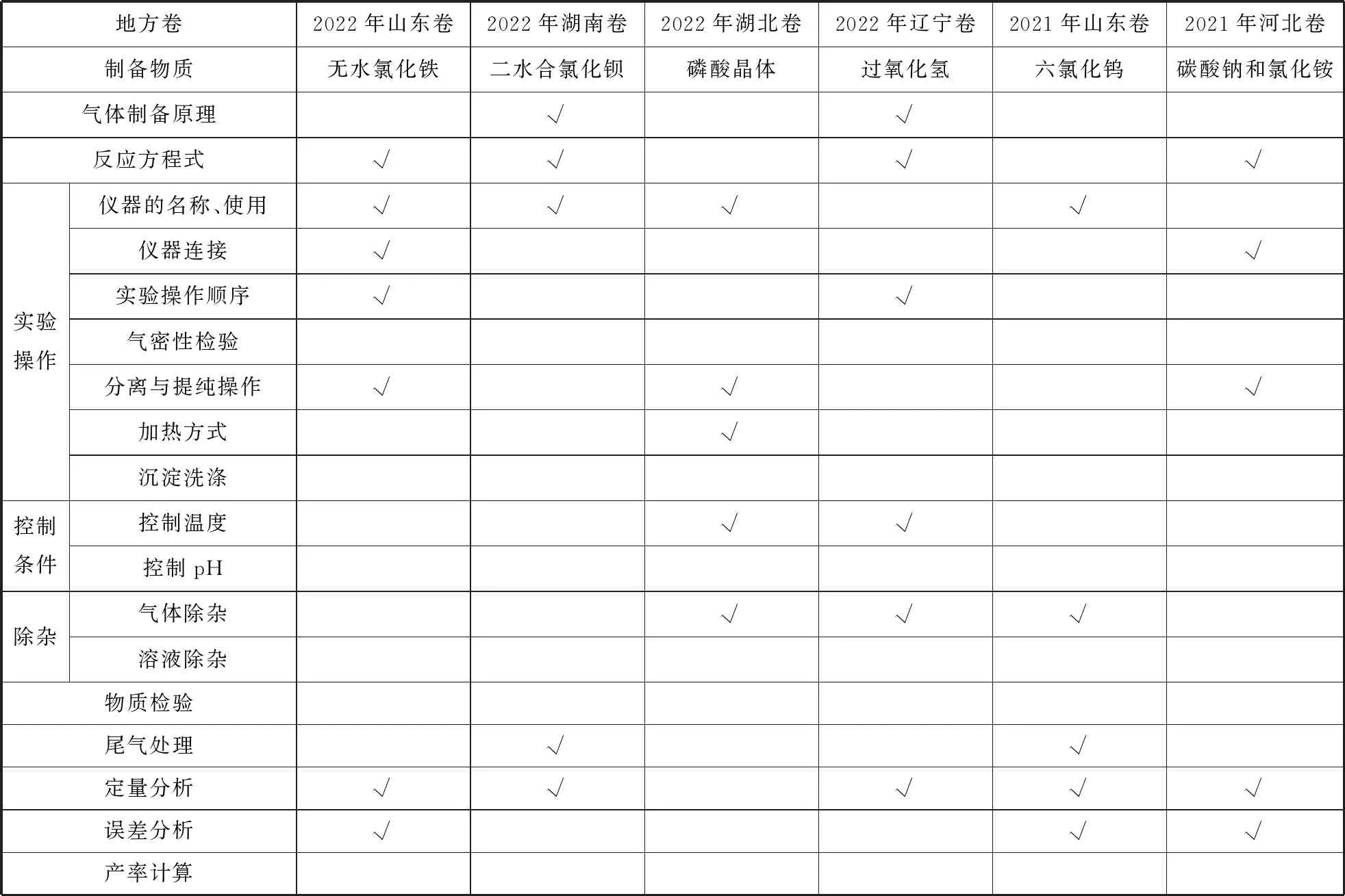
表2
综合表1、表2,可归纳物质制备实验的高频考点有:
①仪器的名称、使用
除常规仪器外,可能涉及中学阶段较为陌生仪器,如恒压分液漏斗、索氏提取器等。
②分离与提纯操作
分离提纯是大部分物质制备实验必不可少的实验环节。常见分离与提纯操作有过滤、结晶、升华、分液、萃取等。其中,尤其要注意结晶操作,一般需要加热浓缩、降温结晶、过滤、洗涤、干燥等一系列步骤,除此之外还有蒸发结晶、趁热过滤等方式。
分离提纯还需要注意物质性质,例如,在热水中溶解度较大的物质要选择冰水洗涤或乙醇洗涤,易分解的物质宜采用减压加热浓缩等。
③定量分析
常见定量分析方法有重量分析法和滴定法。定量分析具有一定难度,不过无外乎找准相关物质之间的定量关系。针对该考点考生平时可以重视题型总结,积累细节问题,逐步形成解题方法。
在平时学习中将这些常规知识、常规考点内化为认知模型,这样面对陌生情境才能灵活应对。除常规考点,近几年考题不乏出现一些中学阶段相对陌生的考点,笔者归纳如表3。

表3
这些考点并不容易快速准确作答。建议考生在平时学习、练习中适当积累类似知识。
2.物质制备实验解题建议
解答题目一定要形成全局意识,重点关注几个“读”。
①读目的:明确原料,明确目标产品,明确物质转化关系,明确核心元素,关心核心元素价态变化。
②读问题:通读问题,综合分析,把握正确的答题方向,抓准突破口。
③读性质:关注原料、中间产物及产品的性质,尤其是特殊性质、特殊反应。
④读干扰:分析实验中干扰因素(干扰物质、干扰反应)。
⑤读装置或步骤:明确各装置或各步骤的用途、发生的反应以及注意事项。
⑥读信息:充分利用题给信息,关心图表自变量、因变量,关心数据或曲线的变化趋势及变化节点。
以2018年全国Ⅰ卷,26题为例,题给信息与对应考题如表4。

表4
3.高考真题浅析
【例1】(2022年山东卷,18题)实验室利用FeCl2·4H2O和亚硫酰氯(SOCl2)制备无水FeCl2的装置如图2所示(加热及夹持装置略)。已知SOCl2沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
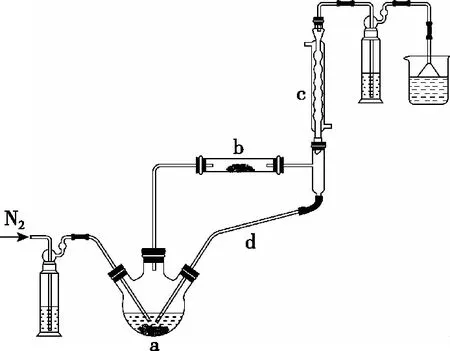
图2
(1)实验开始先通N2。一段时间后,先加热装置________(填“a”或“b”)。装置b内发生反应的化学方程式为____________________。装置c、d共同起到的作用是______________________________。
(2)现有含少量杂质的FeCl2·nH2O,为测定n值进行如下实验:
实验Ⅱ:另取m1g样品,利用上述装置与足量SOCl2反应后,固体质量为m2g。
则n=________;下列情况会导致n测量值偏小的是________(填标号)。
A.样品中含少量FeO杂质
B.样品与SOCl2反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成
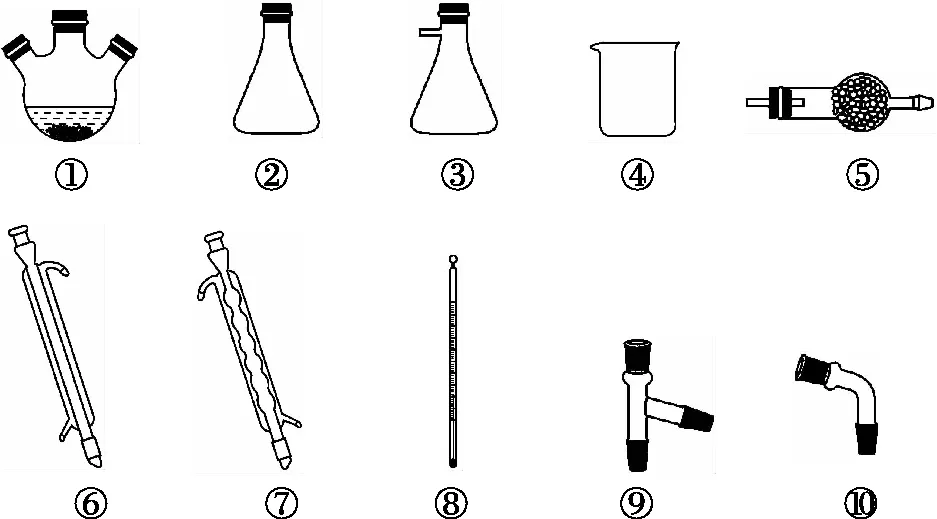
图3
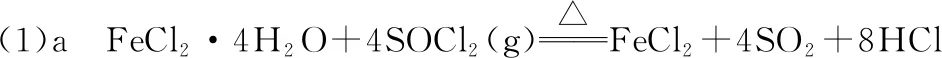
(3)⑥⑩③⑤ CCl4
【解析】①读目的:制备无水FeCl2,SOCl2与FeCl2·4H2O中的H2O反应生成SO2和HCl,HCl抑制FeCl2水解,从而制得无水FeCl2。
②读性质:SOCl2沸点较低、遇水极易反应,FeCl2·4H2O有还原性,且直接加热易水解。
故实验开始先通N2排除装置内O2,一段时间后,应先加热装置a使SOCl2挥发进入b装置,若先加热b会导致FeCl2·4H2O水解。
③读干扰:外界空气或尾气处理装置中水蒸气对易水解物质有干扰。
④读装置或步骤:装置c、d的共同作用是冷凝回流SOCl2。末端装置为尾气处理装置,读者可以思考倒数第二个装置作用。
⑤读信息:“已知TiCl4与CCl4分子结构相似,与CCl4互溶,但极易水解”,需要组装蒸馏装置对TiCl4、CCl4混合物进行蒸馏提纯,按由下而上、从左到右的顺序组装,安装顺序为①⑨⑧⑥⑩,又TiCl4极易水解,为防止外界水蒸气进入,最后连接③⑤。
【例2】(2022年辽宁卷,18题)H2O2作为绿色氧化剂应用广泛,氢醌法制备H2O2原理及装置如图4所示:
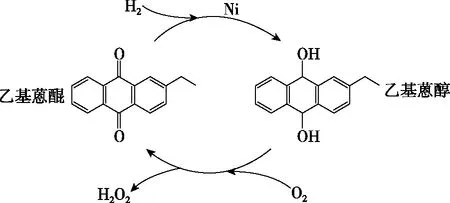
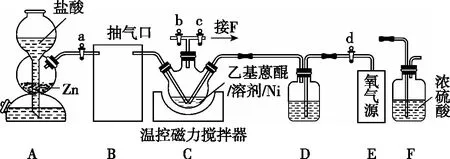
图4
已知:H2O、HX等杂质易使Ni催化剂中毒。回答下列问题:
(1)A中反应的离子方程式为_____________________________________。
(2)装置B应为________(填序号)。
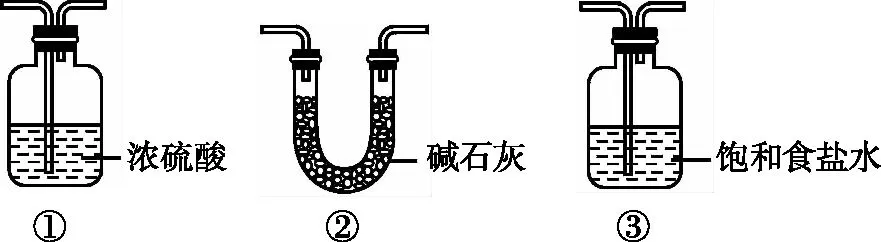
图5
(3)检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,打开活塞________,控温45℃。一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞________,继续反应一段时间。关闭电源和活塞,过滤三颈烧瓶中混合物,加水萃取,分液,减压蒸馏,得产品。
(4)装置F的作用为_____________________________________。
(5)反应过程中,控温45℃的原因为_____________________________________。
(6)氢醌法制备H2O2总反应的化学方程式为_______________________________________________。
(7)取2.50 g产品,加蒸馏水定容至100 mL摇匀,取20.00 mL于锥形瓶中,用0.050 0 mol·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL。假设其他杂质不干扰结果,产品中H2O2质量分数为________。

(2)③①或②
(3)a、b c、d
(4)防止外界水蒸气进入C中使催化剂中毒
(5)适当升温加快反应速率,同时防止温度过高H2O2分解
(7)17%
【解析】①读目的:制备H2O2的反应分为两步,第一步H2在Ni的催化作用下与乙基蒽醌反应生成乙基蒽醇,第二步O2与乙基蒽醇反应生成H2O2和乙基蒽醌。
②读性质:H2O2加热易分解,反应控温45℃的原因之一是防止H2O2分解,“减压蒸馏”也是为了降低蒸馏温度防止H2O2分解。
③读干扰:A中制得的H2有杂质HCl和H2O,外界空气中水蒸气也会影响催化剂。
④读装置或步骤:左侧为制氢装置,右侧为供氧装置。先打开活塞a、b(通H2),再打开活塞c、d(通O2)。
⑤读信息:“H2O、HX等杂质易使Ni催化剂中毒”,H2中的杂质需要分别通过装有饱和食盐水和浓硫酸的洗气瓶,也可以直接通过碱石灰除去,F的作用是防止外界水蒸气进入C中使催化剂中毒。
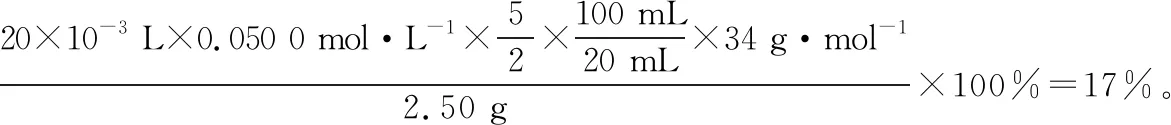
物质制备实验凸显对关键能力和学科素养的考查,题目基于真实实验情境,具有基础性、综合性、应用性和创新性。大部分考题有一定的陌生度,在平时模拟题中并不多见,这种“反押题”的考查形式可以保证试题的科学性、公平性和权威性,引导减少“死记硬背”和“机械刷题”现象,充分发挥高考命题的育人功能和积极导向作用,落实立德树人根本任务。

