miR-519d在结肠癌细胞系中的表达及对其增殖、凋亡和侵袭的影响*
杜天明, 严 群, 王向阳, 王 辉△
1华中科技大学同济医学院附属武汉中心医院胃肠外科,武汉 430014 2华中科技大学同济医学院附属同济医院胃肠外科,武汉 430030
结肠癌是人类癌症死亡的主要原因之一,全世界每年新诊断病例接近60万例[1-2]。过去20年,结肠癌5年生存率在1970年33%的基础上有所提高,但总的生存率仍低于60%[3]。深入了解结肠癌发生发展机制对于发现新的治疗靶点、提高治疗效果具有重要意义。微小RNA(microRNA,miRNA)是一类在动物、植物、真菌和病毒中进化保守的小分子非编码RNA。miRNAs能通过与靶基因的3′-UTR区结合而促进mRNA降解或抑制翻译[4]。研究发现,miRNA可能作为抑癌基因或促癌基因影响人类癌症的进程[5]。miR-519d属于19号染色体miRNA簇。研究表明miR-519d高表达于肝癌细胞[6],低表达于卵巢癌[7]和乳腺癌[8]细胞,并且参与调控细胞增殖、侵袭、凋亡等恶性生物学行为。然而,miR-519d在结肠癌中的表达及功能和机制尚不清楚。本研究旨在检测miR-519d在正常结肠上皮细胞系和结肠癌细胞系中的表达差异,探讨该基因对结直肠癌细胞增殖、凋亡及侵袭的影响,并研究其可能的机制。
1 材料与方法
1.1 材料
正常结肠上皮细胞系NCM460和结肠癌细胞系HCT116、SW620、LOVO、HT29均购自美国ATCC细胞库,X连锁凋亡抑制蛋白(XIAP)、STAT3及β-actin一抗均购自美国Invitrogen公司,羊抗兔二抗购自美国BD公司,miR-519d过表达序列(miR-519d mimics)及阴性对照序列(Scramble)均由广州锐博生物科技有限公司设计及合成,转染采用lipofetamineTM3000系统,Scramble序列:正向序列5′-UUCUCCGAACGUGUCACGU-TT-3′,反向序列5′-ACGUGACACGUUCGGAG-AATT-3′;miR-519d序列:正向序列5′-CAAAG-UGCCUCCCUUUAGAGUG-3′,反向序列5′-CU-CUAAAGGGAGGCACUUUGUU-3′。MTT试剂购于美国Sigma公司。Matrigel基质胶购自美国BD公司,Transwell小室购自美国Corning公司,SDS-PAGE凝胶配制试剂盒购自武汉博士德生物公司,Trizol试剂盒、实时荧光定量PCR检测试剂盒及Annexin Ⅴ-FITC/PI双染试剂盒均购自上海碧云天生物技术有限公司。
1.2 细胞培养及实验分组
所有细胞系均培养于37℃、5%的二氧化碳培养箱中,培养液为含10%胎牛血清的Eagle细胞培养液。结肠癌细胞系SW620培养至对数生长期行传代培养,并分成3组,即miR-519d过表达组(miR-519d组)、阴性对照组(miR-NC组)及空白对照组(Blank组),采用lipofetamineTM3000分别转染miR-519d mimics及Scramble,Blank组仅给予空白对照。
1.3 RNA提取及实时荧光定量PCR(qRT-PCR)检测
miR-519d组、miR-NC组及Blank组均采用TaqMan microRNA试剂盒提取总RNA,提取总RNA后,采用qRT-PCR测定3组细胞miR-519d的相对表达量,qPCR引物:miR-519d上游引物5′-CA-AAGTGCCTCCCTTTAGAGTG-3′,下游引物5′-AGGACGTATAAAAGATCGACCA-3′;U6小核:上游引物5′-CTCGCTTCGGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′。采用反转录法合成cDNA,采用7500 Fast Real Time PCR System(Applied Biosystems)系统行逆转录反应,内参为U6小核,反应条件:95 ℃预变性30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环,测定miR-519d组、miR-NC组及Blank组3组样品的循环阈值,计算Ct值,采用2-ΔΔCt法定量计算miR-519d组、miR-NC组及Blank组miR-519d的相对表达量。
1.4 细胞增殖能力测定
采用MTT法测定miR-519d组、miR-NC组及Blank组3组细胞增殖能力,收集miR-519d组、miR-NC组及Blank组3组对数生长期细胞,调整细胞悬液浓度为5×104个/mL,每孔加入100 μL细胞悬液(每孔5000个细胞),设置6个复孔,细胞放入培养箱培养,待贴壁后第2天每孔加入5 mg/mL MTT液20 μL,培养4 h后每孔加入150 μL DMSO,37℃温箱孵育10 min或摇床低速振荡10 min。于培养0、24、48、72、96 h后用酶标仪在490nm波长下检测各孔的吸光度值(A490nm)。
1.5 细胞凋亡能力测定
采用PI/Annexin Ⅴ-FITC双染和流式细胞术测定细胞凋亡,根据凋亡检测试剂盒说明书中的操作方案,将miR-519d组、miR-NC组及Blank组细胞经培养至对数生长期后,加入膜联蛋白A-Ⅴ-Fluos(Annexin-Ⅴ-Fluos)和碘化丙啶(Propidium Iodide,PI)染色后,上机通过流式细胞仪测定和计算3组细胞凋亡率。
1.6 Transwell实验
采用Transwell实验测定细胞侵袭能力,稀释Matrigel基质胶(稀释比1∶5),Transwell小室上室均匀铺40 μL,置于培养箱内凝固。RPMI 1640培养液(去血清)重悬miR-519d组、miR-NC组及Blank组3组细胞,4×104个/孔细胞密度接种小室上室,小室下室加入含血清培养液。继续培养24 h,用棉签擦去未穿膜细胞。多聚甲醛固定细胞,结晶紫染色,在200×视野下计数每组穿膜细胞数,实验重复3次,取平均值。
1.7 蛋白质印迹法(Western blot)检测
裂解变性miR-519d组、miR-NC组及Blank组细胞,采用半干法转膜,实验条件:浓缩胶80 V 80 min,分离胶100 V 100 min。信号转导及转录激活因子3(STAT3)和X连锁凋亡抑制蛋白(XIAP)及β-actin一抗浓度为1∶300,二抗羊抗兔浓度为1∶500,电化学发光法(ECL)发光液显影后使用胶片曝光,扫描仪导入胶片图像后使用Image J软件分析灰度值,实验重复3次,目标蛋白相对表达量=目标蛋白条带灰度值/β-actin条带灰度值。
1.8 统计学方法

2 结果
2.1 miR-519d低表达于结肠癌细胞系
qRT-PCR检测miR-519d在正常结肠上皮细胞系NCM460和结肠癌细胞系中的相对表达量,在正常结肠上皮细胞系NCM460的表达量为(1.03±0.03),在结肠癌细胞系HCT116、SW620、LOVO、HT29中miR-519d相对表达量分别为(0.42±0.02)、(0.28 ± 0.03)、(0.58±0.05)、(0.49 ± 0.03),经方差分析,差异有统计学意义(F=121.13,P<0.01);经LSD-t检验,HCT116、SW620、LOVO和HT29细胞系miR-519d相对表达量均低于NCM460(均P<0.05),见图1。细胞系SW620中miR-519d的相对表达量最低,故选择SW620行后续实验。
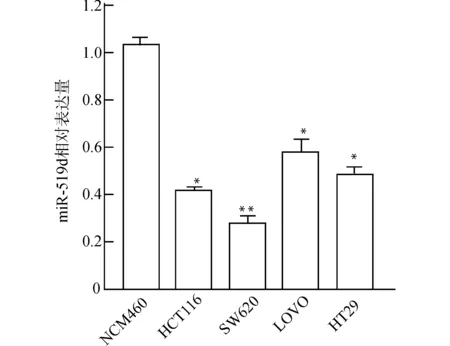
与NCM460组比较,*P<0.05 **P<0.01图1 miR-519d在正常结肠上皮细胞系及结肠癌细胞系中的表达Fig.1 Expression of miR-519d in normal colon epithelial cell lines and colon cancer cell lines
2.2 过表达miR-519d抑制结肠癌细胞系SW620细胞增殖
转染24 h后,miR-519d组miR-519d相对表达量为(21.73±0.83),miR-NC组为(1.02±0.08),miR-519d组miR-519d相对表达量高于miR-NC组(t=43.060,P<0.01),Blank组与miR-NC组差异无统计学意义,见图2A。MTT实验示细胞铺板后0、24、48、72及96 h细胞生长,结果miR-519d组对miR-NC组A490nm值分别为:(0.16±0.02)比(0.15±0.02)(t=0.612,P=0.573),(0.23±0.02)比(0.25±0.02)(t=-1.225,P=0.288),(0.32±0.03)比(0.41±0.04)(t=3.118,P=0.053),(0.42±0.04)比(0.63±0.05)(t=5.681,P=0.011)及(0.57±0.05)比(1.07±0.08)(t=9.180,P=0.003),Blank组则分别为(0.15±0.03)、(0.24±0.03)、(0.43±0.05)、(0.65±0.06)及(1.12±0.09),与miR-NC组差异无统计学意义,见图2B。

A:转染效率测定;B:细胞增殖曲线;与miR-NC组比较,*P<0.05 **P<0.01图2 过表达miR-519d抑制SW620细胞增殖Fig.2 Overexpression of miR-519d inhibits the proliferation of SW620 cell line
2.3 过表达miR-519d促进结肠癌细胞系SW620细胞凋亡
利用PI/Annexin Ⅴ-FITC双染和流式细胞术测定细胞凋亡,其中miR-519d组细胞凋亡率为(23.65±1.23)%,miR-NC组为(4.96±0.63)%,Blank组为(4.78±0.73)%,miR-519d组细胞凋亡率高于miR-NC组(t=23.805,P=0.002),miR-NC组与Blank组细胞凋亡率差异无统计学意义(t=0.334,P=0.760),见图3。
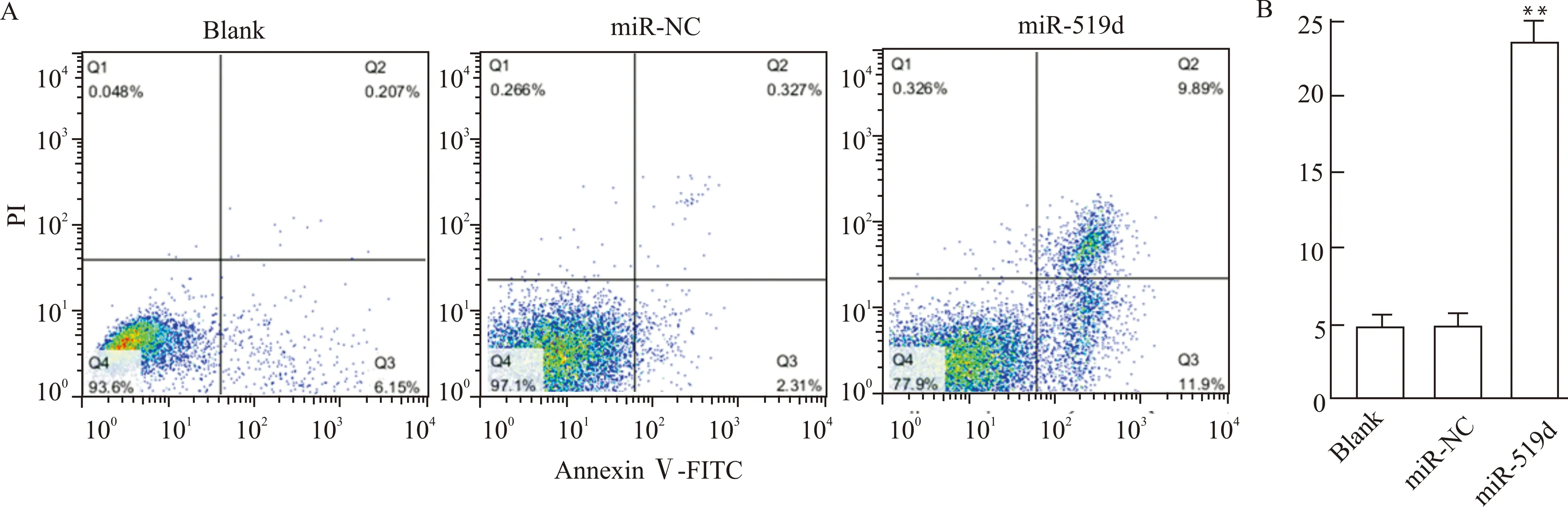
A:流式细胞术B:细胞凋亡率;与miR-NC组比较,**P<0.01图3 过表达miR-519d促进SW620细胞凋亡Fig.3 Overexpression of miR-519d promotes the apoptosis of SW620 cell line
2.4 miR-519d过表达促进结肠癌细胞SW620的侵袭
Transwell实验示:200×视野下,miR-519d组侵袭细胞数为(55±8)个,miR-NC组侵袭细胞数为(137±14)个,Blank组侵袭细胞数为(145±15)个,miR-519d组侵袭细胞数少于miR-NC组(t=8.813,P=0.003),Blank组与miR-NC组侵袭细胞数差异无统计学意义(t=0.638,P=0.570),见图4。

A:Transwell实验(×200);B:侵袭细胞数;与miR-NC组比较,**P<0.01图4 过表达miR-519d促进SW620细胞侵袭Fig.4 Overexpression of miR-519d promotes the invasion of SW620 cell line
2.5 miR-519d过表达对STAT3和XIAP蛋白表达的影响
Western blot法检测了miR-519d调节增殖、凋亡与侵袭相关的靶蛋白质,发现miR-519d组XIAP蛋白相对表达量为(0.32±0.04),miR-NC组为(1.00±0.05),miR-519d组XIAP蛋白相对表达量低于miR-NC组(t=-18.394,P<0.01),Blank组为(1.04±0.06),Blank组与miR-NC组XIAP蛋白表达量差异无统计学意义;miR-519d组STAT3蛋白相对表达量为(0.44±0.04),miR-NC组为(1.05±0.07),miR-519d组STAT3蛋白相对表达量低于miR-NC组(t=-12.031,P<0.01),Blank组与miR-NC组STAT3蛋白表达量差异无统计学意义,见图5。

与miR-NC组比较,**P<0.01图5 过表达miR-519d对STAT3和XIAP蛋白表达的影响Fig.5 Effects of overexpression of miR-519d on STAT3 and XIAP protein expression
3 讨论
结肠癌是一种常见的恶性肿瘤,具有高度异质性、易转移复发、生存率低等特点[9]。miR-519d已被证实能够调控多种类型肿瘤的发生发展。文献报道经荧光素酶实验后证实,miR-519d有多个作用靶点,比如:miR-519d通过靶向细胞周期蛋白依赖性激酶抑制剂1A、第10号染色体同源缺失性磷酸酶-张力蛋白、丝氨酸(Ser)/苏氨酸(Thr)蛋白激酶、基质金属蛋白酶2促进肝癌细胞增殖、侵袭,并诱导细胞凋亡[10];通过靶向XIAP影响卵巢癌细胞增殖并干扰顺铂诱导的细胞凋亡;通过靶向Smad7蛋白促进宫颈癌的进展和转移[11]。本研究发现,miR-519d在结肠癌细胞系HCT116、SW620、LOVO、HT29中表达均显著低于正常结肠上皮细胞系NCM460,提示miR-519d是一种新的结肠癌抑癌基因,可能发挥抑癌基因的功能。随后研究证实,过表达miR-519d影响结肠癌细胞恶性生物学行为,包括抑制增殖、侵袭,并诱导细胞凋亡。此外,miR-519d显著降低SW620细胞株STAT3和XIAP蛋白的表达水平,说明miR-519d可能通过负调控STAT3和XIAP阻碍结肠癌细胞的增殖和侵袭。
Pang等[7]通过双荧光素酶实验发现在卵巢癌中XIAP是miR-519d的靶基因,miR-519d过表达显著抑制XIAP蛋白和mRNA表达水平,且低表达XIAP可介导miR-519d对卵巢癌细胞凋亡的促进作用。是多种恶性肿瘤的关键致癌因素,能通过抑制凋亡,促进细胞增殖、侵袭和血管生成参与肿瘤的进展[12]。研究发现,STAT3是G1/S-特异性周期蛋白-D1(Cyclin D1,CCND1)、基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)、抑制细胞凋亡的杆状病毒抑制剂(Survivin)、凋亡抑制基因(B-cell lymphoma-extra large,Bcl-xL)、血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)等的正调控因子,而这些是涉及细胞凋亡抑制或诱导肿瘤生长、侵袭的重要基因[13]。文献[14]指出下调STAT3可显著抑制MMP-2表达从而抑制胶质瘤细胞侵袭能力,并通过抑制Bcl-xL诱导细胞凋亡。Xiong等[15]发现JAK1/STAT3信号通路受阻促进结肠癌细胞凋亡和细胞周期阻滞,削弱肿瘤细胞侵袭能力。越来越多的研究证实,miRNAs与STAT3信号通路密切相关,多个miRNAs如miR-124、miR-155、miR-21分别参与STAT3介导的非小细胞肺癌、人喉鳞状细胞癌、胶质母细胞瘤的发生及发展过程[13,16-17]。本研究发现,miR-519d表达升高后STAT3蛋白表达降低,表明miR-519d对STAT3有一定的抑制作用,是miR-519d高表达组结肠癌细胞增殖、侵袭受抑制的影响因素。
XIAP是一种众所周知的细胞凋亡阻遏物,通过与Caspase-3,7,9绑定结合抑制细胞凋亡[18]。XIAP也是细胞凋亡抑制剂家族(IAP)中最有效的成员,其表达下调被认为是抗肿瘤的有效方法[18]。XIAP蛋白包含3个BIR结构域,BIR2及侧翼区域负责结合并有效抑制Caspase-3,7,而BIR3和侧翼区域抑制Caspase-9活性[19]。此外,XIAP也被证实参与其他多种细胞生命活动,如调控受体介导的信号转导过程和蛋白泛素化[20]。本研究发现,细胞凋亡抑制因子XIAP受miR-519d负调控,表明XIAP表达降低可能是miR-519d诱导结肠癌细胞凋亡的直接原因。尽管我们对miR-519d在结肠癌中的生物学功能进行了初步探索,但其具体的分子调控机制及临床意义还有待进一步研究。
本研究结果表明miR-519d低表达于结肠癌细胞,miR-519d模拟物可通过下调STAT3和XIAP表达显著抑制肿瘤细胞恶性生物学行为,这使得miR-519d有望成为结肠癌临床诊断、预后的潜在分子标志物,也可能为开发新的治疗手段提供一定的理论和实验基础。

