输出电压对聚焦超声经颅开放血脑屏障有效性及安全性的影响*
罗凯旋,王钰宏,莫晓艳,井治聪,陈茉弦,敖丽娟
(昆明医科大学 康复学院,云南 昆明 650500)
血脑屏障(blood-brain barrier,BBB)主要由血管内皮细胞、周细胞、星形胶质细胞等组成[1],对稳定大脑微环境有着重要作用。一般情况下,分子量>400 Da 的物质无法进入BBB[2],在保护脑组织免受外来毒素侵扰的同时,也限制了大部分治疗物质的进入,成为治疗脑组织疾病的一道障碍[3]。聚焦超声(focused ultrasound,FUS)技术可开放BBB,增加治疗药物的递送效率,进而治疗脑组织疾病[4-5]。由于具有安全、可逆的特点[6-7],FUS 开放BBB 临床转化潜力巨大,是当前的研究热点之一。有学者研究不同子参数对FUS 开放BBB 的效率和安全性的影响,结果显示声压(一般由输出电压控制)和脉宽对FUS 开放BBB 的效率影响最大[8],本实验在控制其他条件不变的情况下,探索输出电压对FUS 经颅开放BBB 有效性及安全性的影响,筛选出可安全、有效开放BBB 的输出电压值。
1 材料与方法
1.1 实验试剂及FUS治疗系统
SonoVue®注射用六氟化硫微泡(平均粒径7.5 μm)购自云南省医药有限公司,Sigma®依文思蓝(evans blue,EB)、Biosharp®4%多聚甲醛溶液、苏木素-伊红(hematoxylineosin staining,HE)染色试剂盒(北京索莱宝科技有限公司);聚焦超声设备由昆明医科大学康复学院提供(包括信号发生器、功率放大器、超声探头等)。
1.2 实验动物及分组
实验动物采用SPF 级昆明小鼠55 只,雄性,8~9 周龄,体重≥28 g,由昆明医科大学实验动物学部提供,实验动物生产许可证号:SCXK(滇)K2020-0004,实验动物使用许可证号:SYXK(滇)K2020-0006。将实验动物随机分为0 mV 组、100 mV组、200 mV 组、500 mV 组和1200 mV 组,每组11 只。各组8 只用于脑组织中EB 含量测定,3 只用于病理学检查。本实验已通过昆明医科大学动物实验伦理审查(No:KMMU2019078)。
1.3 FUS开放小鼠BBB及取材
正确连接信号发生器、功率放大器、包封好的超声探头,并在信号发生器上设置好参数(基础频率为1 MHz,脉宽10 ms,总辐照时间120 s,脉冲重复频率1 Hz),检查仪器运行正常。将小鼠放于预麻箱中,打开麻醉系统,调整至合适的气流流速和麻醉剂(异氟烷)剂量。待小鼠麻醉进入平稳状态后将其固定于小鼠适配器上,用麻醉面罩持续给予麻醉支持,调整固定位置使小鼠颅顶与地面平行;用电推剪和脱毛膏予小鼠颅顶皮肤脱毛备用;用铁架台将超声探头固定于小鼠头皮上,中间用耦合剂填充,使探头正对小鼠左侧海马(Bregma-2.7 mm,lateral+2.5 mm)。按照说明书配置SonoVue®注射用六氟化硫微泡(平均粒径7.5 μm)溶液,配置好的微泡6 h 内有效。根据体重用胰岛素针抽取相应体积(2.5 μL/g)的微泡,以一定速度经尾静脉注入。10 s后打开信号发生器并计时,120 s 后关闭开关。经尾静脉注入2.5 μL/g 的EB 溶液(浓度2%,示意图见图1)。FUS 辐照4 h 后常规生理盐水灌注取鼠脑,用于HE 染色的标本放入4%的多聚甲醛溶液中固定,EB 定量评价的标本去除嗅球和小脑后待检。

图1 FUS开放BBB示意图
1.4 脑组织蓝染的定性评价及蓝染程度观察
肉眼观察鼠脑上视面和冠状切面EB 的渗出情况,并用单反相机对鼠脑上视面和冠状切面拍照。
1.5 脑组织蓝染程度的定量评价
以小鼠脑组织中EB 含量作为BBB 开放程度的指标。
1.5.1 EB 标准曲线制作配置25.00000 μg/mL、12.50000 μg/mL、6.25000 μg/mL、3.12500 μg/mL、1.56250 μg/mL 和0.78125 μg/mL 的EB溶液,用日本日立株式会社的U3010 型紫外分光光度计检测EB 溶液最大吸收峰,并检测最大吸收峰处各浓度EB 溶液的吸光度值,每个浓度梯度测量3 次,取平均值。对各浓度梯度及其所对应的吸光度值进行回归分析,求出回归方程并绘制EB 标准曲线。
1.5.2 各组脑组织EB 含量测定称重后的脑组织切成小块浸泡于含3 mL 甲酰胺溶液的5 mL 离心管中,做好标记并置于37℃恒温箱中萃取24 h,25℃下以3 000 r/min 离心10 min,取上清液1 mL 于比色杯中,以同体积甲酰胺作为空白对照,采用紫外分光光度计检测EB 最大吸收峰处样本溶液的吸光度值,每个样本测量3 次,取平均值。将3 mL 甲酰胺中EB 总含量除以脑组织总重量得到每克脑组织的EB 含量。
1.6 HE 染色检测不同输出电压下FUS 经颅开放BBB小鼠脑组织的变化
小鼠脑组织经常规固定、脱水后用OTC 包埋,制备厚度为10 μm 的冷冻切片(选取FUS 辐照中心区域切片)。将小鼠脑组织切片采用HE 染色,经脱水、透明后用中性树脂封片,并在显微镜下观察不同组小鼠脑组织变化。
1.7 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差()表示,先对数据进行方差齐性检验,若方差齐则进行单因素方差分析,进一步两两比较采用LSD-t检验;方差不齐则做H检验,若差异有统计学意义,对数据进行秩变换后再行两两比较(LSD-t检验)。P<0.05 为差异有统计学意义。
2 结果
2.1 不同输出电压下FUS经颅开放BBB的小鼠脑组织蓝染情况
0 mV 组脑组织未见EB 渗出,100 mV 组、200 mV组、500 mV 组、1 200 mV 组超声未辐照区域脑组织未见EB 渗出,辐照区域均有不同面积和程度的BBB开放,BBB 开放区域与辐照位置一致,说明当输出电压为100 mV、200 mV、500 mV、1 200 mV 时,FUS 可以开放BBB,且随着输出电压的升高,脑组织上视面和冠状面所对应的BBB 开放面积和蓝染程度逐渐增加,见图2。
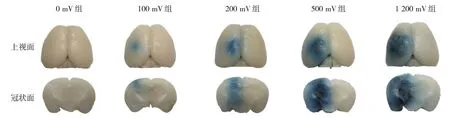
图2 不同输出电压下FUS开放BBB的小鼠脑组织蓝染情况
2.2 不同浓度EB溶液标准曲线
经全波长扫描发现EB 在620 nm 处有最大吸收峰,以甲酰胺作为空白调零液,对各梯度浓度的EB 吸光度及其浓度进行回归分析,回归方程:Y=12X+0.0925(Y为EB,X为吸光度值),R2=0.9999,拟合性好,所得标准曲线见图3。
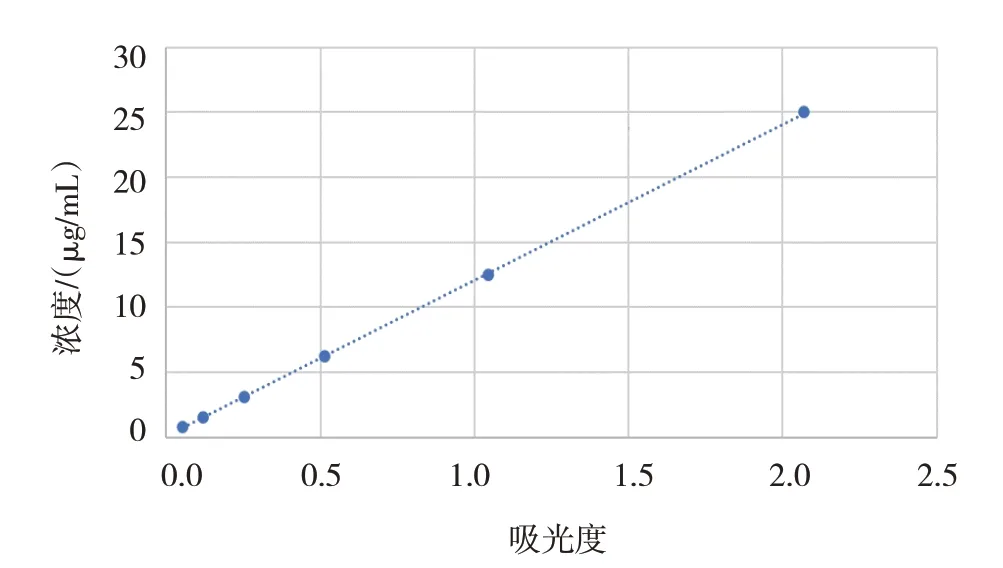
图3 不同浓度EB溶液的标准曲线
2.3 各组小鼠脑组织EB含量比较
0 mV 组、100 mV 组、200 mV 组、500 mV 组、1 200 mV 组小鼠脑组织EB 含量分别为(2.81±0.97)μg/g、(3.87±0.51)μg/g、(13.07±1.47)μg/g、(34.2±19.4)μg/g、(76.83±16.92)μg/g,经H检验,差异有统计学意义(H=35.958,P=0.000)。100 mV 组、200 mV 组、500 mV 组和1 200 mV 组小鼠脑组织EB含量分别与0 mV 组比较,差异有统计学意义(P<0.05),即当输出电压为100 mV、200 mV、500 mV和1 200 mV 时,FUS 可开放BBB。200 mV 组、500 mV组、1200 mV 组小鼠脑组织EB 含量分别与100 mV组比较,差异有统计学意义(P<0.05),且500 mV组和1200 mV 组小鼠脑组织EB 含量高于200 mV 组(P<0.05),1 200 mV 组高于500 mV 组(P<0.05),即随着输出电压升高,EB 渗透量逐渐增多,提示BBB 开放效率逐渐升高。
2.4 不同输出电压下FUS经颅开放BBB的小鼠脑组织受辐照情况
0 mV 组、100 mV 组、200 mV 组小鼠大脑受 超声辐照区域脑组织未见明显异常,均无红细胞渗出。500 mV 组小鼠大脑超声作用区域有红细胞渗出,该输出电压下FUS 同时开放BBB 不能兼顾安全性。1 200 mV 组小鼠大脑超声作用区域脑组织有大量红细胞渗出,该输出电压下FUS 亦无法安全开放BBB,见图4。
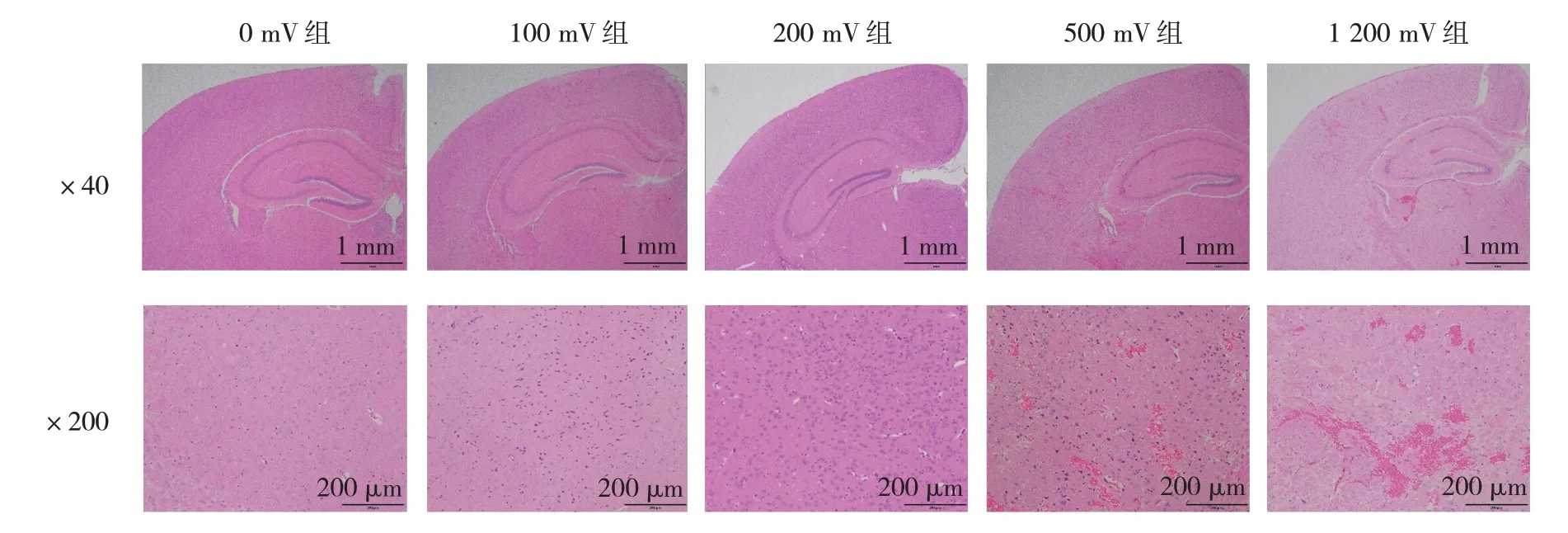
图4 不同输出电压下FUS经颅开放BBB小鼠脑组织受辐照情况(HE染色)
3 讨论
FUS 可将超声能量集中于焦点并于局部发挥作用。放大镜是FUS 的一个形象化类比[9],把放大镜置于阳光下,入射太阳光可汇聚于焦点,在焦点范围内更容易引燃可燃物,而在焦点外的区域则难以实现。由于其聚焦的特性,相比平面超声,FUS 作用更为集中,在神经调控等治疗领域更有优势。
BBB 的存在为脑组织疾病的治疗带来一定困难,开放BBB 有助于治疗药物进入脑组织,优化疗效[10]。静脉注射甘露醇是常见的BBB 开放方法,此方法可导致BBB 广泛开放,不具靶向性;电穿孔技术需将电极插入脑组织中,属有创治疗,难以推广[11]。FUS 联合微泡可安全、有效且可逆[6-7]地开放BBB 并提高治疗药物的递送效率[12-13]。有研究表明,FUS 开放BBB 可使脑恶性神经胶质瘤模型小鼠大脑肿瘤组织中贝伐单抗的含量增加至对照组的5.7 倍,小鼠中位生存期延长58%[4]。另1 项研究利用FUS 使BBB 局部开放,小鼠脑肿瘤组织中替莫唑胺含量明显增加[14]。此外,FUS 开放BBB 还可提高基因[15]、免疫细胞[16]、免疫因子[17]和天然化合药物[18]的递送效率。除了提高治疗药物的入脑效率外,FUS 开放BBB 本身也具有治疗作用。JORDÃO等[19]运用FUS 经颅开放AD 小鼠大脑BBB,在未递药的情况下观察到了β-淀粉样蛋白斑块明显减小,而且星形胶质细胞和小胶质细胞被激活,这两种胶质细胞中的β-淀粉样蛋白含量增加,提示星形胶质细胞和小胶质细胞被激活可能与β-淀粉样蛋白的内化作用有关。FUS 可在微泡作用下开放BBB,医学界对FUS 开放BBB 的机制进行大量探究,目前普遍认为FUS 开放BBB 的机制主要与超声波空化作用有关,当微泡流经FUS 作用区域时,会被不断压缩、膨胀甚至爆破,使血管内皮细胞之间的紧密连接出现松动,导致BBB 开放[20]。
FUS 是否能够开放BBB 与超声参数密切相关。有学者就不同子参数对FUS 开放BBB 的效率和安全性的研究结果显示,声压(一般由输出电压控制)和脉宽对FUS 开放BBB 的效率影响最大,并且与BBB 开放区域组织的损坏程度高度相关,而脉冲重复频率、总辐照时间、微泡种类及剂量等参数对FUS 开放BBB 的安全性影响较小[8]。本研究主要是在固定其他参数的情况下探讨最佳的输出电压值。由于技术原因,早期的FUS 实验需要移除颅骨[21],但随着FUS 技术和设备的进步,目前已实现经颅FUS 治疗。经颅FUS 联合微泡开放BBB 的实验中大多采用低频超声,因为其在穿过颅骨过程中产生的声束路径变形较小,可一定程度上减少颅骨的不利影响[22]。另外,大部分实验使用的脉冲重复频率为1 Hz[23],因此本研究选用基础频率1 MHz 的低频超声探头,并将脉冲重复频率设定为1 Hz。输出电压主要影响换能器所产生的声压值,在一定范围内,输出电压越高,所产生声压也越高。本研究结果显示,当FUS 基础频率为1 MHz,脉宽10 ms,总辐照时间120 s,脉冲重复频率1 Hz,SonoVue®注射用六氟化硫微泡(平均粒径7.5 μm)剂量2.5 μL/g时,输出电压为100 mV、200 mV、500 mV、1200 mV时FUS 均能够开放BBB。100 mV 时BBB 开放效率较低,而200 mV、500 mV、1 200 mV 的输出电压可高效开放BBB;就安全性而言,100 mV、200 mV的输出电压可安全开放BBB,而500 mV、1200 mV在开放BBB 的同时难以保证安全性,200 mV 既能有效开放BBB,又能保障安全性,后续实验中笔者将把200 mV 作为输出电压。
综上所述,本实验利用现有FUS 治疗系统,固定FUS 基础频率为1 MHz,脉宽10 ms,总辐照时间120 s,脉冲重复频率1 Hz,SonoVue®注射用六氟化硫微泡(平均粒径7.5 μm)剂量2.5 μL/g,探索出可经颅、高效、安全开放小鼠BBB 的输出电压为200 mV,为下一步FUS 经颅无创开放BBB 治疗脑组织疾病提供依据。

