三阴性乳腺癌MRI影像及病理免疫分子标志物特征与非三阴性乳腺癌对比研究
沈文彬,李清蓉
(遂宁市中心医院放射影像科 四川 遂宁 629000)
乳腺癌多数起源于乳腺导管上皮组织,由各种原因所致上皮细胞过度表达及增殖所致。据WHO 2020年的统计数据[1],乳腺癌已经成为全球第一大癌症,每年新发病例约220万,死亡病例约68万,严重影响人们生活健康,是临床关注的重点。在我国,乳腺癌发病年龄更为年轻。早期乳腺癌患者几乎无临床症状,多数患者首次就诊,多因无意中扪及乳腺结节就诊。但是由于我国经济条件仍然不发达,多数乳腺癌患者就诊时,已为中晚期患者。临床治疗效果差,五年生存率明显低于早期乳腺癌患者。因此,进一步探讨乳腺癌的早期发现、早期治疗在我国是十分重要的。
MRI成像是早期诊断乳腺癌的主要影像学方法。目前,应用MRI多模态对三阴性乳腺癌(triple-negative breast cancer,TNBC)及非TNBC乳腺癌的影像学特点进行对比、总结,意见有部分国内外研究报道[2-4]。但是上述研究病例数相对较少,而且对TNBC的病理免疫分子标志物对比分析较少。因此,本研究回顾性收集遂宁市中心医院2018年3月—2022年6月经临床病理证实TNBC的患者及非三阴性乳腺癌患者各80例,总结TNBC的MRI影像及病理免疫分子标志物特征,以提高认识。报道如下。
1 资料与方法
1.1 一般资料
回顾性收集遂宁市中心医院乳腺外科及胸外科2018 年3月—2022年6月经手术大体病理证实的TNBC患者及非三阴性乳腺癌患者各80,TNBC患者作为研究组,非三阴性乳腺癌患者作为对照组。两组患者均为女性,研究组年龄28.3~62.9岁,平均年龄(35.8±5.7) 岁;对照组30.4~68.1岁,平均年龄(40.3±8.9) 岁。按照根据免疫组化表达情况分型:TNBC 80例(研究组);三阴性乳腺癌80例(对照组),其中Luminal A型28例;人类表皮生长因子受体2(human epidermal growth factor receptor,HER-2)过表达型20例;Luminal B(HER-2阴性)组17例;Luminal B(HER-2 阳性)组15例。所有患者于术前1~2 周行MRI检 查。
纳入标准:①患者首次就诊、首次发现乳腺肿块,术后病理证实为乳腺癌;②所有患者MRI检查前无穿刺活检、内分泌治疗、新辅助化疗、局部放疗及靶向药物治疗病史;③患者及家属均知情并签署知情同意书。排除标准:①患者临床、影像或免疫分子标志物(Ki67、AR、EGFR、CK5/6、P170及TopoⅡ)资料不完整;② 其他部位恶性肿瘤患者。
1.2 方法
MRI检查设备采用Siemens MAGNETOM Vida 3.0T磁共振扫描仪;患者取俯卧位,头先进,乳腺专用线圈,常规T1WI及T2WI序列扫描后,进行动态增强扫描及弥散加权成像。
动 态 增 强 扫 描:采 用grasp序 列,TR/TE为3.50 ms/1.40 ms,层厚1.0 mm,FOV 340 mm×340 mm,矩阵265×265,6~7个时相,每个时相60 s,对比剂采用钆喷酸葡胺DTPA用量为0.2 mmol/kg体重,肘静脉注射,注射速率为2 mL/s。
弥散加权成像:采用EPI序列,扩散敏感系数(b值)为0 s/mm2及1 000 s/mm2。
1.3 观察指标及评定标准
影像观察内容为乳腺癌形态、大小、边缘、强化方式、TIC曲线及ADC值,病理学观察指标为免疫分子标志物(Ki67、AR、EGFR、CK5/6、P170及TopoⅡ)的表达情况。影像学观察内容由2名晋升主治医师3年以上乳腺组诊断医师单独判断,若不一致,协商后决定;病理学观察内容有一名晋升主治医师3年以上病理学医生单独进行。
乳腺癌形态、大小、边缘、强化方式及TIC曲线判断标准为乳腺影像报告和数据系统(BI-RADS)及中国抗癌协会乳腺癌诊治指南与规范[5]。ADC值测量应选取病灶实质部分,避开液化坏死区、出血及钙化,多点测量并取平均值。
免疫分子标志物表达采用常规免疫组织化学方法进行检测及判断:①Ki67:阳性细胞数<20%为低表达,≥20%为高表达;②P170及TopoⅡ:阳性细胞≤10%为阴性,>10%为阳性;③AR:阳性细胞≤1%为阴性,>1%为阳性;④EGFR及CK5/6阳性是指任何数量的癌细胞胞浆和/或胞膜着色。
1.4 统计学方法
采用SPSS 26.0统计软件进行数据分析,符合正态分布的计量资料以均数±标准差(± s)表示,组间比较采用独立样本t检验;计数资料以频数(n)、百分率(%)表示,采用χ2检验或Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 两组病灶MRI征象对比结果
两组患者的病灶大小、TIC曲线类型及ADC值比较差异均无统计学意义(P>0.05);TNBC乳腺原发病灶更容易表现为类圆形肿块(42.5%,34/80),边缘光滑(47.5%,38/80),呈环形强化(56.3%,45/80),两组比较差异有统计学意义(P<0.05),见表1。
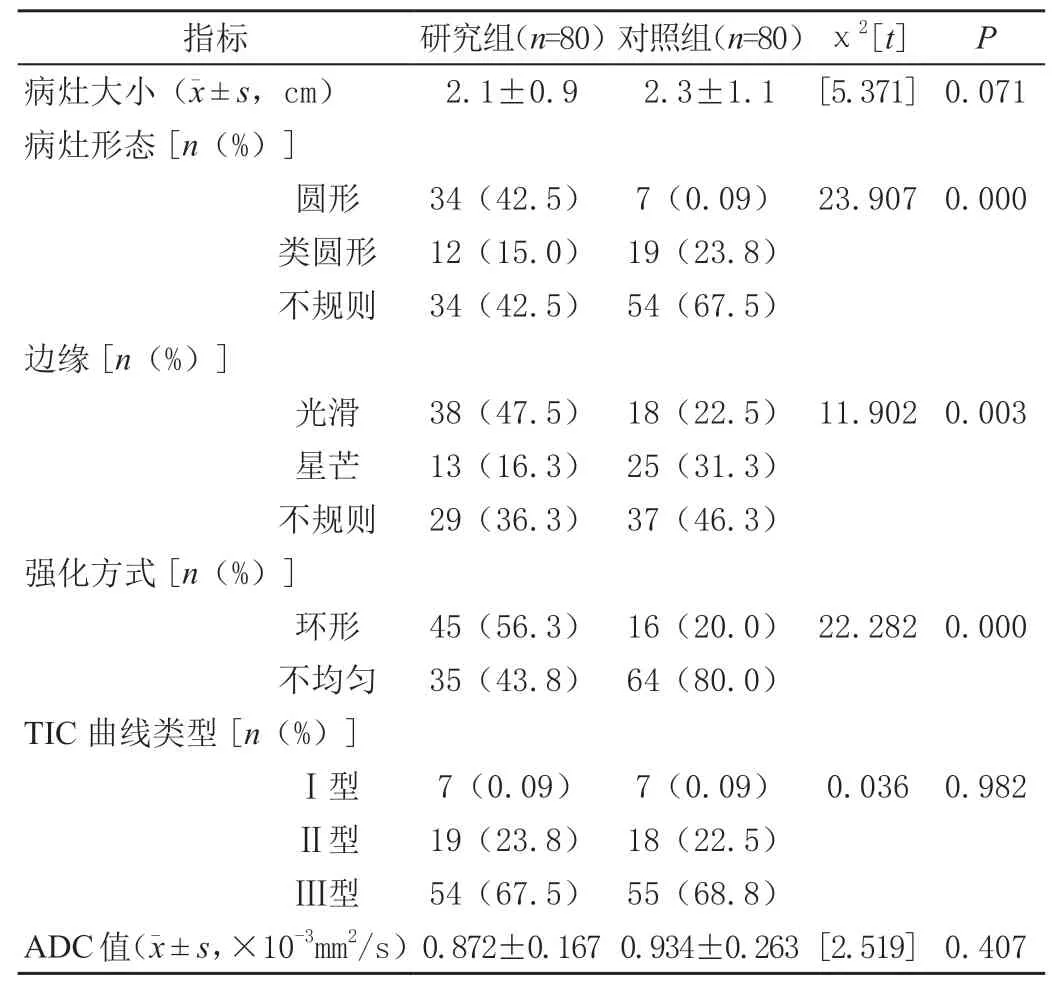
表1 两组病灶MRI征象对比结果
2.2 两组患者免疫分子标志物表达对比结果
TNBC患者病灶AR表达水平显著低于非三阴性乳腺癌患者(P<0.01),Ki67、EGFR、CK5/6、P170及TopoⅡ表达水平显著高于非三阴性乳腺癌患者(P<0.01),见表2。
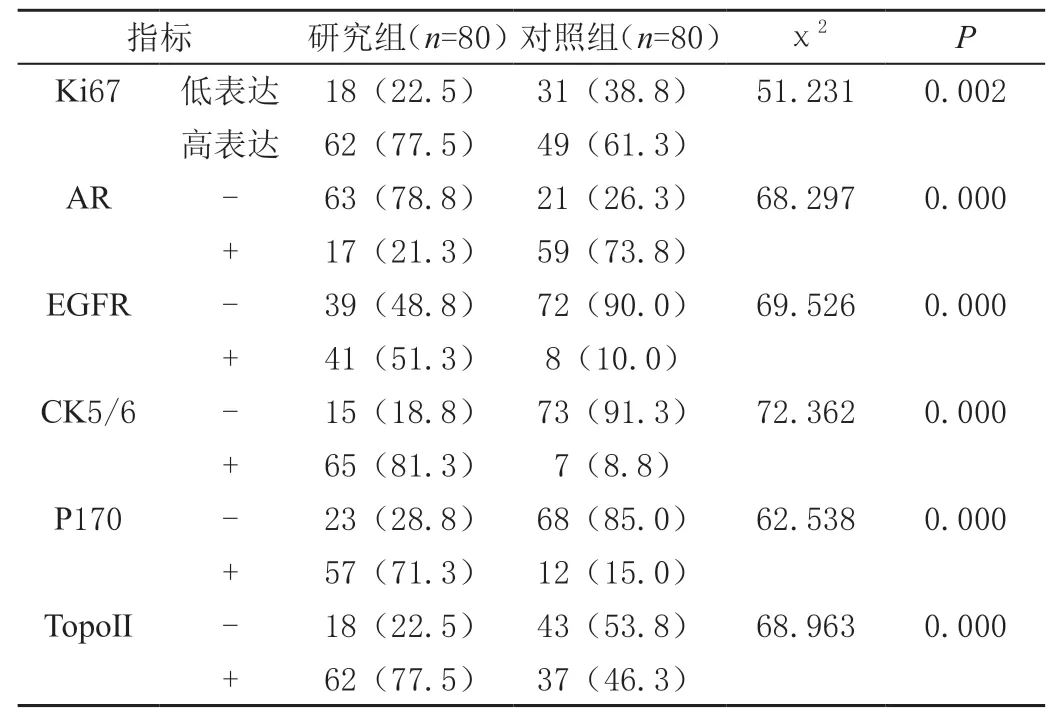
表2 两组病灶免疫分子标志物表达对比结果[n(%)]
3 讨论
近年来,乳腺癌的分子分型在乳腺癌的治疗中占据非常重要的地位。具体临床实践中,病理学根据乳腺癌分子免疫组化表达情况,将其分为4种亚型。病理学分型常用的4种受体分别为:孕激素受体(progesterone receptor,PR)、雌激素受体(estrogen receptor,ER)、人类表皮生长因子受体2(HER-2)及Ki-67。三阴性乳腺癌(TNBC)是指ER、PR及HER-2均阴性表达的癌灶。TNBC约占所有乳腺癌的四分之一左右,对临床常规内分泌、靶向治疗不敏感,早期容易侵袭及转移,预后相对较差。但是,TNBC患者术前新辅助化疗能有效缩小病灶大小及降低转移的可能性,进而提高预后[6-7]。因此,早期准确判断或提示乳腺癌三阴性具有重要的临床意义。
术前MRI准确判断或提示乳腺癌三阴性具有重要的临床意义。本次研究中,TNBC磁共振成像病灶更易出现类圆形、边缘光滑及环形强化病灶。其可能的原因是:①TNBC癌灶不同于其他分子亚型浸润性生长,反而在大体上表现出假包膜特点,呈一定程度上膨胀性生长,边缘光滑的特点,与良性肿瘤影像学特点类似。这与部分研究结果是一致的[8-9]。需要注意的是,虽然TNBC大体上呈类圆形,但是进一步病理切片证明TNBC对周围组织结构浸润并不少见,可见多发小毛刺。但可能由于TNBC生长非常快,其癌细胞增殖明显快于周围浸润的速度,其向周围膨胀、推压速度明显快于逐渐浸润、蔓延速度,因此其影像学多呈类圆形改变。②TNBC环形强化可能是由于病灶外周部细胞增殖活跃,细胞密度明显高于病灶中央部[10-11]。因此动态增强扫描时,外周部强化程度高于中央部,呈环形强化特点。③TNBC环形强化还可能是因为,癌灶增殖明显,生长迅速,病灶中央部常常存在不同程度缺血坏死[12]。
TNBC癌灶Ki67、EGFR、CK5/6、P170及TopoⅡ表达水平明显高于非三阴性乳腺癌患者。这与临床实际是符合的,Ki67、EGFR、CK5/6、P170及TopoⅡ均与细胞增殖能力有关,细胞增殖速度越快,相应水平表达越高[13]。AR属于核受体超家族中的类固醇受体,在乳腺癌中的表达率与病灶组织学分级呈负相关。一般来说,TNBC癌症恶性程度明显高于非三阴性乳腺癌,其病理组织分级程度也明显高于非三阴性乳腺癌。因此,本研究结果认为TNBC AR表达低于对照组,符合实际。这也与以往研究一致[14-15]。
综上所述,非三阴性乳腺癌相比,TNBC更容易出现类圆形、边缘光滑及环形强化病灶,其Ki67、EGFR、CK5/6、P170及TopoⅡ高表达,常提示其预后较差。在临床实际工作中,应注意结合TNBC MRI表现与病理特点进行综合评估,为临床治疗提供依据。

