低温等离子体对低盐泡菜生花腐败的抑制及贮藏期品质的影响
侯新磊,赵 楠,葛黎红,梅 源,曾雪晴,严文静,章建浩,*
(1.南京农业大学食品科学技术学院,江苏 南京 210095;2.四川省农业科学院农产品加工研究所,四川 成都 610066;3.四川师范大学生命科学学院,四川 成都 610101)
泡菜腐败是指由腐败微生物及其代谢产物引起的泡菜表面形成白色浮膜或点片状白斑(生花),并出现色泽变暗、质构软烂、异味物质和有害物质产生等一系列品质劣化甚至存在安全风险的现象[1],是泡菜贮运过程中引起经济损失的主要食品安全问题,仅四川泡菜每年因产品腐败导致的经济损失达10亿 元[2],造成了巨大的生产资源浪费。低盐泡菜的乳酸菌活性及其独特发酵香气对热敏感,故实际生产中通常不经热杀菌,直接通过冷链进行运输及销售[3]。因此,物流过程中产品发酵仍持续进行,低盐环境下泡菜中乳酸菌产酸迅速,且产品低盐、高酸的特性极易引起毕赤酵母、假丝酵母等产膜微生物利用乳酸迅速繁殖,在产品贮运后期形成膜醭并引发生花腐败,这不仅造成明显的感官品质劣变,极大地影响消费者接受度,而且乳酸的大量消耗使泡菜体系pH值上升,导致对酸敏感的腐败菌生长抑制解除,腐败菌的滋生进一步加速了泡菜腐烂变质、风味劣化,甚至引发严重的食品安全问题[4]。因此,采用低温杀菌方法控制膜醭微生物是保证低盐泡菜贮运安全的关键。
介质阻挡放电(dielectric barrier discharge,DBD)低温等离子体杀菌是一种低破坏性的新型冷杀菌技术,可通过放电电离产生的活性氮/氧自由基、氧化剂、紫外光子及高能粒子等实现食品基质表面微生物的灭活,具有能耗低、杀菌效果好、热敏性食品感官品质破坏小及无二次污染等多重优势[5-6]。随着对食品营养、健康及品质追求的提高,消费者对最低限度加工的生鲜食品需求日益扩大,DBD低温等离子体对于生鲜食品的冷杀菌与保鲜成为研究热点。目前,研究显示DBD低温等离子体处理在鲜切果蔬、肉及肉制品、水产品及其制品等多种生鲜产品的保质、保鲜及货架期延长方面表现出明显优势[7-9]。已有研究发现DBD低温等离子体对泡菜中产气酵母杀菌效果明显,并能缓解产品的胀袋问题[10]。经前期预实验研究发现,DBD低温等离子体可显著抑制腌制萝卜的膜醭生成,目前有关DBD低温等离子体对低盐泡菜产膜及生花腐败的抑制作用研究尚鲜见报道。
本研究模拟泡菜包装产品的生产及物流过程,对发酵1 d的低盐泡菜包装后进行DBD低温等离子体杀菌处理,并进行25 ℃常温贮藏实验,探究DBD低温等离子体对低盐泡菜生花腐败的抑制及贮藏品质的影响,以期为低盐泡菜包装产品品质及安全控制提供新思路。
1 材料与方法
1.1 材料与试剂
新鲜白萝卜、红皮萝卜、胡萝卜、大蒜、泡菜盐、矿泉水均购于成都生鲜超市;发酵老母水由四川眉山某泡菜企业提供。
平板计数琼脂(plate counting agar,PCA)培养基、MRS(Man-Rogosa-Sharpe)琼脂培养基、孟加拉红琼脂(red bengal agar,RBA)培养基、酵母浸出粉胨葡萄糖肉汤(yeast extract peptone dextrose broth,YPDB)、月桂基硫酸盐胰蛋白胨肉汤(lauryl sulfate tryptose broth,LSTB)、煌绿乳糖胆盐肉汤(bright green lactose bile broth,BGLB) 青岛海博生物技术有限公司;乙酸锌、亚铁氰化钾、硼酸 成都金山试剂有限公司;亚硝酸钠、对氨基苯磺酸、盐酸萘乙二胺、氢氧化钠标液 成都科隆试剂有限公司;所有试剂均为分析纯。
1.2 仪器与设备
DBD低温等离子体设备由南京农业大学食品科学技术学院、苏州屹润食品科技有限公司、南京屹润等离子体科技有限公司联合研发;自动封膜包装机 浙江利强包装科技公司;Synergy HTX多功能型酶标仪 美国BioTek公司;CR-400色差仪 日本Chroma Meter公司;TA.XT. Plus质构仪 英国Stable Micro Systems公司;Intuvo9000-GC System-5977b气相色谱-质谱联用仪美国Agilent公司。
1.3 方法
1.3.1 泡菜制备及样品处理
将白萝卜洗净、去皮,切成1 cm×1 cm×5 cm左右的条状,将红皮萝卜、胡萝卜切成较大的块状,大蒜去皮一并放入泡菜陶坛,发酵液为泡菜发酵老母水,蔬菜与老母水质量比1∶2,以水封坛,参考企业实际生产加工工艺,将泡菜坛置于25 ℃恒温箱发酵1 d,得到发酵酸度稳定的泡菜样品备用。
样品包装:取泡白萝卜条150 g于聚丙烯保鲜盒(150 mm×100 mm×30 mm)中,加入150 mL 2 g/100 mL NaCl溶液,随后进行聚乙烯薄膜密封包装。随机将全部样品分为3 组,每组各15 盒。
样品处理:对照组无任何杀菌处理;根据前期DBD低温等离子体杀菌效果预实验,DBD组在电压70 kV、频率50 Hz条件下单次处理180 s,循环4 次;参考文献[10]中低盐泡菜的巴氏杀菌处理参数,选择70 ℃水浴加热处理30 min。处理后将3 组样品置于25 ℃恒温培养箱,分别于第0、1、2、3、5天取样进行微生物数量、色差、脆度测定,挥发性风味物质和其他理化指标为取样后冻存于-80 ℃,待取样结束(5 d)测定[11]。
1.3.2 微生物计数
取泡菜样品,参考GB 4789.2—2016《食品微生物学检验 菌落总数测定》进行菌落总数的测定;参考GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》进行乳酸菌数的测定;参考GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》进行酵母菌数的测定;参考GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》进行大肠菌群的测定。
产膜酵母的判定与计数:取泡萝卜样品25 g加入225 mL无菌生理盐水摇匀,并依次用生理盐水进行10 倍梯度稀释,取不同梯度稀释样液100 μL涂布于RBA平板于28 ℃培养48 h。用无菌接种环挑取所有不同形态的酵母菌菌落接种于含YPD液体培养基的96 孔板,每个菌落接种3 孔作为平行,并于28 ℃下培养48 h。将孔板中有膜醭产生的酵母计为产膜酵母,并对RBA平板上的产膜酵母计数[12]。
1.3.3 理化指标测定
采用pH计及电位滴定法测定3 组贮藏不同时间泡菜发酵液的pH值和总酸质量浓度[13];参考GB 5009.33—2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》中的分光光度法测定亚硝酸盐质量浓度。
1.3.4 色泽测定
采用色差仪,对各组泡萝卜相同部位进行亮度(L*值)、红度(a*值)、黄度(b*值)测定,测定前经标准白板校正。每个样品测定6 次,结果取平均值。
1.3.5 脆度测定
采用1 kg标准砝码校正质构仪,然后对各组泡萝卜相同部位进行测定,选用P2探头,测前、测中、测后速率均设为1 mm/s,压缩应变设为50%,测试距离固定为15 mm。每个样品测定8 次,结果取平均值。脆度为探头下压过程中第1压缩周期的第1个峰值处所测力,为物料最大承受压力,单位为g。
1.3.6 挥发性风味物质相对含量测定
参考文献[14]的方法,将5 mL泡菜发酵液置于20 mL自动进样瓶进行50 ℃振摇加热20 min,萃取头经250 ℃老化30 min后插入进样瓶吸附30 min,随后于250 ℃气相色谱仪进样口处解吸5 min。气相色谱条件:色谱柱为HP-5MS UI(30 m×0.25 mm×0.25 μm);载气为He;流速1.0 mL/min;自动无分流进样;升温程序:初温40 ℃维持3 min,然后以5 ℃/min升高至150 ℃,维持3 min,最后以10 ℃/min升高至250 ℃,维持3 min。质谱条件:离子源和接口温度分别为230 ℃和280 ℃;电子电离源;扫描范围m/z35~550。经NIST 17.L谱库检索,对匹配度大于750的物质定性,采用面积归一化法计算相对含量。
1.4 数据处理与分析
数据处理与差异分析采用SPSS 24.0软件,采用单因素方差分析、Duncan多重比较进行差异显著性分析;采用SIMCA 14.1软件进行偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA);采用Origin 2021软件作图。
2 结果与分析
2.1 DBD低温等离子体杀菌对低盐泡菜生花腐败的影响
如图1所示,贮藏终点(第5天)时不同处理组泡菜的外观特征差异明显,对照组已出现生花腐败,泡菜水表面产生较多白色浮膜,且盐水浑浊(图1A);巴氏杀菌组未生花,但萝卜表面颜色变暗,且内部组织纹路较明显(图1B);DBD低温等离子体杀菌组未生花,且盐水清亮,萝卜组织较为细嫩(图1C)。上述结果表明低盐泡菜在常温贮藏过程中易发生生花腐败,巴氏杀菌尽管可有效控制低盐泡菜的生花现象,但对产品色泽、质地造成明显破坏,而DBD低温等离子体处理不仅能有效控制低盐泡菜在贮藏过程中的生花腐败,还能保证产品具有较好的感官品质。
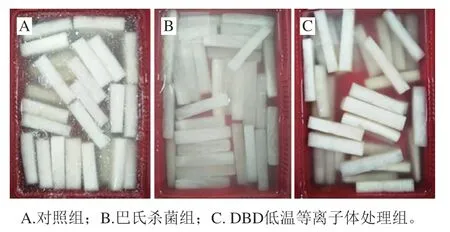
图1 贮藏终点不同处理组低盐泡菜产品外观对比Fig. 1 Comparison of appearance of low-salt paocai in different treatment groups at the end of storage
2.2 DBD低温等离子体杀菌对低盐泡菜贮藏期微生物数量的影响
为确定DBD低温等离子体处理对低盐泡菜贮藏期微生物数量的影响,对3 组泡菜中的菌落总数、乳酸菌、酵母菌及大肠菌群进行计数。如图2A~C所示,贮藏期间对照组菌落总数、乳酸菌、酵母菌数均不断增长并逐渐达到6~7(lg(CFU/g)),巴氏杀菌组在贮藏期间未检测到活菌,DBD低温等离子体处理后短时间内(第0、1天)菌落总数、乳酸菌及酵母菌数均有不同程度的降低且明显低于对照组,贮藏期间菌落总数对数值降低了1.54~3.55(lg(CFU/g))。其中DBD低温等离子体对酵母菌的杀菌效果最好,处理后酵母菌数对数值第0天时较对照组降低2.31(lg(CFU/g)),贮藏第1天时较对照组降低4.21(lg(CFU/g)),在贮藏期间较对照组降低2.12~4.21(lg(CFU/g))。这是由DBD产生的·OH、NO·、1O2、O3及等直接氧化蚀刻,以及粒子间碰撞生成、H2O2并溶于发酵液的综合作用结果[15]。此外,泡菜的酸性基质利于和H2O2反应生成高活性的ONOOH,ONOOH可直接透过微生物细胞膜,对胞内结构造成不可逆损伤[16]。对照组仅在第0天检测到大肠菌群(4 300 MPN/100 g),巴氏杀菌和DBD低温等离子体杀菌组在贮藏期间未检出(图2E),表明巴氏杀菌和DBD处理可将大肠菌群全部灭活。
为进一步明确DBD对膜醭微生物的影响,对酵母菌中的产膜酵母进行计数。第0天3 组泡菜中均未检测到产膜酵母,表明产品包装后产膜微生物初始菌数很少。第3天对照组开始检测到产膜酵母(2.81(lg(CFU/g))),表明已开始发生生花腐败,贮藏3~5 d迅速增长,第5天增长至6.17(lg(CFU/g)),并出现生花现象,这可能是贮藏期间产品内部环境发生变化导致了产膜酵母的快速生长。DBD低温等离子体杀菌组在第5天时检测到产膜酵母(1.64(lg(CFU/g))),比同时期对照组产膜酵母数对数值降低4.53(lg(CFU/g)),且其生长趋势明显放缓,泡菜未生花,表明DBD低温等离子体处理对产膜酵母具有良好的杀灭效果,即便部分产膜真菌未被完全杀灭,但在贮藏期其成膜能力也受到较大影响。原因可能是DBD低温等离子体处理抑制产膜酵母产膜相关基因如FLO基因家族的表达,进而影响产膜相关系列蛋白表达,使其成为浮游态,从而抑制了其生长及成膜生花[17-18]。综上,DBD低温等离子体处理可通过抑制产膜酵母生长并破坏其成膜能力有效控制泡菜生花腐败,同时保留部分乳酸菌活性,有利于保证产品的益生功效。
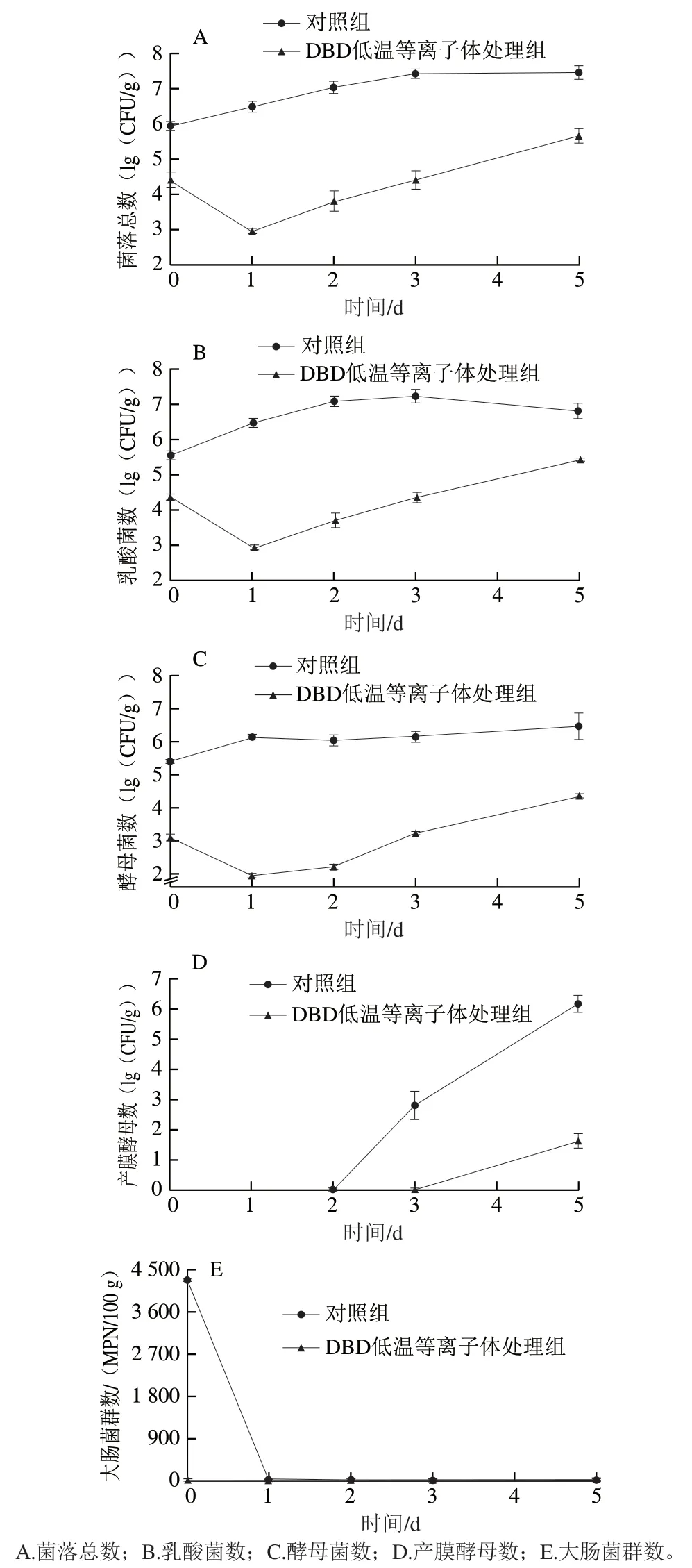
图2 不同处理对低盐泡菜贮藏期间微生物数的影响Fig. 2 Effect of different treatments on the microbial load of low-salt paocai during storage
2.3 DBD低温等离子体处理对低盐泡菜贮藏期品质的影响
2.3.1 DBD低温等离子体处理对低盐泡菜贮藏期pH值和总酸质量浓度的影响
pH值及总酸含量反映了泡菜的发酵状态,总酸质量浓度在0.6~0.8 g/100 mL之间的泡菜风味口感最佳[19]。如图3所示,巴氏杀菌造成乳酸菌被全部灭活,贮藏期间始终保持较高的pH值和较低的总酸质量浓度。对照组在贮藏0~3 d pH值从4.26降低至3.49,总酸质量浓度从0.11 g/100 mL上升至0.48 g/100 mL,但贮藏3 d后pH值上升且总酸质量浓度下降,第5天pH值达3.89,总酸质量浓度降低至0.17 g/100 mL,这可能是因为在此期间产膜酵母大量繁殖导致乳酸消耗增加,同时pH值升高也表明产品开始出现腐败[20]。DBD低温等离子体杀菌组pH值从4.17逐渐降低至3.25,总酸质量浓度从0.13 g/100 mL逐渐上升至0.65 g/100 mL,并在贮藏终点(第5天)达到了口感最佳的酸度范围,这可能是由于DBD低温等离子体对酵母菌的杀菌效果优于乳酸菌,从而保证了乳酸菌在体系内的优势地位,乳酸菌数量在贮藏期间不断上升,此外也与DBD低温等离子体处理对消耗酸的产膜酵母的抑制作用有关。以上结果表明,DBD低温等离子体处理在抑制产膜酵母生长的同时保证了乳酸菌在发酵体系中的优势地位,从而有效控制贮藏期间pH值的上升及产品腐败。
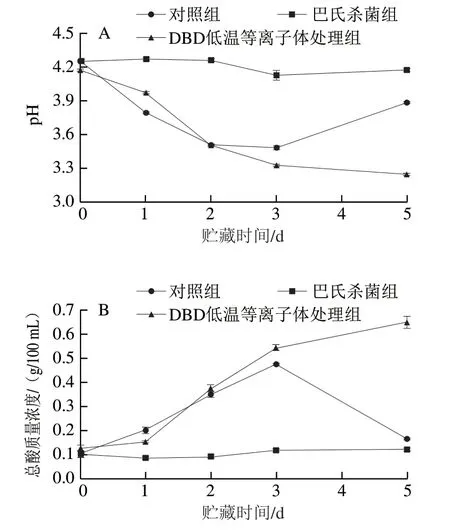
图3 不同处理对低盐泡菜贮藏期间pH值(A)和总酸质量浓度(B)的影响Fig. 3 Effect of different treatments on pH (A) and total acid content (B)of low-salt paocai during storage
2.3.2 DBD低温等离子体处理对低盐泡菜贮藏期亚硝酸盐质量浓度的影响
亚硝酸盐是衡量泡菜食用安全性的重要指标。由图4可知,贮藏期间巴氏杀菌组亚硝酸盐质量浓度最低且变化不大,维持在2.30~3.26 mg/L。对照组在贮藏第1天的亚硝酸盐质量浓度为4.60 mg/L,贮藏1~3 d下降是因为乳酸菌不断发酵产酸,抑制体系内杂菌的生长,贮藏3~5 d又升高可能是pH值上升导致对不耐酸杂菌生长的抑制解除[21]。DBD低温等离子体杀菌组亚硝酸盐质量浓度在第0天最高,为6.52 mg/L,远低于GB 2762—2017《食品安全国家标准 食品中污染物限量(含第1号修改单)》[22]限定的20 mg/kg(或mg/L),并且在贮藏1 d后亚硝酸盐质量浓度迅速下降至较低水平,第5天时仅检出3.13 mg/L。由活性粒子碰撞产生并溶于泡菜发酵液中,其含量在贮藏期逐渐降低的变化趋势与Qian Jing等[23]的研究结果一致。综上,DBD低温等离子体处理后短时间内(第0天)会导致亚硝酸盐含量有所上升,但远低于GB 2762—2017规定限值,并且在贮藏期间其含量迅速下降至较低水平。
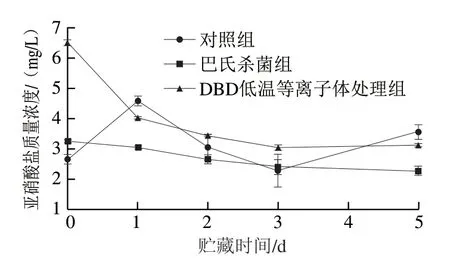
图4 不同处理对低盐泡菜贮藏期间亚硝酸盐质量浓度的影响Fig. 4 Effect of different treatments on nitrite content of low-salt paocai during storage
2.3.3 DBD低温等离子体处理对低盐泡菜贮藏期色泽的影响
低盐泡菜色泽可由L*、a*、b*值反映,3 个指标分别表示颜色的明暗程度、红绿程度和黄蓝程度。由表1可知,3 组a*值较为接近,L*值和b*值差异较大。相较于对照组,DBD低温等离子体处理后短时间内(第0天)的L*、b*值显著降低(P<0.05),贮藏期间L*值逐渐与对照组接近,b*值偏高,但与对照组无显著差异(P>0.05)。巴氏杀菌组低盐泡菜L*和b*值在贮藏期间一直显著低于对照组和DBD低温等离子体杀菌组(P<0.05),这与Hou Yanan等[24]研究结果一致。上述结果表明DBD低温等离子体处理对低盐泡菜色泽影响不大,并能显著改善巴氏热杀菌造成的泡菜L*、b*值降低、表面颜色变暗。
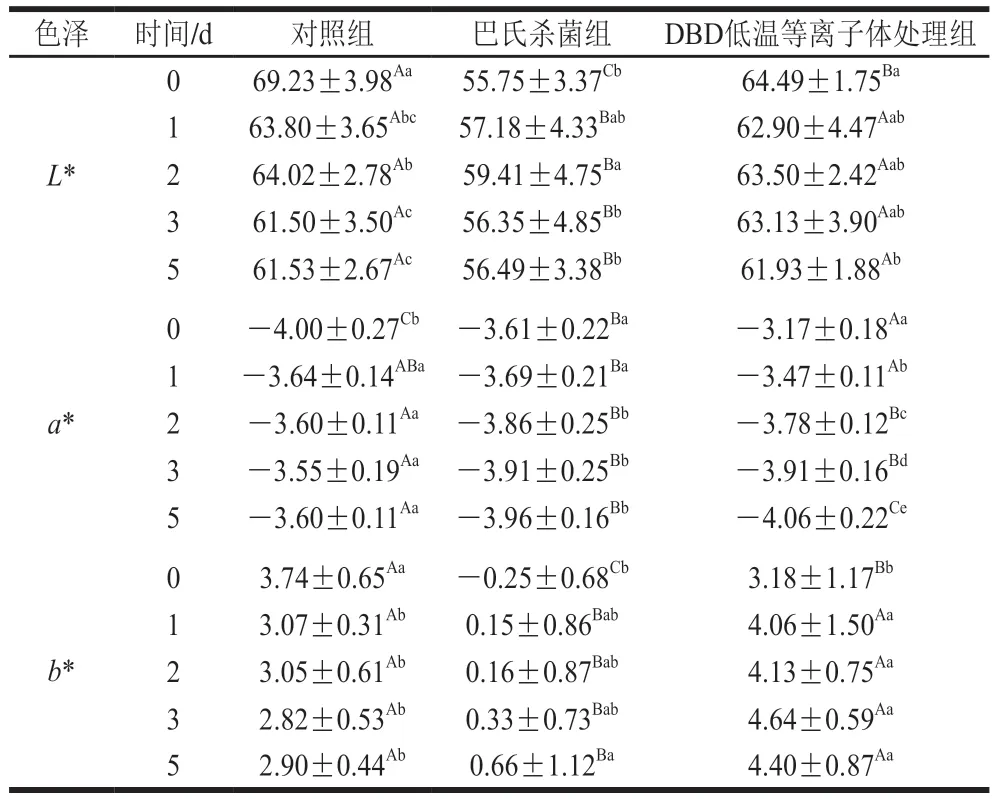
表1 不同处理对低盐泡菜贮藏期间色泽的影响Table 1 Effect of different treatments on color parameters of low-salt paocai during storage
2.3.4 DBD低温等离子体处理对低盐泡菜贮藏期脆度的影响
脆度在一定程度上反映了泡菜的质构特性,发酵过程中微生物分泌的胞外酶及蔬菜组织细胞的部分内源酶对细胞壁聚合物的降解导致脆度逐渐降低、质构变软[25-26]。如图5所示,巴氏杀菌组低盐泡菜脆度在贮藏期间明显低于对照组和DBD低温等离子体杀菌组;对照组在贮藏第1天时脆度最高,贮藏1~5 d逐渐降低;DBD低温等离子体杀菌组脆度在贮藏2~5 d高于巴氏杀菌组和对照组,表明DBD低温等离子体处理可改善热杀菌导致的脆度下降,并适度减缓泡菜正常发酵过程中发生的质构软化,这可能与DBD低温等离子体杀菌和钝酶的双重作用有关[27]。
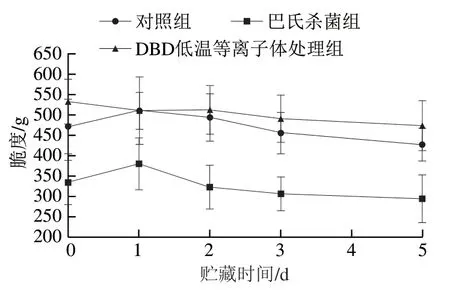
图5 不同处理对低盐泡菜贮藏期间脆度的影响Fig. 5 Effect of different treatments on brittleness of low-salt paocai during storage
2.3.5 DBD低温等离子体处理对低盐泡菜贮藏期挥发性风味物质的影响
挥发性风味物质是泡菜风味的重要组成部分,为探究不同处理对低盐泡菜挥发性风味物质的影响,以物质含量指标为变量X,不同处理组样本作为分类变量Y,对贮藏第0和5天的3 组泡菜样品进行PLS-DA。第0天模型为0.931、为0.988、Q2为0.979,第5天模型、Q2为0.985,表明两个模型稳定可靠[28]。双标图中的小椭圆和大椭圆分别表示置信度为75%和100%。
由图6A可知,第1主成分解释了71.8%的变量信息,第0天巴氏杀菌组与第1主成分呈明显负相关,而对照组和DBD低温等离子体杀菌组与第1主成分呈正相关,表明DBD低温等离子体处理对低盐泡菜主体风味物质影响不大,而巴氏杀菌对风味物质造成较大影响。对照组和DBD低温等离子体杀菌组在第1主成分贡献较大的挥发性风味物质有己酸、丁酸丁酯、2,4-二甲基苯甲醛、乙酸、辛酸、乙酸乙酯、癸酸乙酯、2-乙基己醇和丁酸乙酯。挥发性风味物质中,二甲基二硫、三芥子酸甘油酯、二甲基三硫及3-(甲硫基)丙基异硫氰酸酯与巴氏杀菌组密切相关;异戊醇、2,2-二甲基-4-戊烯醛、17-十八炔酸及2,4-二叔丁基苯酚与对照组密切相关;丙酸丁酯、苯甲醛及10-十一烯醛与DBD低温等离子体杀菌组密切相关,与文献[29]研究结果相似。其中二甲基二硫、三芥子酸甘油酯、二甲基三硫、异戊醇、丙酸丁酯的变量投影重要性(variable importance projection,VIP)值大于1(图6B),对3 组样本分组贡献较大。异戊醇呈醚香,丙酸丁酯呈果香,烯醛类、不饱和酸、苯酚、苯甲醛及含硫类物质在泡菜中均较为常见,含量适宜可为泡菜提供清香、酸香、坚果、辛辣等特殊香气。其中含硫类物质阈值极低,巴氏杀菌组由于含硫类物质含量过多,导致泡菜呈腐烂蔬菜味[30-31]。综上,DBD低温等离子体处理后短时间内(第0天)对泡菜主体风味物质影响不大,无对风味不利的物质产生,巴氏杀菌组风味物质与对照组和DBD低温等离子体杀菌组明显不同,风味劣化严重。
由图6C可知,贮藏期间巴氏杀菌组风味物质变化不大,贮藏第5天仍以含硫类物质为主,对照组和DBD低温等离子体杀菌组主要共有挥发性物质为异丁酸丁酯、丁酸乙酯、异戊醇、乙酸、丁酸丁酯和乙酸乙酯。此时对照组已出现生花腐败并伴有异味产生,而DBD低温等离子体杀菌组未发生生花腐败。两组的挥发性风味物质差异主要表现为:二甲基二硫、二甲基三硫、异辛醇、癸酸乙酯、辛酸乙酯、苯乙醇、丁酸乙烯酯和3-甲基-4-庚酮这8 种物质在对照组中含量较高;丙酸丁酯、辛酸、2,2-二甲基-4-戊烯醛、2,2-二甲基己酮、正己醇和2,4-二甲基苯甲醛这6 种物质在DBD低温等离子体杀菌组中含量较高。其中丙酸丁酯、二甲基二硫、异辛醇、癸酸乙酯、二甲基三硫和辛酸乙酯的VIP值大于1(图6D),对两组样本分组贡献较大。
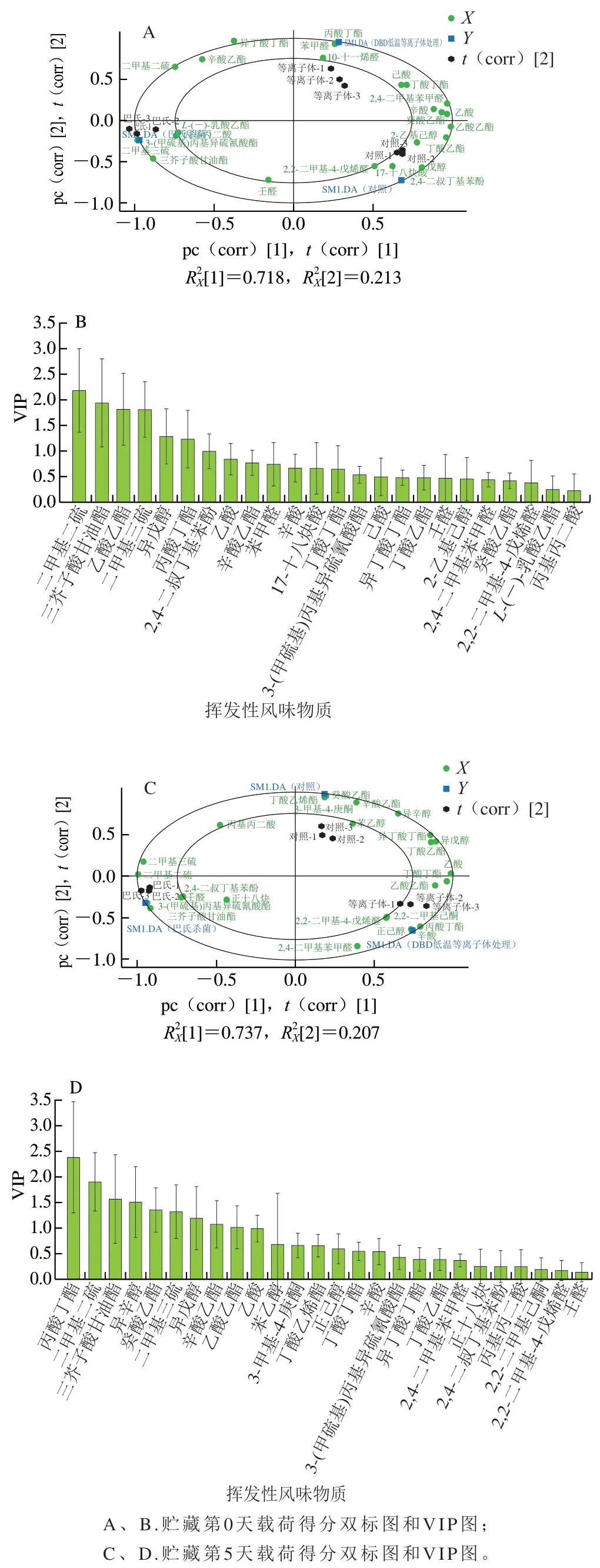
图6 不同处理组低盐泡菜贮藏期间挥发性风味物质PLS-DAFig. 6 PLS-DA analysis of volatile flavor compounds of low-salt paocai in different treatment groups during storage
为进一步探究第5天对照组和DBD低温等离子体组低盐泡菜风味差异与微生物的相关性,对贮藏期间上述14 种差异性挥发性风味物质与微生物指标进行Pearson相关性分析。由图7可知,对照组中含量较高的二甲基二硫、二甲基三硫、异辛醇、癸酸乙酯、苯乙醇和丁酸乙烯酯与产膜酵母数呈较显著正相关(P<0.01、P<0.001),而DBD低温等离子体杀菌组中含量较高的6 种差异性挥发性风味物质与产膜酵母无明显相关性。Ao Xiaolin等[32]将腐败泡菜中分离的产膜真菌回接泡菜,发现二甲基二硫和二甲基三硫大量产生并导致泡菜出现刺激性气味;张文娟等[33]发现相较于乳酸菌发酵,酿酒酵母接种的萝卜泡菜中癸酸乙酯和辛酸乙酯含量明显同步升高;此外,研究显示假丝酵母、毕赤酵母均可通过苯丙氨酸代谢产生苯乙醇[34-35]。综上所述,第5天对照组中含量较高的差异性挥发性风味物质可能与低盐泡菜中产膜酵母大量繁殖代谢有关,其中二甲基二硫和二甲基三硫含量的上升引发了泡菜的异味,DBD低温等离子体处理抑制了产膜酵母生长,从而与对照组风味物质存在较大差异,避免了含硫类物质含量明显增加导致的异味。
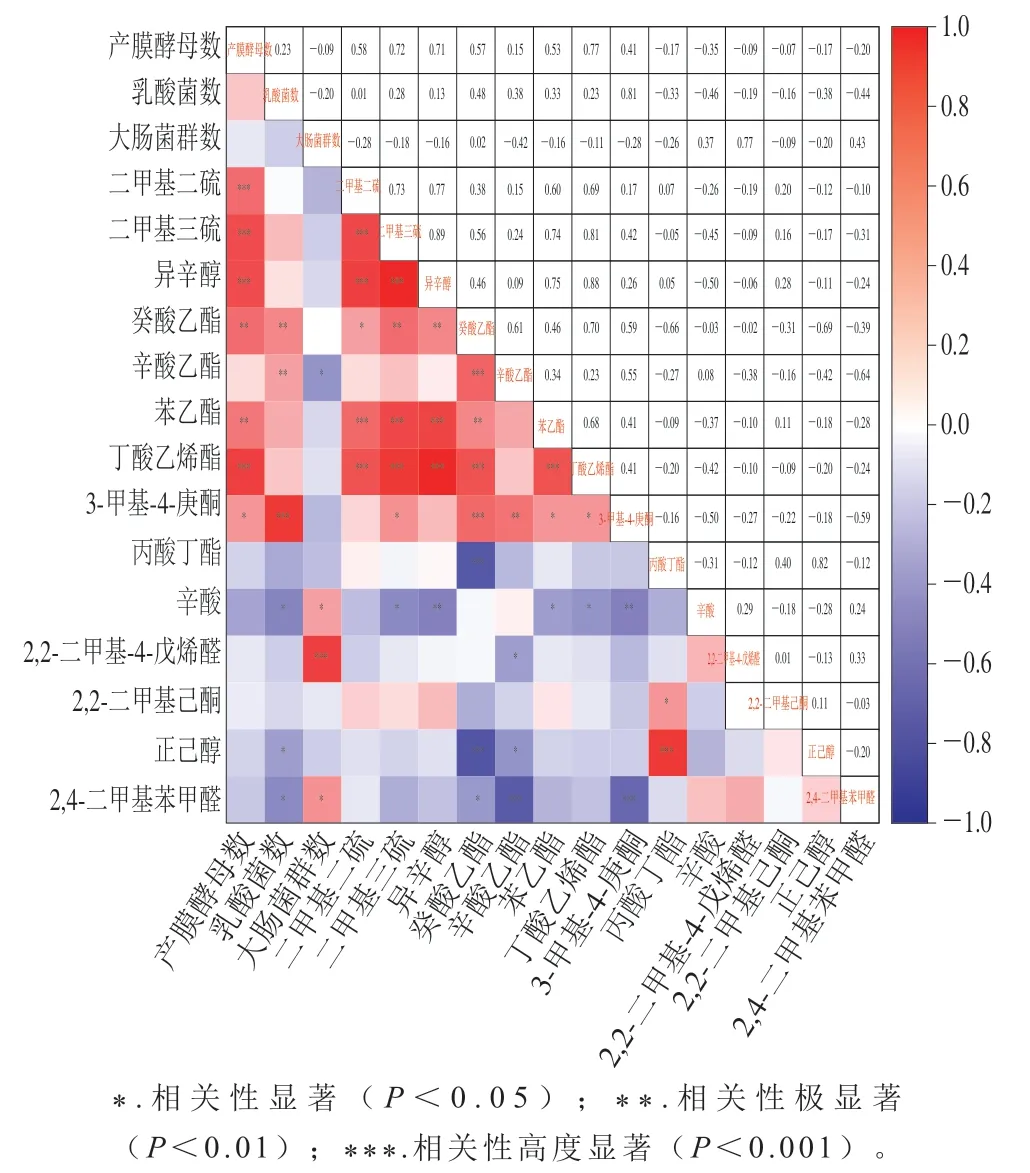
图7 贮藏第5天泡菜中主要差异挥发性风味物质与微生物的相关性热图Fig. 7 Heatmap showing the correlation between major differential volatile flavor compounds and microbial counts
3 结 论
本实验从微生物、理化指标、色差、质构及挥发性风味物质方面探究了DBD低温等离子体对低盐泡菜的冷杀菌、生花腐败抑制效果及贮藏品质的影响,得出以下结论:1)DBD低温等离子体处理可显著降低低盐泡菜中的微生物数量(P<0.05),与对照组相比,在贮藏期间将菌落总数对数值降低1.54~3.55(lg(CFU/g)),酵母菌数对数值降低2.12~4.21(lg(CFU/g)),抑制产膜酵母生长并使大肠菌群全部灭活,同时保留一定数量的乳酸菌,保证了产品的益生特性;2)DBD低温等离子体处理可有效控制贮藏期间pH值上升及产品的生花腐败,pH值从4.17逐渐降低至3.25,总酸含量从0.13 g/100 mL逐渐上升至0.65 g/100 mL,DBD低温等离子体处理后亚硝酸盐质量浓度虽有所上升,但峰值远低于GB 2762—2017限值,且在贮藏1 d后其含量迅速下降至较低水平;3)DBD低温等离子体处理对泡菜色泽影响不大,并可适度减缓发酵过程中脆度的降低,改善了巴氏杀菌造成的色泽变暗及质构软化;4)在挥发性风味物质方面,DBD低温等离子体处理后短时间内(0 d)对泡菜主体风味物质影响较小,无对风味不利的物质产生,贮藏期间能有效控制二甲基二硫和二甲基三硫等异味物质的产生。综上所述,DBD低温等离子体处理能在保证产品益生性的前提下有效控制贮藏期间发生pH值上升及生花腐败,并改善热杀菌造成的品质劣变,在低盐泡菜包装产品的品质及安全控制方面具有较好的应用前景。在未来研究中将进一步探究DBD低温等离子体对低盐泡菜贮藏过程中氨基酸、有机酸、糖组成等非挥发性物质的影响。

