不同蛋黄油组分促进小鼠消化性胃溃疡愈合作用
田 笑,仝其根
(1.北京农学院食品科学与工程学院,北京 102206;2.蛋品安全生产与加工北京市工程研究中心,北京 100094)
近年来促进消化性胃溃疡愈合作用的研究主要集中在使用中药及食物提取物或使用微生物发酵蛋白产物等,如张明昊等[1]研究发现大蒜素对乙醇致小鼠急性胃溃疡具有保护作用,其机制可能与抑制Wnt/β-catenin信号通路有关;赵澄等[2]使用龟甲胶治疗食用醋酸导致的溃疡模型小鼠,结果发现龟甲胶可通过降低胃液酸度,减少白细胞介素-1β、白细胞介素-8和胃泌素的分泌,降低溃疡指数,从而发挥对胃溃疡的治疗作用;赵欣等[3]使用牦牛酸奶分离纯化的特殊菌株发酵的豆浆品质优于标准嗜热链球菌发酵豆浆,且其对胃溃疡有很好的预防效果;还有学者使用白芨多糖[4]、山茶油[5]与姜油[6]等进行对消化性胃溃疡进行治疗。
蛋黄油是部分禽类动物的卵黄中脂溶性提取物的总称,其中的脂质是最具营养价值的一部分,脂质成分磷脂类占比32.8%(其中含有卵磷脂73.0%、脑磷脂15.0%以及其他磷脂12.0%)、脂肪酸类占比62.3%和固醇类占比(4.9%)[7]。使其既有丰富的食用价值,还有良好的抗氧化、降血脂活性[8-10],可应用于化妆品与保健品等[11-12]。
在临床上的蛋黄油主要用于促进术后烫伤创口愈合[13],婴幼儿湿疹[14],慢性皮肤溃疡[15]等。华苗爽等[16]研究表明醇提蛋黄油具有良好的促进小鼠消化性胃溃疡愈合的作用,但由于给药量太大,将其有效给药量转换为人体需要时,会使人体摄入脂质过剩,导致其他健康问题,且蛋黄油作用机制仍不明确。因此,本实验采用不同萃取剂将蛋黄油进行提取与组分分离,研究不同组分的性质与脂肪酸组成,并将其用于动物实验进行有效组分筛选,为蛋黄油作用机制探究和促进蛋黄油临床治疗人体的消化性胃溃疡开辟新思路。
1 材料与方法
1.1 动物、材料与试剂
SPF级6 周龄CD-1®(ICR)小鼠(雌雄各半、体质量(30±3)g)由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2021-0006,使用许可证号:SYXK(京)2021-0001。
蛋黄粉 亳州海川蛋制品有限公司;玉米胚芽油(以下简称玉米油) 益海嘉里金龙鱼粮油食品股份有限公司;食用淀粉、西咪替丁胶囊(0.2 g/粒) 成都锦华药业有限责任公司;小鼠饲养垫料、饲料 北京维通利华实验动物技术有限公司。
甲醛(分析纯) 天津致远化学试剂有限公司;冰乙酸(分析纯) 天津光复科技有限发展公司;无菌双蒸水 北京雷根生物技术有限公司;羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na) 上海阿拉丁生化科技股份有限公司;小鼠内皮素(endothelin 1,ET-1)、小鼠谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、小鼠超氧化物歧化酶(superoxide dismutase,SOD)酶联免疫吸附试验试剂盒 上海博湖生物科技有限公司;一氧化氮(nitric oxide,NO)、丙二醛(malondialdehyde,MDA)试剂盒 南京建成生物工程研究所;Bradford蛋白浓度测定试剂盒 福州飞净生物科技有限公司。
1.2 仪器与设备
RE-52AA旋转蒸发器 上海亚荣生物仪器厂;真空恒温烘箱 上海博迅实业有限公司;循环水真空泵上海恒科亿丰有限公司;ME204E分析电子天平 南京贝登医疗股份有限公司;SH-3C恒温磁力搅拌器 天津泰斯特仪器有限公司;YC-200超低温冰箱(-86 ℃)青岛澳柯玛集团;TH-Mini手持均质仪 北京兰杰柯科技有限公司。
1.3 方法
1.3.1 3 种蛋黄油及磷脂的制备
取一定量蛋黄粉以料液比1∶5(m/V)加入无水乙醇,55 ℃磁力搅拌1.5 h后进行抽滤,收集滤渣备用,所得滤液在60 ℃减压旋蒸至无溶剂,50 ℃真空干燥后得醇提蛋黄油。取上述无水乙醇提取后所得滤渣60 ℃真空干燥后再以料液比1∶5(m/V)加入石油醚,常温磁力搅拌1 h后低温抽滤。滤液60 ℃旋蒸得到石油醚提取的蛋黄油,真空干燥后-18 ℃贮藏备用。取醇提蛋黄油以料液比1∶10(m/V)加入丙酮,搅拌10 min至磷脂析出,抽滤后得到磷脂,真空干燥后-18 ℃贮藏备用,所得滤液65 ℃旋蒸至无溶剂,40 ℃真空干燥后得到去磷脂醇提蛋黄油备用。
取去磷脂醇提蛋黄油以料液比1∶10(m/V)加入乙醇-乙腈溶液(体积比1∶1),混匀后倒入分液漏斗静置分层,分别收集上层油与下层油,65 ℃旋蒸至无溶剂,然后真空干燥后-18 ℃贮藏备用。将上层油、下层油和石油醚油分别命名为蛋黄油1、蛋黄油2及蛋黄油3。
由蛋黄油提取蛋黄油1、蛋黄油2及蛋黄油3和磷脂4 个脂质成分。其中磷脂组分大多由卵磷脂构成,为固体;上层油下层油和石油醚油为液态油,性质和脂肪酸组成未知。依据GB/T 5532—2008《动植物油脂 碘值的测定》和GB/T 5534—2008《动植物油脂 皂化值的测定》测定3 种液态脂质的碘值、皂化值,参考GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》第一法,采用气相色谱法测定3 种液态脂质脂肪酸组成。
1.3.2 动物造模、分组以及给药设计
小鼠饲养环境温度(22±2)℃、相对湿度(55±5)%,昼夜12 h交替。90 只小鼠(造模实验致死率10%,因此增加造模小鼠的数量以备用,后同)自由饮水进食,适应性饲养7 d后随机选取9 只作为空白对照组,其他81 只小鼠参考文献[16]进行造模。造模共进行5 d,前3 d每只小鼠灌胃0.2 mL/d 7.5%(质量分数,后同)乙酸溶液,后2 d每只小鼠灌胃0.2 mL/d 6%乙酸溶液,建立消化性胃溃疡模型。每次灌胃前断食12~15 h,灌胃后0.5 h给食。造模期间空白对照组小鼠灌胃等体积蒸馏水。造模后的消化性胃溃疡小鼠随机分为8 组,每组9 只:模型组造模结束次日处死;模型对照组灌胃0.4 mL/d蒸馏水观察小鼠自行愈合情况;阳性药物组灌胃0.4 mL/d 0.75%(质量分数)西咪替丁浊液(用0.2%(质量分数)CMC-Na溶液溶解);蛋黄油1、蛋黄油2及蛋黄油3组分别灌胃0.4 mL/d蛋黄油1、蛋黄油2及蛋黄油3浊液(分别在3 种蛋黄油中加入1/3体积蒸馏水,充分混合乳化制成浊液),即摄入0.3 g/d蛋黄油;磷脂组灌胃0.4 mL/d磷脂-玉米油浊液(将1.3.1节磷脂与玉米油等体积混合均匀后加入与混合物等体积的蒸馏水,充分混合乳化制成浊液),即摄入0.1 g/d磷脂;玉米油组灌胃0.4 mL/d玉米油浊液(在玉米油中加入1/3体积蒸馏水,充分混合乳化制成浊液),即摄入0.3 g/d玉米油。空白对照组小鼠灌胃0.4 mL/d蒸馏水。各组干预5 d后于次日脱颈处死(处死前断食不断水12 h),取胃体观察胃窦溃疡情况并进行组织病理学及胃组织生化指标分析。
1.3.3 胃窦观察及胃溃疡评分
取各组小鼠胃体,用生理盐水冲洗后沿胃大弯剪开胃壁,冲洗胃中残余食物,观察胃窦溃疡情况并拍照,并根据胃溃疡评分标准[17](表1)进行溃疡评分,结果取平均值。

表1 胃溃疡评分标准[17]Table 1 Scoring criteria for gastric ulcer[17]
1.3.4 组织病理学分析
每组随机剪取溃疡部分胃组织((1.0±0.5)cm×(1.0±0.5)cm)于10%(体积分数)中性甲醛溶液固定24 h以上后进行石蜡切片,苏木精-伊红染色后在显微镜下观察胃组织中细胞结构及炎性细胞的病变情况。
1.3.5 胃组织生化指标测定
各组小鼠胃组织称质量后剪碎并加入生理盐水,冰浴下均质制成质量分数10%组织匀浆,4 ℃、3 000 r/min离心10 min后收集上清液,置于-86 ℃冰箱中备用。分别参考SOD、MDA、NO、ET-1、GSH-Px试剂盒说明书测定相应指标。
1.3.6 剂量验证实验
取1.3.1节制备的蛋黄油1和磷脂进行小鼠消化性胃溃疡剂量验证实验。取60 只小鼠参考1.3.2节方法进行造模和干预,造模结束后将小鼠分为6 组(每组9 只):模型组、模型对照组和高剂量(0.3 g/d)、低剂量(0.15 g/d)蛋黄油1组以及高剂量(0.1 g/d)、低剂量(0.05 g/d)磷脂组,模型组造模次日处死,其余组干预5 d后于次日处死。参考1.3.5节方法进行胃组织生化指标测定。
1.4 数据处理与分析
实验结果以平均值±标准差表示,采用SPSS软件进行数据处理与单因素方差分析,采用Duncan multiplerange test法检验进行显著性分析,P<0.05为差异显著。采用Origin软件作图。
2 结果与分析
2.1 不同蛋黄油组分干预后小鼠胃窦溃疡情况
胃窦观察可以直观反映溃疡情况及胃黏膜受损程度,胃窦溃疡评分可以对比溃疡损伤的差异性。正常小鼠胃窦剪开后在日光灯下呈淡粉色(图1A);模型组胃体在灯光下为深红色,出现异常褶皱,伴有胃黏膜溃烂、出血,溃疡清晰可见(图1B);模型对照组相较模型组,溃疡有一定好转,但仍伴有非正常褶皱与对称溃疡血痕(图1C);蛋黄油1组褶皱均匀、颜色稍红,相较于模型对照组有明显愈合作用(图1D);蛋黄油2组仍有明显对称性出血溃烂,伴有点状溃疡,非溃疡面颜色趋正常(图1E);蛋黄油3组颜色偏深,有少量点状溃疡以及褶皱,促进愈合效果与蛋黄油1组接近(图1F);阳性药物组胃体组织完整、颜色正常,无溃疡以及血斑(图1G);磷脂组颜色较正常、无褶皱,有少量点状溃疡,愈合作用相较其他脂质组(蛋黄油1、蛋黄油2、蛋黄油3与磷脂组,下同)较好(图1H);玉米油组有大量血痕以及点状溃疡,颜色较深,促进愈合效果较差(图1I)。
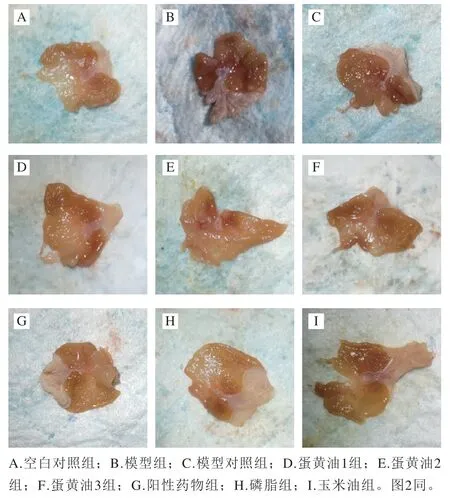
图1 各组小鼠胃体解剖观察图Fig. 1 Photographs of gastric tissue of mice in each group
各组小鼠胃体溃疡评分如表2所示,对比模型对照组,阳性药物、蛋黄油1、蛋黄油3及磷脂组的溃疡评分均显著下降(P<0.05),且在脂质组中磷脂组的评分下降的趋势最大,其效果接近阳性药物。与模型对照组相比,玉米油组溃疡评分变化不显著(P>0.05),由此可知磷脂-玉米油浊液中具有促进溃疡愈合效果的成分为磷脂。

表2 各组小鼠溃疡评分Table 2 Ulcer scores of mice in each group
以上结果表明:1)给药组(脂质组、阳性药物组和玉米油组,下同)均有一定促进消化性胃溃疡愈合作用,磷脂、蛋黄油3与蛋黄油1效果显著,溃疡评分较低,高溃疡评分占比较少;2)脂质组中磷脂对损伤的治愈效果强于其他蛋黄油组分,其次是蛋黄油1与蛋黄油3,蛋黄油2效果较差;3)使用磷脂-玉米油浊液灌胃的溃疡愈合效果明显强于单一使用玉米油,说明磷脂是促进溃疡愈合的有效成分。
2.2 组织病理学分析结果
白细胞渗出——炎性浸润是炎症反应最重要的指征,游走出血管壁进入组织间隙的白细胞即为炎细胞,炎细胞聚集即为炎性浸润。而通过对样品的病理学分析(将样品经过石蜡包埋染色等操作后在显微镜下观察)可以观察到炎细胞浸润[18]聚集现象,胃溃疡小鼠胃组织还可能出现明显的出血性损伤、水肿、上皮细胞丢失与腺体脱落等现象[2],上述现象也可以通过小鼠病理学分析进行观察。
图2A为正常胃组织,细胞排列均匀,肌肉层结构清晰,组织完整,无炎性细胞浸润。模型组胃窦黏膜腺体受损严重,出现成片脱落现象,且炎性细胞大量聚集(图2B)。给药组均有一定促进溃疡愈合作用。其中蛋黄油2、蛋黄油3与玉米油组效果较差,均有炎症浸润、腺体脱落等异常组织结构(图2E、F、I)。而蛋黄油1、磷脂和阳性药物组对于腺体完整性的保持效果明显强于其他组别,炎性浸润现象较少(图2D、G、H)。与玉米油组相比,磷脂具有促进溃疡愈合效果。
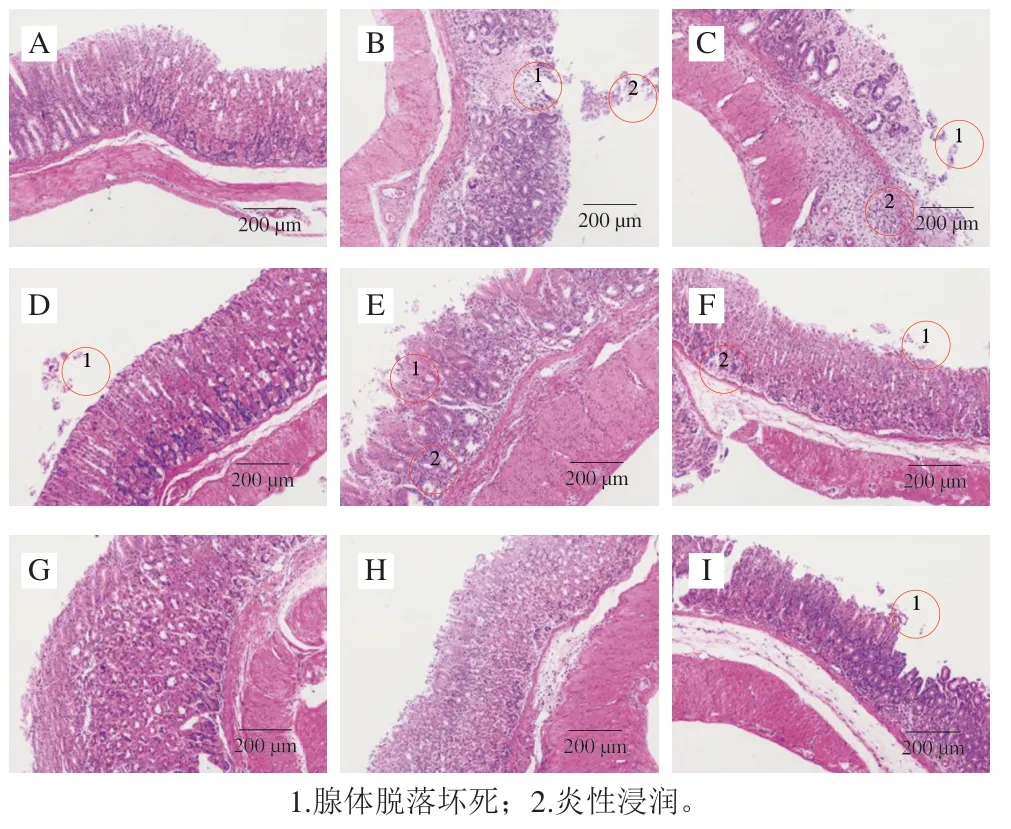
图2 各组小鼠胃组织病理形态(×100)Fig. 2 Pathological morphology of stomach tissues in mice from each group (× 100)
以上结果表明:1)蛋黄油1、磷脂促进消化性溃疡愈合能力较好,进一步印证胃窦溃疡观察结果;2)蛋黄油3组胃窦溃疡观察愈合效果显著,但组织病理学观察结果表明愈合效果不佳;3)磷脂组溃疡愈合效果明显强于玉米油组,进一步印证磷脂成分对溃疡的愈合效果。
2.3 不同蛋黄油组分干预对小鼠胃组织生化指标的影响
2.3.1 胃组织SOD活力、MDA含量及GSH-Px含量
胃组织在外因素刺激下会产生大量的氧自由基,引发体内的氧化应激反应与脂质的过氧化反应[19]。氧自由基可通过攻击生物膜中多不饱和脂肪酸形成一系列脂质过氧化物及其降解产物MDA等,导致组织损伤,引起和加剧炎症反应[20]。因此,组织内的MDA含量可以间接反映细胞损伤程度,判断溃疡情况。SOD与GSH-Px是生物体内氧自由基清除系统的重要防线[20]。两者主要作用虽然有差异,但都可以反映炎症的严重程度,酶活力越低,局部组织损伤越明显,机体清除自由基能力弱,炎症则趋于严重[21]。
如图3所示,与模型对照组相比,脂质组(除蛋黄油2组及蛋黄油3组外)胃组织SOD活力均极显著提高(P<0.01),其中磷脂和蛋黄油1对胃组织SOD活力的提升作用优于阳性药物。磷脂组相较玉米油组SOD活力明显提高,说明磷脂干预具有提高SOD活力的作用。
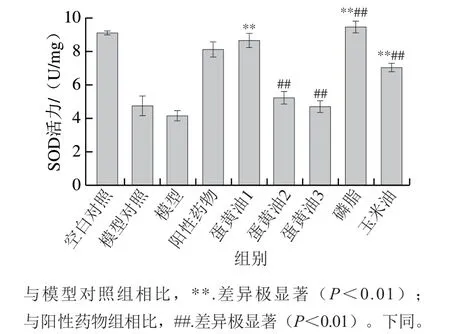
图3 各组小鼠胃组织SOD活力Fig. 3 SOD activity in gastric tissues of mice in each group
如图4所示,与模型对照组相比,除蛋黄油3组外,各脂质组MDA含量均显著或极显著下降(P<0.05、P<0.01),其中蛋黄油1组MDA含量降低效果更接近阳性药物,其次是磷脂组。玉米油组相对模型对照组无显著差异(P>0.05),说明磷脂组中有效干预成分为磷脂。
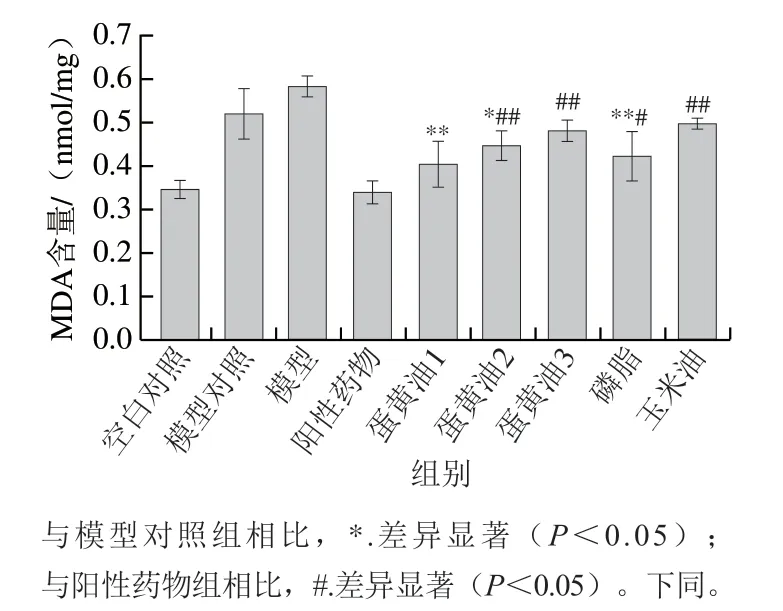
图4 各组小鼠胃组织MDA含量Fig. 4 MDA concentration in gastric tissues of mice in each group
如图5所示,与模型对照组相比,除蛋黄油2组和玉米油组外,给药组胃组织GSH-Px含量均显著或极显著提高(P<0.05、P<0.01),其中蛋黄油3组和磷脂组GSH-Px含量接近或高于阳性药物组。与模型对照组相比,磷脂组GSH-Px含量极显著提高(P<0.01),但玉米油组未明显改变,说明磷脂具有提高消化性胃溃疡小鼠胃组织内GSH-Px含量的作用。
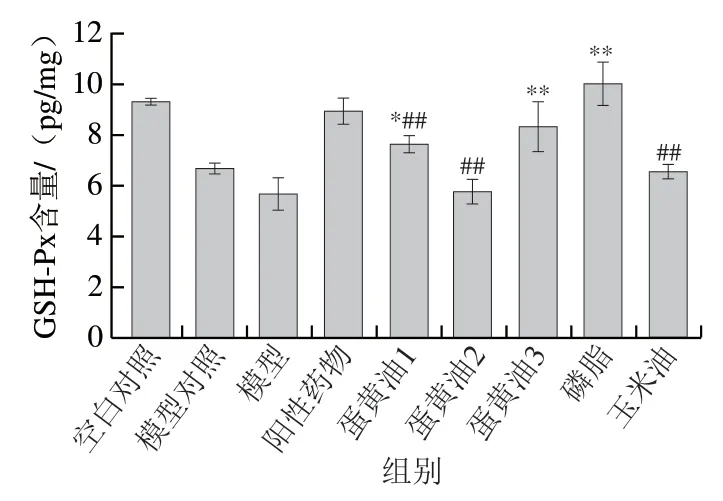
图5 各组小鼠胃组织GSH-Px含量Fig. 5 GSH-Px concentration in gastric tissues of mice in each group
如图3~5所示,与模型组相比,模型对照组SOD活力、MDA含量以及GSH-Px含量变化不明显;与模型对照组相比,阳性药物组SOD活力、MDA含量以及GSH-Px含量变化明显,证明药物作用可靠有效。通过上述对小鼠胃组织SOD活力、MDA含量以及GSH-Px含量的综合分析结果可以看出:1)蛋黄油1和磷脂对于胃组织应激反应有较好的抑制作用,并能够较好地清除刺激产生的自由基,两种脂质都能显著提升消化性胃溃疡小鼠胃组织SOD活力与GSH-Px含量,同时抑制MDA的产生,有效起到促进消化性胃溃疡愈合的作用,且效果接近阳性药物;2)对比上述磷脂组与玉米油组,磷脂组胃组织各生化指标均有显著变化,而玉米油组对于调整溃疡胃组织上述指标能力较差,因此推断磷脂组干预物质中的有效成分为磷脂。
2.3.2 胃组织NO与ET-1含量
内源NO对血管有舒张作用,可以通过扩张血管以增加胃黏膜血流量,降低血管通透性,抑制血小板聚集,从而起到保持胃黏膜上皮完整性促进胃黏膜损伤愈合作用[22]。ET-1是一种具收缩血管活性的物质,其能促进氧化自由基、血小板激活因子等损伤因子增加,加重胃黏膜损伤[23]。NO与ET-1两者共同构成胃黏膜血流动力学平衡,ET-1可以增加内皮细胞NO产生,该反应负反馈调节ET-1的血管收缩,抑制NO产生[24]。因此,NO与ET-1含量是表征胃黏膜损伤的重要指标。
如图6、7所示,模型对照组与模型组NO及ET-1含量变化不显著(P>0.05),说明5 d内小鼠不能将此指标自行调节至正常水平。阳性药物组的NO和ET-1含量较模型组发生明显改变,证明阳性药物有效。相较模型对照组,脂质组中的NO含量除蛋黄油1组外变化均不显著,说明只有蛋黄油1可以显著升高胃组织NO。相对阳性药物组,脂质组都不能达到药物升高组织NO含量的作用。

图6 各组小鼠胃组织NO含量Fig. 6 NO concentration in gastric tissues of mice in each group
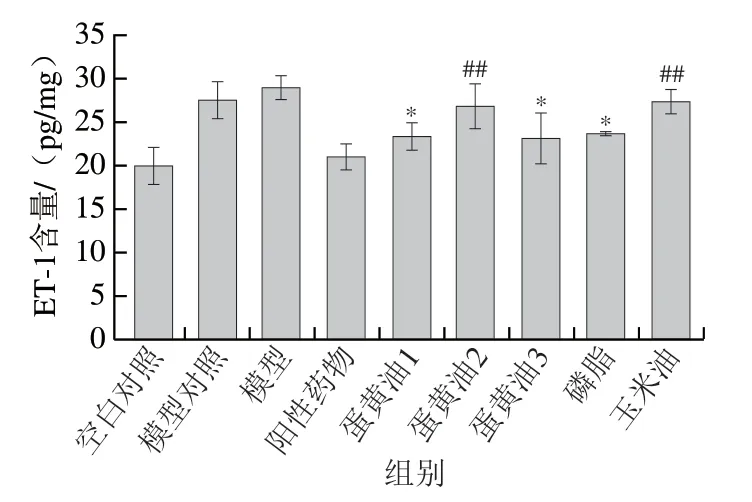
图7 各组小鼠胃组织ET-1含量Fig. 7 ET-1 concentration in gastric tissues of mice in each group
如图7所示,对比模型对照组,蛋黄油1、蛋黄油3和磷脂组胃组织ET-1含量均变化显著(P<0.05),说明三者能有效降低组织内ET-1含量,且三者相较阳性药物组ET-1含量差异不显著(P>0.05),说明其降低消化性胃溃疡小鼠胃组织ET-1含量的能力较强。
以上结果表明:1)在消化性胃溃疡小鼠的胃组织中,蛋黄油1可以通过降低ET-1含量、升高NO含量进行血管扩缩调节,促进小鼠胃溃疡损伤愈合;2)蛋黄油3与磷脂能够显著降低溃疡胃组织内ET-1含量,但其降低组织NO含量能力不明显;3)磷脂组降低消化性胃溃疡小鼠胃组织ET-1含量和升高NO含量效果明显强于玉米油,说明磷脂组中磷脂起到降低消化性胃溃疡小鼠胃组织ET-1含量和提高NO含量的作用。
以上实验结果表明:各组干预后胃窦溃疡的愈合效果为磷脂>蛋黄油3≥蛋黄油1>蛋黄油2;各组干预后的组织病理形态愈合效果为磷脂>蛋黄油1≥蛋黄油3>蛋黄油2;各组干预后的胃组织SOD活力促进效果为磷脂≥蛋黄油1>蛋黄油2≥蛋黄油3;各组干预后的胃组织MDA含量降低效果为蛋黄油1≥磷脂>蛋黄油2>蛋黄油3;各组干预后的胃组织GSH-Px含量提升效果为磷脂>蛋黄油3≥蛋黄油1>蛋黄油2;各组干预后的胃组织NO含量提升效果为蛋黄油1>磷脂≥蛋黄油2≥蛋黄油3;各组干预后的胃组织ET-1含量降低效果为蛋黄油3≥蛋黄油1≥磷脂>蛋黄油2。
综合考虑,本实验所制备4 种蛋黄油组分中蛋黄油1和磷脂对小鼠消化性胃溃疡的促进愈合效果最好,胃窦观察结果表明两组分干预后可明显促进小鼠胃溃疡愈合,组织病理学分析结果表明两组分抑制炎性因子的浸润;此外,两组分还能通过提高组织内SOD活力、GSHPx含量和降低MDA含量来清除胃内由乙酸刺激产生的自由基,保护胃黏膜,且通过调节内部ET-1和NO含量舒张血管,抑制损伤因子水平增加,起到保护胃黏膜、促进小鼠消化性胃溃疡愈合的作用。分离出的其他脂质虽也有一定效果,但综合效果不如蛋黄油1和磷脂明显。综上,选择蛋黄油1和磷脂进行验证性实验。
2.4 验证性实验结果
为了验证蛋黄油1和磷脂的有效性,采用高剂量(0.3 g/d)、低剂量(0.15 g/d)蛋黄油1及高剂量(0.1 g/d)、低剂量(0.05 g/d)磷脂干预消化性胃溃疡小鼠。干预结束后,各组小鼠胃组织氧化应激水平和炎症水平分别如表3、4所示:1)对比模型对照组,蛋黄油1和磷脂的高剂量组氧化应激水平和炎症水平变化趋势与2.3.1节结果一致;2)与高剂量磷脂干预相比,低剂量磷脂干预清除自由基与抑制过氧化反应的能力较差,调节ET-1和NO含量能力也变弱;3)与模型对照组相比,0.15 g/d蛋黄油1干预5 d后,胃组织SOD活力、MDA含量与NO含量变化仍显著,GSH-Px含量甚至高于高剂量蛋黄油1组,低剂量蛋黄油1干预后ET-1含量变化不显著(P>0.05),但对比模型对照组仍然有效果一定效果,说明0.15 g/d蛋黄油1干预也有良好的促进小鼠消化性胃溃疡愈合作用。
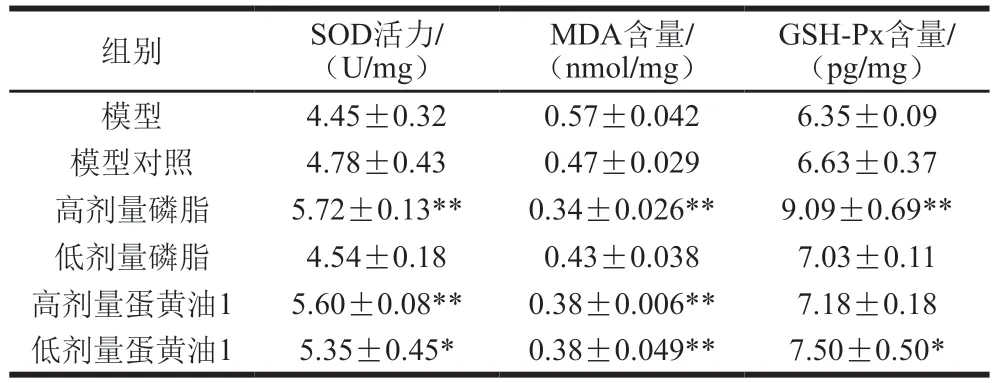
表3 验证实验各组小鼠胃组织氧化应激水平Table 3 Levels of oxidative stress in gastric tissues of mice from each group in validation experiments

表4 验证实验各组小鼠胃组织炎症水平Table 4 Levels of NO and ET-1 in stomach tissues of mice from each group in validation experiments
2.5 蛋黄油中液态脂质组成及不同蛋黄油组分促进小鼠消化性胃溃疡愈合效果
碘值能够反映油脂中脂肪酸的不饱和程度,是评价其不饱和度的重要指标[25]。皂化值是样品平均分子质量的量度[26],油脂皂化值反映其相对分子质量,皂化值越大,油脂相对分子质量越小[27]。如表5所示,3 种蛋黄油液态脂质的碘值由高到低依次为蛋黄油1、蛋黄油2、蛋黄油3,皂化值由高到低依次为蛋黄油3、蛋黄油2、蛋黄油1。综合以上实验结果,3 种液态脂质中蛋黄油1促进愈合效果最显著。蛋黄油1是由蛋黄粉乙醇提取后脱去磷脂再溶解乙腈-乙醇等比例混合液的油脂,其碘值在实验所用油脂中最高,且高于一般动物性油脂,因此其不饱和程度较高;蛋黄油1皂化值在实验样品中最低,脂质相对分子质量较大,推测可能与其不饱和脂肪酸相对含量高有关。蛋黄油1中多不饱和脂肪酸相对含量21.3%,n-3不饱和脂肪酸和花生四烯酸分别占总脂肪酸的1.3%和2.0%,均远高于其他两种液态脂质,这两者都与炎症愈合、抑制过氧化反应有密切联系[28-29]。因此,蛋黄油1中丰富的多不饱和脂肪酸可能是其在各实验组中促进小鼠胃溃疡愈合效果最佳的主要原因。
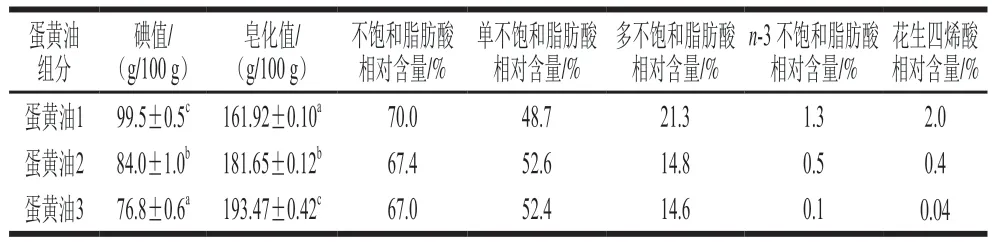
表5 蛋黄油中液态脂质组分性质Table 5 Properties of egg yolk oil components
蛋黄磷脂中最主要的成分就是卵磷脂,其占蛋黄固体总含量的22%与蛋黄脂类的50%[30-31]。卵磷脂功能性已有诸多研究,卵磷脂可以起到清除自由基的作用,改善破坏的生物膜系统[32]。此外卵磷脂还可以抑制氧化应激与脂质氧化,减轻炎症反应和星状细胞活化[33]。以上研究与本实验中磷脂促进消化性胃溃疡的愈合作用相印证。
3 结 论
蛋黄油1和磷脂均可以通过抑制脂质过氧化、清除自由基和调节血管扩缩等促进小鼠消化性胃溃疡愈合。华苗爽等[16]采用蛋黄油干预胃溃疡模型小鼠,其有效剂量为0.3 g/d;而本实验选取蛋黄油组分黄油1和磷脂分别进行干预,有效剂量分别为0.15 g/d与0.1 g/d。蛋黄油1与磷脂中何种物质具有保护细胞结构与抑制脂质过氧化的作用,其中具体机制以及临床应用剂量等还需要进一步研究。

