超声造影评估慢性肾病1-3期病人临床及病理改变的应用价值研究
张梦瑞 张妍 王芹 赵静雯 张竞亓 张杰
慢性肾病(chronic kidney disease,CKD)已成为全球性的公共健康问题,我国成人CKD的发病率高达10.8%[1]。CKD的发生、发展与肾脏血流灌注减低密切相关,但目前尚缺乏安全、有效的影像学检查手段对其进行评估。超声造影(contrast-enhanced ultrasound,CEUS)可以动态观察靶器官的微循环灌注情况,并能对血流信息进行定量评价。既往研究对CKD早期病人的肾皮质血流状况进行CEUS定量分析,显示CEUS参数有助于区分对照组与CKD早期病人[2-3],但使用CEUS参数评估CKD病理改变并从临床和病理两方面对CKD综合评估的研究仍然较少。本研究通过对CKD不同分期病人CEUS参数的比较分析,旨在探讨CEUS评估CKD临床及病理改变的应用价值。
1 资料与方法
1.1 一般资料 前瞻性选取2020年8月—2022年1月天津医科大学总医院肾内科住院的CKD 1-3期病人60例,男31例,女29例,年龄18~78岁,平均(40.3±14.3)岁。均经肾脏穿刺活检明确病理结果且拟行穿刺侧肾脏CEUS检查。纳入标准:①体质量指数(BMI)为18.5~28.0 kg/m2;②病人实验室检验指标包括血清肌酐(serum creatinine,SCr)、血尿素氮(blood urea nitrogen,BUN);③无对比剂过敏、严重的心肺疾病、妊娠或哺乳期等CEUS检查禁忌证。排除标准:①呼吸配合不佳者;②影像质量较差者。本研究经医院伦理委员会批准(IRB2021-YX-159-01),CEUS检查前所有病人均知情同意。
1.2 病人分期 使用2009年发布的基于SCr的CKD流行病学合作(CKD-EPI)公式估算肾小球滤过率(estimated glomerular filtration rate,eGFR)[4],并根据美国国家肾脏基金会-肾脏病预后质量倡议(NKF-K/DOQI)中的CKD分期标准[5]对病人进行分期,其中1期39例、2期13例、3期8例。
1.3 设备与方法 采用GE LOGIQ E8彩色超声诊断仪,探头型号C 1-6。常规超声检查选取朝向肾门的最大纵切面为观察切面,测量穿刺侧肾脏长径及肾皮质厚度(肾锥体前缘与肾被膜之间的距离)。CEUS检查在穿刺侧肾脏完成,将机械指数调至0.12,增益值设置为30~33。嘱病人平稳缓慢呼吸,开启造影模式,经肘静脉团注法手动推注2 mL对比剂(声诺维:SonoVue,瑞士Bracco Suisse SA,国药准字号J20180005;配比:59 mg/5 mL盐水),之后立即推注5 mL生理盐水冲管,记录动态图像。
1.4 CEUS参数分析 采用SonoLiverR定量分析软件(德国Tomtec公司和意大利Bracco公司合作开发)对CEUS动态资料进行后处理。在CEUS影像上选取兴趣区(ROI)(图1):①边界ROI,界定分析ROI与参考ROI的选取范围;②分析ROI,选取在与探头垂直的肾皮质区域;③参考ROI,选取在肾包膜上方无灌注区域。必要时使用运动补偿以减少呼吸对ROI位置的影响。采用机器内置函数获得分析ROI的时间-强度曲线(time-intensity curve,TIC)并测量相关定量参数,包括上升时间(rise time,RT)、达峰时间(TTP)、峰值强度(maximum intensity,Imax)、平均通过时间(MTT)、曲线下面积(AUC)、曲线上升支斜率(A)、曲线下降支斜率(α)。每个参数均测量3次取平均值,拟合质量(quality of fit,QOF)需≥75%。
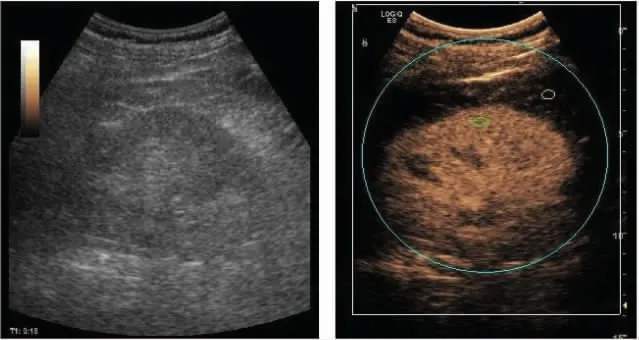
图1 ROI的选取。图中蓝色、绿色和黄色曲线内区域分别为边界ROI、分析ROI和参考ROI。
1.5 病理学评分 组织学标本由2名病理科医师根据肾小球硬化、肾小管萎缩/间质纤维化程度进行评分,意见不一时协商确定。①肾小球硬化(病变占总小球的比例)评分:0分,未见明显硬化;1分,<25%;2分,25%~50%;3分,>50%。②肾小管萎缩/间质纤维化(病变占总小管/间质的比例)评分:0分,未见明显萎缩与纤维化;1分,<25%;2分,25%~50%;3分,>50%。
1.6统计学方法 采用SPSS 20.00软件进行数据分析。符合正态分布的计量资料以(±s)表示,3组间比较采用单因素方差分析;非正态分布的计量资料以中位数[M(P25,P75)]表示,3组间比较采用Kruskal-Wallis H检验;进一步两两比较均采用Bonferroni校正。计数资料以例(%)表示。CEUS参数与实验室指标、病理评分的相关性分析采用Pearson或Spearman秩相关分析。P<0.05为差异具有统计学意义。
2 结果
2.1 3 期CKD病人实验室指标及超声测量结果比较1-3期CKD病人的实验室指标差异均有统计学意义(P<0.05)。随着CKD分期增高,SCr、BUN均逐渐增高,eGFR逐渐减低(均P<0.05)。1-3期CKD病人的CEUS测量结果中Imax和A值的差异均有统计学意义(均P<0.05),2、3期病人的Imax值均低于CKD 1期(P<0.05),3期病人的A值低于1期病人(P<0.05)。1-3期病人的其他超声测量结果间差异均无统计学意义(均P>0.05),详见表1。

表1 不同分期CKD病人的实验室指标及超声测量结果比较
2.2 CKD病人Imax、A值与实验室指标的相关性分析Imax值与SCr、BUN呈负相关(分别r=-0.350,P=0.006;r=-0.476,P<0.001),与eGFR呈正相关(r=0.485,P<0.001);A值与eGFR呈正相关(r=0.278,P=0.031)。见图2。
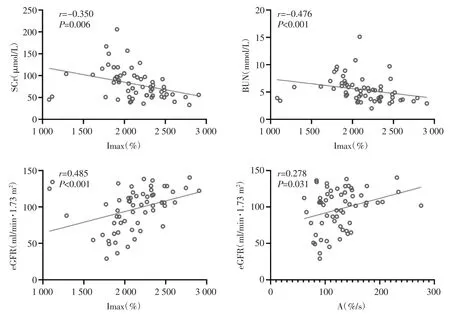
图2 Imax、A值与实验室指标的相关性分析散点图
2.3 CKD病人Imax、A值与病理评分的相关性分析CEUS参数中,Imax值与肾小球硬化评分呈负相关(r=-0.493,P<0.001),见表2。Imax、A值与肾小管萎缩/间质纤维化评分呈负相关(分别r=-0.398,P=0.002;r=-0.283,P=0.029),见表3。
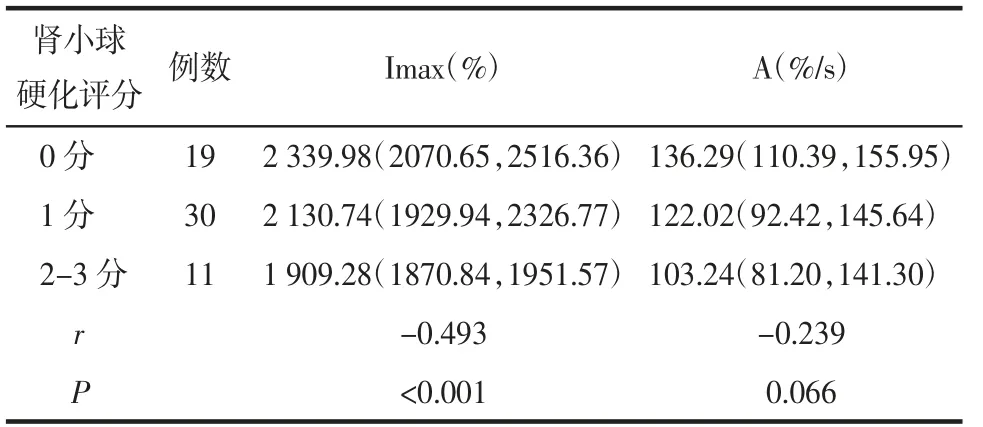
表2 肾小球硬化评分与Imax、A值的相关性
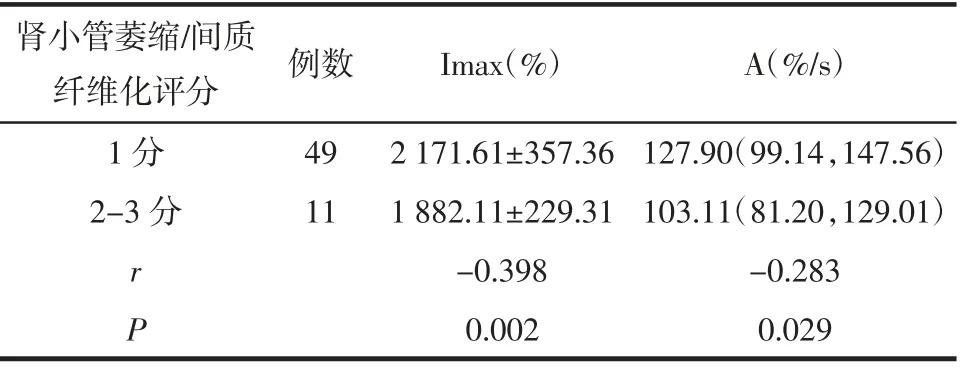
表3 肾小管萎缩/间质纤维化评分与Imax、A值的相关性
3 讨论
CKD指各种原因导致的肾脏损伤或肾功能下降,随着病情的进展,部分病人甚至发展为终末期肾病。因此,对CKD进行有效监测、合理干预有助于减缓疾病进程,降低终末期肾病的发生率。目前,临床常用的无创评价肾病进展的方法中,实验室指标存在一定的滞后性[6-7],核医学检查有放射性,CT、MRI对比剂有肾毒性。超声具有无创、无辐射等优点,但常规超声测量的指标,如肾脏大小、皮质厚度等特异性较差。本研究中,不同分期CKD病人之间的常规超声测量结果无明显差异。
近年来,CEUS技术的进步推动超声由形态学成像向功能性成像发展[8]。在一定浓度范围内,对比剂的信号强度能真实反映组织器官内的血流灌注水平。CEUS技术能够量化血流灌注信息,显示灌注水平之间的差异,因而被广泛应用于各种肾脏疾病的评估[9]。既往研究使用CEUS评估肾脏血流灌注情况的对比剂剂量多为1~1.7 mL[2,10-11],但本研究使用的机型为GE LOGIQ E8,采用CHI技术,造影参数中机械指数为0.12,破泡率较高,为满足定量分析的需要,参考李等[12]的研究,使用了2 mL对比剂。
3.1 CEUS参数评估不同分期CKD病人的价值 肾病的发生发展与肾脏血流灌注的异常密切相关。随着病情的发展,肾小球硬化程度加重,有效肾单位的数量减少,肾皮质血流灌注进一步降低[13-16]。峰值强度Imax表示ROI内所能达到的对比剂最大强度。本研究发现CKD 2期、3期病人的Imax值低于1期,提示随着肾病的发展,肾皮质血流灌注量逐渐减低,对比剂灌注量减少。庞等[2]、Dong等[3]研究发现CKD早期病例组的Imax明显低于对照组,提示CKD早期肾皮质即发生灌注量减少,与本研究结果一致。
CKD时,炎性免疫复合物沉积于肾小球基底膜及系膜区,导致细小动脉玻璃样变,管壁增生硬化,血管阻力增加,进而肾脏血流灌注量减少。为维持血流量的稳定,肾素-血管紧张素系统被激活,从而进一步增加小动脉的血管阻力,造成恶性循环[2]。曲线上升支斜率A、曲线下降支斜率α可反映ROI内对比剂微泡浓度随时间变化的快慢情况。本研究中,CKD 3期病人的A值低于CKD 1期,这提示随着纤维化程度加重,肾内血管阻力增加,对比剂的流入受阻,进而造成流速减低,因而A值发生变化。本研究中,α值随CKD分期的升高有降低趋势,但各组间差异无统计学意义,与梁等[17]的研究结果一致。α值能否作为有意义的指标还有待今后进一步探讨。
RT和TTP指对比剂到达最大强度所需的时间,MTT指灌注起点到峰值强度下降一半所需的时间。本研究中,RT、TTP、MTT值在不同分期CKD病人之间差异无统计学意义,分析其原因可能是由于个体间微循环速度不同、CEUS检查的同步采集时间存在误差所致。TIC-AUC虽一定程度上可代表肾脏总体血容量情况,但其受峰值强度、时间、对比剂灌注速率等多因素的影响,且文献提示不同研究之间的一致性较差[2,12],CKD早晚期变化趋势也不尽相同[18]。本研究中不同分期CKD病人的AUC值差异没有统计学意义。相比之下,在对比剂注射剂量一定时,Imax值能直观反映ROI内对比剂的信号强度,或许具有更好的应用前景。
CEUS参数比较显示,Imax、A值在不同分期CKD病人之间具有差异性,故本研究进一步将Imax、A值与CKD病人实验室指标和病理评分进行了相关性分析。
3.2 Imax、A值与实验室指标的相关性 本研究结果发现Imax值与SCr、BUN呈负相关,与eGFR呈正相关,表明肾功能下降与肾皮质血流灌注减低呈同步发展。同时,A值与eGFR呈正相关,说明肾实质病变不仅导致肾功能的下降,还会改变肾内血管状态,使肾内血管阻力增加,血液流入受阻,A值降低。CKD早期病人的肾功能多数未发生明显改变,若仅依赖于临床化验指标,则可能错失最佳治疗时机,未来CEUS有可能作为CKD临床评估的辅助手段。
3.3 Imax、A值与病理评分的相关性 肾脏长期处于缺血、缺氧状态使肾组织受损,启动肾脏纤维化进程。纤维化将导致肾小管萎缩及毛细血管减少,进而引起相应的肾小球硬化。随着肾小球硬化、肾小管萎缩/间质纤维化程度的加重,毛细血管内的血容量不断下降,肾皮质灌注减低。本研究显示Imax值与肾小球硬化、肾小管萎缩/间质纤维化程度呈负相关,与Yang等[19]研究结果一致。此外,本研究中,A值与肾小管萎缩/间质纤维化呈负相关,考虑与肾小管萎缩、间质纤维化导致对比剂灌注受阻有关。与本研究结果类似,Yang等[11]的研究结果也显示,重度肾小管/间质损伤病人的A值低于对照组的。
3.4 局限性 本研究具有如下局限性:①糖尿病肾病和高血压肾病病人在多数情况下不行肾穿刺,且两者均为全身性疾病,全身血管状态可能会对肾脏的血流灌注情况产生影响,因此本研究未纳入以上肾病类型;②本研究病例数较少,且为横断面分析。未来需要扩大样本量、纵向研究进一步探索CEUS评估CKD的应用价值。
3.5 小结CEUS能够评估CKD病人肾脏血流灌注的改变,且与临床及病理改变具有一定的相关性。随着CEUS技术的发展以及对肾脏病理改变认识的深化,有望在CKD的评估及随访中发挥更重要作用。

