儿童睡眠呼吸障碍疾病的源头研究
李彦如 王慧君 韩德民
[首都医科大学附属北京同仁医院耳鼻咽喉头颈外科,耳鼻咽喉头颈科学教育部重点实验室(首都医科大学),北京 100730]
生命始于胚胎时期,为适应生理功能不断发育完善的需要,人体组织结构始终处于动态平衡的构建之中。机体功能与结构的时序性变化,以青春前期最为突出。上气道是呼吸系统的门户,构成呼吸、吞咽及发音等重要生理功能的结构基础。儿童上气道骨骼及软组织结构之间的平衡关系也存在同样的平衡变化。因此,评估和干预儿童睡眠呼吸障碍应结合儿童不同发育时期进行,并综合评价结构对呼吸、免疫防御功能发育完善的影响。
1 正常上气道发育规律的基础研究
上气道发育形态受遗传、软硬组织发育及生物力学交互作用的影响。1927年,Scammon教授[1]首次绘制了人体重要系统的生长曲线特征。胚胎时期,肌肉、骨骼等组织处于快速发育阶段,生长的幅度和速度自出生到2岁(婴幼儿期)逐渐变缓,儿童时期趋于稳定,青春期再次加速,青春期后发育速度稳步下降;而淋巴组织的生长模式不同,表现为持续生长并于学龄后期开始萎缩(图1)[2]。组织结构生长的时序性及其对功能的影响受到广泛关注。
胚胎时期,颅神经嵴细胞从背侧神经外胚层迁移到发育中的面部突起是颅面形成的关键[3-4]。致畸因素作用于该时期时易发生颌面畸形,这也是婴幼儿睡眠呼吸障碍发生的原因之一[5]。胚胎第3~5个月,原始反射神经网络建立,这是胚胎后期及出生后吸吮-吞咽功能实现的前提,口-唇-舌-食道关联运动也刺激面部骨骼生长。
牙颌面骨骼的发育:上气道位于颅底下方及颌面后方,上下颌的位置关系与气道骨性框架的容积及形态密切相关,因此颅-颌面的发育变化是影响上气道大小的关键因素。出生后,颅-颌面快速生长,随着喉的下降,儿童逐渐能够在鼻呼吸的同时,配合进行不同比例的口呼吸,以适应运动等通气需求较高的生理状态[6]。因颅底软骨骨化,鼻上颌复合体向前下方生长,6岁后其生长动力源于腭中缝、鼻中隔软骨的生长及磨牙萌出。下颌骨因髁突和下颌支后缘的生长及周围软组织的作用向前下方移动,下颌的生长曲线比上颌更接近于全身的生长曲线[2]。颌面部的总体发育在6~8岁时已与成人非常相似,青春期前完成颌面发育的90%~95%[2]。
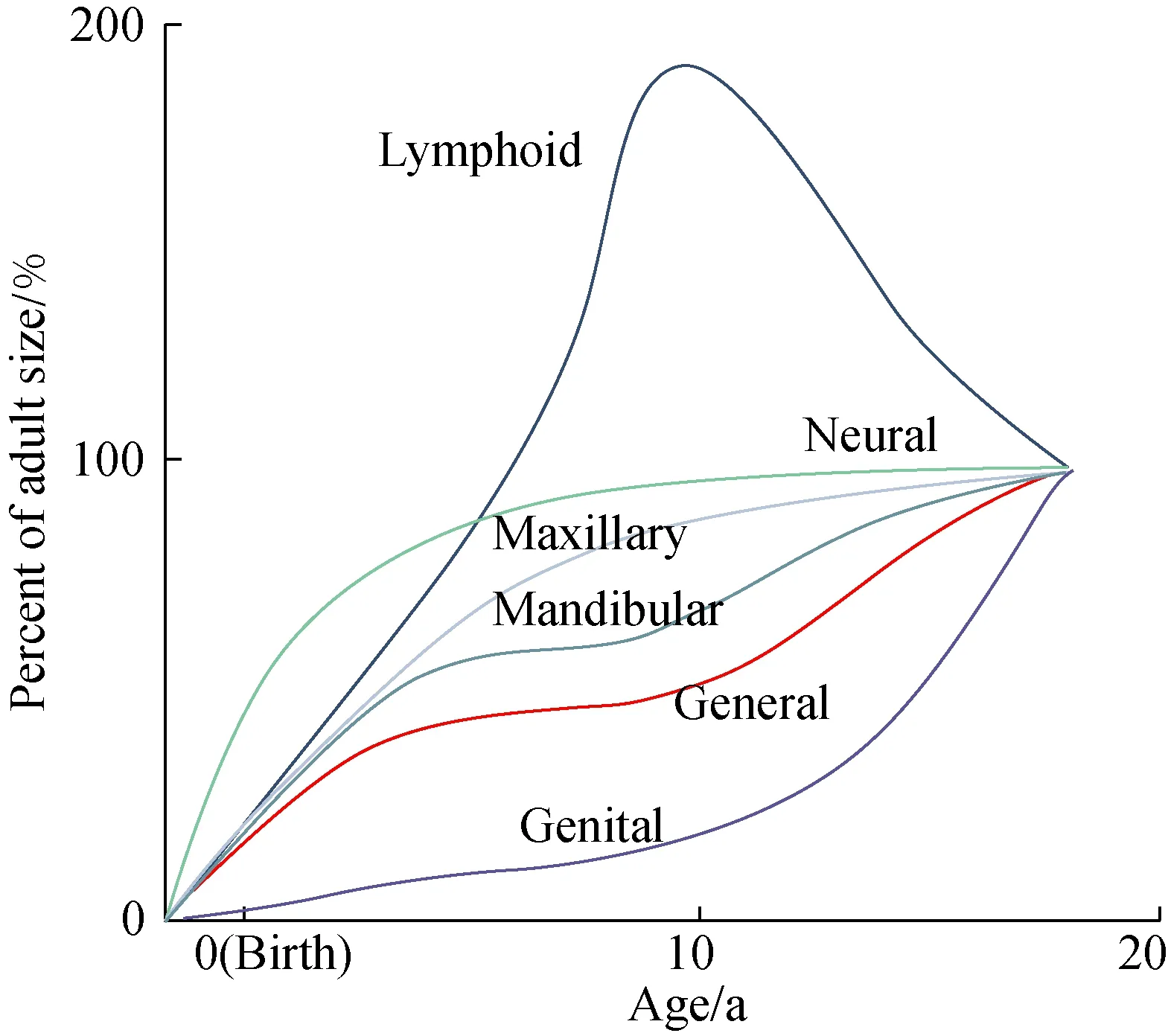
图1 以Scammon曲线为背景的颌骨生长曲线(重新绘制,图引自《当代口腔正畸学》第五版)[2]Fig.1 Growth curves for the maxilla and mandible shown aganist the background of Scammon’s curves(redrawn, quoted from Contemporary Orthodontics, the 5th edition)
咽淋巴组织的生长与免疫防御的形成:咽淋巴组织在病原体清除、免疫调节和组织修复中不断变化[7]。外源性抗原刺激生发中心淋巴滤泡及滤泡间淋巴组织增生,在出生后3~10年表现出最大的免疫活性。儿童腺样体增长始于婴儿期,6~10岁时达到高峰而后逐渐萎缩;腭扁桃体自婴儿期至4~5岁持续增长,而后保持稳定直至11岁左右略减小[8-9]。随着年龄增长,免疫系统逐步完善,淋巴细胞构成及实质纤维化的程度发生变化[10]。
健康儿童气道长度随身高增长成比例增加。颏棘-斜坡距离及下颌骨宽度与年龄呈线性关系;舌、软腭、鼻咽气道及腺样体与颏棘-斜坡距离保持恒定比例;扁桃体大小、扁桃体间距离及咽旁脂肪垫宽度与下颌骨宽度成比例生长[11]。炎症、口呼吸习惯、肥胖等因素作用于上气道,均可打破气道解剖结构的平衡,促使睡眠呼吸障碍的发生。
2 影响睡眠的上气道结构功能的关联性研究
上气道塌陷、阻塞是睡眠呼吸障碍疾病的主要特征,源于上气道骨骼结构与软组织比例失衡及神经-肌肉调节功能异常。受气道发育时序、后天获得性免疫完善,或肥胖的影响,儿童睡眠呼吸障碍可出现迁延持续、阶段性加重和自发缓解等不同病程阶段[12]。以下将从气道炎症、免疫、颌面骨骼结构及肥胖等方面阐述儿童上气道通气的影响因素。
2.1 气道炎症、软组织增生与免疫
出于维系生命基本功能的需要,呼吸道全时态暴露于病原微生物和复杂的物理、化学污染物或过敏原存在的刺激环境。气道的气液屏障、免疫屏障等在维持微环境稳态中发挥重要作用。病原微生物持续感染引起的免疫过激反应导致屏障功能异常,可引起区域淋巴组织代偿性肥大、气道重塑等结构改变,引发上气道阻塞、炎性分泌物渗出等临床症状。其中,儿童常见的腺样体和扁桃体疾病、过敏性鼻炎、鼻窦炎及过敏性哮喘等气道疾病具有高患病率、可合并发生的特点,并可追溯遗传背景的影响。
研究[13]显示,儿童腺样体和/或腭扁桃体肥大(以下简称腺扁肥大)的患病率为34.4%。腺扁肥大所致气道阻塞多见于青春期前,但由于淋巴组织消退的时间具有个体差异性,持续至成年期的腺扁肥大患者并不少见。气道阻塞的机制是腺样体体积与鼻咽气道生长比例不协调,扁桃体肥大导致口咽平面狭窄。
持续肥大的扁桃体组织病理学表现为细胞衰老、慢性炎细胞浸润和继发性改变(如上皮鳞状化生)[14-15]。目前认为其机制与病原体清除和免疫调节失衡引起的持续感染、组织损伤及病态修复有关[16]。扁桃体合并慢性复发性炎症时,抗原运输及提呈发生改变。淋巴细胞被持续的抗原刺激后无法对其他抗原做出反应。一旦免疫损伤发生,扁桃体就不能充分发挥局部免疫保护的作用[8]。
研究[17]显示,腺样体及扁桃体组织中贮存大量的病原微生物(细菌和病毒)。多种需氧菌(链球菌属、嗜血杆菌属、葡萄球菌属及莫拉菌属)和厌氧菌(消化链球菌属、普雷沃菌属及梭杆菌属)参与扁桃体肥大及慢性炎症的形成。Faden等[18]的研究显示,腺扁手术切除的70.9%的扁桃体组织及94.7%的腺样体组织中检测到病毒,其中腺病毒最常见,检出率为71.1%。扁桃体肥大程度分级与EB病毒感染有关;腺样体肥大则与腺病毒、EB病毒、冠状病毒、副流感病毒及鼻病毒均相关。
持续的炎症反应引起上呼吸道黏膜损伤,上皮细胞下神经末梢裸露,β受体兴奋性下调,导致气道高反应性,进一步加重气道的免疫失衡[19]。Ivaska等[20]发现人博卡病毒-1持续感染的患者扁桃体淋巴组织中Th-17细胞和Treg细胞免疫反应明显下降。 Jartti等[21]研究发现扁桃体组织病毒检出率与年龄呈强负相关,其细胞因子的表达与现有的病毒感染、年龄及过敏性疾病密切相关。
过敏性鼻炎、哮喘与上气道阻塞的临床症状和病理生理机制存在一定共性,但因果关系尚未证实。过敏性疾病引起上气道阻塞严重程度增加的机制考虑为:①鼻阻力增加,影响气道稳定性;②鼻塞引起口呼吸,促使颌面气道结构生长幅度及速度改变;③炎症细胞及介质增多,改变气道神经肌肉的调节能力[22-23]。一项涉及45 155名儿童的Meta分析[24]显示,哮喘显著增加儿童阻塞性睡眠呼吸暂停(obstructive sleep apnea hypopnea syndrome,OSAHS)的患病风险[OR=1.9,95%CI:1.7~2.2]。相较于无哮喘或哮喘控制良好的儿童,哮喘控制不佳儿童的夜间觉醒、白天嗜睡及学习能力下降的比例增加,且具有相对较长的睡眠潜伏期、较高的浅睡眠比例及微觉醒指数[25-26]。哮喘一线治疗药物——吸入性糖皮质激素(inhaled corticosteroids,ICS)与OSAHS的发生风险具有剂量依赖性,与未使用ICS的患者相比,低、中、高剂量组发生OSAHS的风险分别增加129%、267%和443%[27],其可能机制为用药后上呼吸道扩张肌收缩力下降和向心性肥胖导致咽腔周围组织压增加[28]。
反之,OSAHS继发的夜间睡眠片段化、慢性间歇性缺氧导致气道高反应性及炎性细胞因子水平增加也影响免疫调节功能[29]。Yang等[30]在OSAHS患者外周血细胞检测中发现,3个核心生物钟基因被破坏,包括BMAL1在内的8个生物钟基因在凌晨表达下调。Scheer等[31]的研究证实,稳定的昼夜节律系统在调节患者肺功能及哮喘严重程度方面具有重要作用。慢性间歇性缺氧作用于呼吸道上皮细胞及肺巨噬细胞,缺氧诱导因子-2α(hypoxia inducible factor-2α,HIF-2α)可诱导club细胞增殖,促使上皮细胞产生基质金属蛋白酶2(matrix metalloprotein-2,MMP-2)、MMP-9、白细胞介素-8(interleukin-8,IL-8)、血小板源性生长因子及血管内皮生长因子(vascular endothelial growth factor,VEGF)[32]。肺泡巨噬细胞通过HIF-1α和核因子-κB(nuclear factor-kappa B, NF-κB)信号通路使IL-6分泌增加[33]。此外,间歇性缺氧通过颈动脉化学感受器介导增加气道高反应性,加重疾病的严重程度[34-35]。
“同一气道,同一疾病”常用来描述过敏性鼻炎与哮喘的联系,气道作为一个整体,气道免疫调控异常可能是各类气道疾病关联的重要病理机制[24]。
2.2 颌面骨骼结构
不同种族的成人OSAHS解剖学研究[36]提示,在相同的体质量指数时,亚洲人更易于发生睡眠呼吸暂停,说明亚洲人的OSAHS与颅面结构异常的关联更加密切。颌面发育受到遗传控制和环境因素影响。其中两个关键因素为鼻-上颌复合体和下颌骨[37]。除遗传因素外,吸吮、咀嚼、吞咽及呼吸模式对面部肌肉张力的调节也影响着口腔及面部生长。
与成人不同的是,上气道阻塞继发的口呼吸会影响儿童的颌面结构发育,进一步加重上气道结构异常,形成恶性循环。腺扁肥大儿童中口呼吸比例增加。口呼吸导致口周肌肉张力平衡破坏及头部姿势改变,经过神经肌肉调节后,牙齿和颌骨逐渐适应错误的平衡状态,呈异常运动和生长方式[38-39]。研究[40-42]显示,儿童口呼吸与颌面生长异常及错合畸形发生率密切相关,表现为上、下颌骨向后下方旋转,上切牙唇侧倾斜[40]及上颌后牙弓明显狭窄[41-42]。上述口呼吸导致的结构改变,同样是成人患病的颌面危险因素。儿童口呼吸引起的气道结构改变与成人气道狭窄的关联,仍需更多的证据证实。
2.3 肥胖
儿童及青春期肥胖的常见原因是能量摄取与消耗不均衡[43]。儿童早期的肥胖很大程度上影响着青春期及成年后肥胖的发生,研究[44]指出,儿童肥胖的预防应提前到2岁以内。肥胖儿童上气道脂肪沉积,区域软组织比例增加[45],使青春期睡眠呼吸障碍持续的风险增加3.75倍;肥胖持续8年以上,导致中年患OSAHS的风险增加1.52倍[46]。儿童肥胖也是腺扁切除术后上气道阻塞缓解不佳的重要危险因素[47]。此外,肥胖患者血清特异性免疫球蛋白E(immunoglobulin E, IgE)、IL-6和肿瘤坏死因子-α(tu mor necrosis factor-α, TNF-α)浓度升高及IL-10浓度降低,导致机体对抗原的免疫耐受改变和失衡,促使过敏性疾病发生[23,48]。肥胖还可导致骨龄增加,刺激过度生长,从而使颌面气道发育提前[49-50]。肥胖儿童上气道阻塞的病因构成分析应更加细化。
总之,气道炎症、颌面结构、肥胖等因素及其交互作用是导致儿童上气道阻塞的重要危险因素(图2)。
在病因与病理生理机制的探讨中,应充分考虑到气道本身的发育规律,包括儿童期气道阻塞是否会持续发展为青春期或成年期的疾病状态等,需要规模性的队列研究进一步明确。
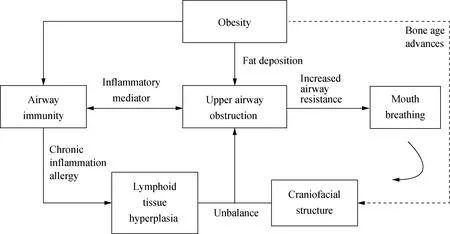
图2 影响上气道通气功能的因素及交互作用Fig.2 Factors and their interactions of ventilation function in the upper airway
3 不同年龄儿童临床睡眠呼吸障碍特点及干预措施
制定儿童上气道阻塞的干预策略应充分考虑疾病的自然缓解规律,病因间的交互作用,并要权衡干预给儿童带来的风险与获益。
3.1 婴幼儿期
婴幼儿上气道阻塞具有独特的病理生理机制和自然病程。常见病因为颅面异常、神经肌肉疾病和遗传综合征,如喉软骨软化病、脑瘫、下颌骨发育不全、面中部发育不全综合征、Pierre Robin综合征等[51]。腺扁肥大是6个月以后婴儿上气道阻塞的重要诱因,与上气道感染及其他全身性疾病有关。此外,胃食管反流引起声门及声门下区肿胀也可导致疾病加重[52]。
干预措施的选择取决于病因及医疗条件,旨在保持气道通畅及扩大咽腔,常需多学科协作。非手术治疗包括体位治疗、置入鼻咽通气道或支架等,手术措施包括喉软化的声门上成形术、下颌骨牵引术、腺扁切除术、后鼻孔闭锁成形术等。由于干预后有较大比例的婴幼儿气道阻塞持续,仍需持续随访与序贯治疗[53-54]。
3.2 儿童期
在无干预状态下,儿童睡眠呼吸障碍自然转归的队列研究[41,55-59]显示,OSAHS随发育可出现缓解、持续或加重。在CHAT(Childhood Adenotonsillectomy Trial)队列研究[41]中,42%的OSAHS患儿在无干预治疗下随访7个月后缓解。睡眠问卷提示:症状改善者仅占15%[55]。肥胖、性别与气道结构发育等因素对儿童睡眠呼吸障碍从儿童期向青春期的转归具有预测作用[56-57]。
腺扁切除术是儿童上气道阻塞的一线治疗方法。CHAT队列中,与无干预治疗的儿童相比,腺扁切除术后儿童的症状减轻,嗜睡程度、行为学指标和儿童生活质量明显改善[58]。术后患儿上、下切牙唇侧倾斜,牙弓周长和宽度,咬合不正及下颌生长模式等指标有正常化的趋势,但不能完全逆转[41,59]。
腺扁切除术后对体液免疫的影响一直是关注热点,多数研究[60-63]显示,婴幼儿及儿童术后短期、长期体液免疫及细胞免疫功能处于正常范围(表1)。基于大型数据库研究[64]的分析显示,与27 012名性别、年龄及居住地匹配的仅药物治疗的哮喘儿童相比,13 506例合并哮喘进行腺扁切除术的儿童哮喘急性发作次数、就诊率及住院率在术后1年明显降低,支气管扩张剂、ICS、白三烯受体拮抗剂及口服糖皮质激素使用量显著减少。然而也有研究[65-66]显示,腺扁切除术后儿童对脊髓灰质炎病毒疫苗反应下降,新发哮喘患病率增加。干预时机的选择对免疫系统及颌面发育的影响仍需继续探究。

表1 腺样体和/或扁桃体切除术后儿童免疫功能变化Tab.1 Changes in the immune function of children after adenotonsillectomy
非手术治疗中,鼻用糖皮质激素及白三烯受体拮抗剂作为轻、中度OSAHS儿童的治疗药物,可改善症状评分、降低睡眠呼吸事件,但是否能减小腺扁体积仍有分歧[67]。持续气道正压通气治疗(positive airway pressure, PAP)是中-重度OSAHS儿童重要的替代治疗及围手术期补充治疗的手段。应密切监测长期使用PAP治疗患儿的气道阻塞随生长的改变情况以调整参数,并关注面罩压力导致的中面部发育不良的情况。停止使用PAP治疗的指征包括症状和/或睡眠呼吸参数随年龄的增长、气道手术的干预及减重而改善[68-69]。
口腔正畸治疗包括上颌骨快速扩弓及下颌前导矫治。干预时间窗应充分考虑儿童颌面发育规律,上颌扩弓治疗对于腭骨中缝闭合前的儿童具有较好效果[67]。口周肌肉功能训练可应用于口呼吸习惯不良及腺扁术后口呼吸持续的儿童,以减少口周肌肉力量失衡对颌面发育的影响[70-71]。对合并肥胖的患病儿童同期进行减重治疗,也是缓解睡眠呼吸障碍的重要方法。
3.3 青少年期
Schwab等[72]研究发现肥胖的OSAHS青少年群体的主要危险因素是咽淋巴组织增生,而不是气道软组织结构的增大,提示腺扁切除术可作为肥胖青少年OSAHS的一线治疗方式之一。由于青少年OSAHS病理生理机制及临床研究较少,其干预和治疗方法多借鉴学龄后期及成人。青少年期处于生长发育的高峰时期,充分评估患病的潜在因素并予以遏制和逆转,可能将从源头阻断发生成人OSAHS。
4 建立儿童智能健康管理模式
2021年第七次全国人口普查数据[73]显示,我国0~14岁少年儿童人口约2.53亿(占总人口的17.95%)。面对庞大的人口基数,加强对儿童成长发育过程中的健康管理和疾病防治是一项重要的任务。儿童上气道阻塞可引发一系列成长期和成年期的远期并发症,如神经认知损伤、学习障碍、生长发育落后、颌面发育异常、内分泌代谢紊乱,甚至增加成年期心血管等事件的发病风险等[67,74]。
队列研究是探究儿童青少年睡眠障碍疾病的病理机制及其对全生命周期健康影响的理想手段,其优势包括:①所获得的资料完整可靠,无回忆偏倚;②暴露因素与疾病的时间先后顺序清晰,可进行因果论证;③有助于了解疾病的自然史,分析多种暴露因素及疾病间的交互作用和结局关系[12]。目前全球范围内大型儿童睡眠呼吸障碍疾病的队列研究多基于出生队列,如Avon Longitudinal Study of Parents and Children(ALSPAC)、Millennium Cohort Study(MCS)、the Canadian Healthy Infant Longitudinal Development(CHILD)出生队列,中国-安徽出生队列(C-ABCS)及上海优生儿童队列(SBS)等。此外,CHAT队列纳入腺扁切除术和等待观察及支持治疗的OSAHS儿童,评估不同干预措施对儿童生活质量、神经认知水平及生长发育的影响,对疾病的临床干预具有重要指导价值。香港中文大学于2003-2004年建立的社区睡眠队列[56]是国内经典的儿童睡眠呼吸障碍疾病研究队列,揭示了儿童OSAHS疾病的自然病程,睡眠呼吸障碍疾病与肥胖、高血压、抑郁等躯体及精神疾病的关系,对我国儿童睡眠研究具有重要推动作用。然而,绝大多数队列研究中缺乏睡眠呼吸监测,仅基于睡眠症状问卷,限制了建立睡眠疾病表型、内在型分析及个性化防治模式。
儿童睡眠呼吸障碍病因复杂,临床特点异质性大且牵涉多个学科的序贯治疗。建立治疗策略需要综合考虑气道发育及免疫系统发育的时序变异特点、个体表型差异、患病危险因素此消彼长之间的关系。同时也要考虑经口呼吸导致的颌面发育异常以及肥胖、过敏性疾病等可能延续至成年期的问题。儿童的睡眠呼吸监测较成人技术要求更高,也是此类长期队列研究的瓶颈问题。通过未来低负荷穿戴式诊断设备的规模性应用、基于物联网云平台的数据联通系统、大数据人工智能分析等[75],建立全生命周期的预防-治疗-随访为一体的健康管理预警系统,可以满足提供更高等级临床证据验证数据的需求,也是实现儿童睡眠疾病健康管理,实现防治结合的技术关键,更是践行健康中国发展战略的重要一环。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明李彦如:论文设计、撰写及修改;王慧君:论文撰写及修改;韩德民:论文审核及修改。

