颞叶癫痫伴双侧海马硬化的临床研究进展
陶琪 邱晶晶 何晨敏 王爽
颞叶癫痫是常见的局灶性癫痫,其发作起源于颞叶,根据起源的具体部位还可进一步分为颞叶内侧型、外侧型和混合型。颞叶癫痫发展为药物难治性癫痫的比例高达71%,也是常见的耐药性癫痫[1]。颞叶癫痫伴海马硬化(TLE-HS)是常见的颞叶癫痫,也是经典的局灶性癫痫综合征之一,患者的癫痫发作一般起始于颞叶内侧或同时累及边缘系统结构,并伴随海马硬化。海马硬化具有鲜明的影像学特征(图1),能被高分辨率MRI或图像后处理程序较敏感识别。
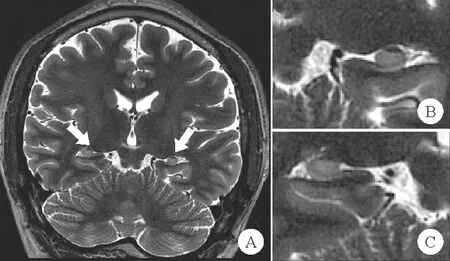
图1 双侧海马硬化MRI表现(冠状位):A:T2序列见双侧海马体积缩小(如箭头所示),海马体信号增高,海马内部结构紊乱;B:左侧海马硬化;C:右侧海马硬化
TLE-HS还可分为颞叶癫痫伴单侧海马硬化(TLE-uHS)和颞叶癫痫伴双侧海马硬化(TLE-bHS)。一项国内研究发现,颞叶内侧癫痫患者中出现海马硬化的比例达59%,显著高于健康对照组和非颞叶内侧起源的癫痫组,同时TLE-uHS约占颞叶内侧癫痫的47%,而TLE-bHS约占12%,表明TLE-bHS临床并不少见[2]。TLE-uHS一般可作为颞叶癫痫的代表性类型,相关研究报道多见,通常为人们所熟知,而TLE-bHS相关文献很少,人们对其认识不足,这与其发病率并不相称。作为TLE-HS的亚型,TLE-bHS不仅耐药性癫痫发生率高,且大部分患者并不适合切除性手术治疗,总体治疗效果很不理想。本文回顾近年来有关TLE-bHS的研究进展,为临床医生深入了解此类疾病提供帮助。
一、TLE-bHS的病理学和影像学特征
海马硬化最早由德国精神病学家Wilhelm Sommer于1880年提出,其大体表现为海马体萎缩和组织硬化,病理特征为海马神经元丢失和反应性胶质增生。2013年国际抗癫痫联盟基于神经元丢失和胶质增生的组织学模式将海马硬化分为典型(1型)和非典型(2型和3型)两类。此外,颗粒细胞重组和神经元集群的改变、神经肽纤维网络和苔藓纤维发芽均为与癫痫相关海马硬化的显著特征[3]。海马硬化有时与颞叶的其他病理改变合并存在,如高度分化的胶质神经元肿瘤和局灶性皮质发育不良[4]。
海马硬化的MRI特征包括海马体积缩小、T2加权成像(或FLAIR相)信号强度增加、T1信号降低、海马内部结构破坏和紊乱[5-9]。其中,海马萎缩和信号改变是最为重要的征象[10]。值得注意的是,TLE-uHS患者对侧海马通常也会出现轻微的体积减小,而TLE-bHS患者则具有明确的双侧海马硬化特征。此外,与TLE-uHS患者相比,TLE-bHS可能还存在更为严重的颞叶外白质损害,有学者采用全脑体素分析技术比较TLE-bHS、TLE-uHS患者与正常健康对照组的差异,发现TLE-bHS患者在颞外轨迹和连合通路中均表现出更为明显的白质病变(包括各向异性分数降低、平均弥散度增加或白质体积减少),且白质损害的范围涉及穹窿、扣带回和钩状束等区域[11]。
二、TLE-bHS的病因及发病机制
海马硬化形成的病因尚不完全清楚,可能是由多重因素造成的。有研究证据显示,海马神经损伤与过度释放神经递质(尤其是谷氨酸)的兴奋毒性相关[12]。长时间的癫痫发作会导致神经元丢失、胶质细胞增生,神经元之间突触增多或形成假突触,从而导致海马神经网络结构上的重构。这种重构可分为2个方面,一方面是形态学上的变化,另一方面为功能方面的变化(如海马细胞功能蛋白分子水平的改变),而这些功能蛋白水平的改变可能会引起重构后神经网络的自发性放电[13]。此外,海马硬化是癫痫发作的病因还是后果也尚无定论,虽然海马硬化可能由癫痫持续状态产生,但TLE-HS的形成并不仅仅依赖于细胞丢失或海马内的神经可塑性改变。到目前为止,没有一个单独的致病因素足以导致海马硬化。
早期的研究显示,儿童早期持续时间较长的热性惊厥发作史与海马硬化存在重要关联[14-15]。10年前启动的前瞻性FEBSTAT研究已在少数(11%)持续时间较长的高热惊厥发作史患者中检测到海马硬化,而这些患者是否出现颞叶癫痫还有待长期随访明确[16-17]。部分患者海马硬化还与大脑发育障碍有关(如局灶性皮质发育不良和灰质异位),提示长时间的热性惊厥并非海马硬化的唯一原因。
TLE-HS存在家族易感性,家族性颞叶癫痫中部分成员会出现海马硬化。一项针对TLE-HS患者一级亲属MRI的研究发现,无症状亲属的海马体积比正常小,这可能是类似海马硬化的一种发育变异[18]。全基因组测序的研究也发现了与海马体积相关的常见基因变异[19-20],未来进一步的研究可能会明确这些基因如何影响海马发育,及其是否与癫痫患者海马体积缩小、海马硬化易感性有关。
TLE-bHS患者最常见的可识别的病因是感染,主要是脑膜炎或脑炎。近2/3的TLE-bHS患者中没有明确的诱发因素,病因不明;另外1/3患者,感染和热性惊厥是主要病因,少数病因为出生损伤、脑外伤、推测的抗体介导性疾病、新发难治性癫痫持续状态或发热性感染相关癫痫综合征[21]。可推测这些损伤因素,尤其是感染,可能导致具有遗传易感性的患者产生双侧海马硬化。此外,神经退行性疾病(如阿尔茨海默症和额颞叶痴呆)同样存在海马硬化,这可能和异常蛋白的沉积有关[22]。
三、TLE-bHS的癫痫发作症状及脑电图(EEG)特征
TLE-HS的首次癫痫发作常在儿童晚期或青少年早期,最初的发作事件可能是双侧强直-阵挛或局灶知觉损害性。典型先兆包括与恐惧等情绪障碍相关的腹部上升感、精神症状(如似曾相识感)和自主神经症状(如脸红、面色苍白、心动过速)等。TLE-HS的常见发作期症状包括呆滞发作、同侧肢体自动症、对侧肢体肌张力障碍和口咽部自动症[23],与TLE-uHS患者相比,TLE-bHS患者癫痫发作无先兆的比例及发作频率较高。Sen等[21]报道TLE-bHS患者每月癫痫发作平均次数为10.9次,大多数为局灶知觉损害性发作或局灶扩展至双侧强直-阵挛发作(45.8%,44/96),仅有局灶知觉损害性发作的患者占24.0%(23/96),而仅有局灶扩展至双侧强直-阵挛发作的患者只占4.2%(4/96),仅有局灶知觉性发作的患者未见,此外有27%(26/96)的TLE-bHS患者存在癫痫持续状态。
TLE-HS患者的常规EEG检查可表现正常或仅有非特异性异常,但长程监测则显示大多数患者能记录到发作间期癫痫样异常[24-25]。Williamson等[25]研究报道96%的TLE患者在长期监测期间出现癫痫样异常。临床发作后30秒内,头皮EEG的变化以颞叶节律性α或θ活动为标志。
TLE-bHS患者癫痫发作期的电活动能迅速传播到对侧颞叶,且当癫痫发作的EEG起始模式为低幅快活动时,这种EEG活动难以在头皮EEG中准确观察到[26],因此头皮EEG对于癫痫起始病灶定位存在局限性。一项研究显示,据头皮EEG推测为双侧颞叶癫痫的患者,颅内电极记录到其中73%癫痫发作起始于单侧颞叶[27-28],仅11.5%为比较明确的双侧颞叶独立起源[26]。因此,仅依靠头皮EEG记录到的癫痫发作期起始侧别或海马硬化的侧别对致痫灶定侧有很大局限性[29]。King-Stephens等[30]选择疑似双侧颞叶内侧癫痫患者82例,所有患者的双侧颞叶均植入反应性电刺激装置,通过分析设备储存的EEG信息,69例(84%,69/82)最终出现双侧颞叶起始的癫痫发作,而记录到首次对侧颞叶起始的癫痫发作的平均时间为41.6天(中位时间13天,范围0~376天)。长程EEG监测需消耗大量的医院资源,长期颅内监测还存在感染风险,因此临床上一般情况下监测持续时间限制为1~2周。对于可能的双侧颞叶癫痫,此监测时间很可能不足以明确发作起源的侧别,也无法确定癫痫发作起源侧别的分布[31-33]。考虑到TLE-bHS大部分存在双侧颞叶的致痫性,双侧颞叶癫痫的可能性较高,未来植入式的长程EEG的记录设备可能有助于明确诊断。
四、TLE-bHS的认知损害及精神共病
前颞叶和海马在学习、记忆等认知功能方面起关键作用[34]。在颞叶癫痫中,长期的发作不仅会加重同侧海马和颞叶的损伤,还会导致对侧海马出现损伤,所以发作频繁的患者会出现不同程度的智力、学习、记忆、思维等认知功能障碍[35-36]。Vanli等[37]比较16例TLE-bHS、36例右侧TLE-HS和39例左侧TLE-HS患者的记忆评分,发现左、右海马硬化组患者言语记忆过程测试的延迟回忆得分比较差异有统计学意义,而TLE-bHS组的基线认知损害均比其余两组更严重。TLE-bHS患者还存在较高的认知和精神共病率,既往研究结果显示,17.7%(17/96)患者存在记忆功能障碍,另有21.9%(21/96)患者存在智力障碍;精神共病几乎影响一半的患者,如抑郁、焦虑或两者兼有,4.2%(4/96)患者发展为发作间期精神病,另有4.2%(4/96)患者出现发作后精神病[21]。
五、治疗与展望
约70%~80%的TLE-HS患者会发展成药物难治性癫痫[38-39],TLE-uHS患者往往能从切除性或消融手术中获益,手术疗效较好,但因其存在双侧致痫性,其中大部分可能不适合切除性手术治疗,因此临床上治疗效果总体并不理想,患者往往尝试过多种抗癫痫药物治疗。Sen等[21]报道96例TLE-bHS患者之前尝试的抗癫痫药物平均数量为5.32种,其中最常见为卡马西平和左乙拉西坦,目前使用的药物平均数量为2.99种。
因对TLE-bHS患者行双侧颞叶切除仍为禁忌,部分学者尝试采用一些复合的外科治疗措施,如单侧颞叶切除、对侧杏仁核冷冻或对侧海马杏仁核深部电刺激或给对侧海马实施射频治疗等。近年来,神经调控手术的不断发展为TLE-bHS的治疗带来新的希望。既往一项研究追踪96例TLE-bHS患者,11例(11.5%)行手术切除,其中仅1例完全无癫痫发作,3例(手术切除患者的27.3%)癫痫发作频率有所改善[21]。部分患者接受或正在考虑神经刺激疗法,其中包括迷走神经刺激(9.4%,9/96)、反应性神经刺激(6.3%,6/96)或两者均有。
TLE-bHS在临床工作中并不少见,通常药物治疗困难,其中大部分难以从癫痫致痫灶切除术中获益,治疗现状总体很不理想。为更好地控制TLE-bHS患者的癫痫发作,我们需对其电生理特征、病理类型及病因学等方面展开更为深入的高质量研究,以指导临床的诊断与治疗。

