乳糖醇调节液态发酵红曲菌生长及莫纳可林K代谢的研究
许世锦,胡文林,陈罗华周,聂增宇,陈玲娟
(广东天益生物科技有限公司,广东 湛江,524300)
1979 年日本学者远滕章(AKIRA ENDO)教授发现红曲霉(Monascusruber)能产生强力抑制胆固醇合成的活性物质,将其命名为莫纳可林K(Monacolin K,MK)[1]。1985 年又相继分离到Monacolin L、X、J、Dihydroerinolin和Dihydromonalin L 等类似物,它们都具有相同的基本结构(L 是J 的前驱物,J 是K 的前驱物),同时又都具有很强的降低胆固醇的作用[2]。其中,红曲中的MK 作用最强,能高效地抑制胆固醇合成中的关键酶3-羟基-3-甲基戊二酸单酰辅酶A(3-hydroxy-3-methyl glutaryl coenzyme A,HMG-CoA)还原酶的活性,进而调节血脂水平[3]。
目前,国内MK 的生产全部以大米为碳源、采用塑料三角瓶固态发酵方式生产。与传统固态发酵法相比,液态发酵法具有规模大、自动化程度高、人力成本低及生产过程中可以控制杂菌污染的显著优点。据报道以乳糖为碳源的液态发酵产127 mg/L 的MK,为国外红曲菌液态发酵MK 的最高产量[4]。甘油作为常用碳源之一,对红曲菌生长和代谢有着重要作用,且能大幅提高合成MK 基因的转录水平[5]。目前国内采用甘油与葡萄糖或米粉作混合碳源的液态发酵产MK 的研究,进展显著[6-8],尤其当甘油与淀粉[m(甘油)∶m(淀粉)=3∶1]为混合碳源的液态发酵产MK可达1 302 mg/L[9],但以采用纯甘油为碳源的摇瓶与15 L小型发酵罐液态发酵产MK的产量最高,分别为1 600、888.9 mg/L[10]。另外,在甘油与淀粉为混合碳源的培养基中,再添加非离子表面活性剂对MK产量的提高效果更为明显[11],尤其是添加非离子表面活性剂Triton X-100,液态发酵产MK可达到 2 026.0 mg/L[12],效果极显著。上述液态发酵技术中,甘油作为碳源发酵生产应用于食品、保健品、药品作为原料的MK 制品,不符合GB 2760—2014《食品安全国家标准 食品添加剂使用标准》和QB/T 2847—2007《国家轻工行业标准 功能性红曲米(粉)》,无法量产。非离子表面活性剂Triton X-100虽可大幅提高MK的产能,但具有毒性,且红曲菌无法利用,其在产品中的残留物的清除方法及其对产品质量的影响等方面尚需深入的理论研究。由于采用大米淀粉作为碳源利于产色素,而不利于产MK[13],产MK值不足100 mg/L,无经济价值。目前尚未见采用符合GB 2760—2014《食品安全国家标准 食品添加剂使用标准》和QB/T 2847—2007《国家轻工行业标准 功能性红曲米(粉)》的原料作为碳源进行液态发酵生产MK的相关报道。
基于此,本文拟研究糖醇对红曲菌TY02生长与代谢的影响,探讨糖醇对红曲菌TY02的MK代谢调控机理,以期为谷物淀粉等物质作为碳源、且符合GB 2760—2014《食品安全国家标准 食品添加剂使用标准》和QB/T 2847—2007《国家轻工行业标准 功能性红曲米(粉)》的原料进行的液态发酵大幅提高红曲菌MK的代谢能力、突破液态发酵低产MK的技术瓶颈、实现功能红曲液态发酵量产提供理论参考。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株
紫色红曲菌TY02(MonascuspurpureusTY02)为广东天益生物科技有限公司保藏于中国典型培养物保藏中心,保藏编号为CCTCC M2018586的保藏菌株。
1.1.2 实验仪器
HWY-2112型双层恒温培养摇床,上海智城分析仪器制造有限公司;LC-20AD高效液相色谱仪、SPD-20A紫外分光检测器,日本岛津仪器有限公司;SW-CJ-1FD型超净化工作台,苏州净化器设备有限公司;LS- B50L型立式蒸汽灭菌锅,上海医用核子仪器厂;LXJ-ⅡB型低速大容量多管离心机,上海安亭科学仪器厂;DHG-9140A型鼓风干燥箱、HWS-28型电热恒温水浴锅、LRH-150型生化培养箱,上海一恒科学仪器有限公司;B2200S型超声波清洗器,必能信超声(上海)有限公司;MP502B型电子天平,上海精密实验器材有限公司
1.2 培养基
斜面培养基:12 °Bx麦芽汁培养基
种子培养基(g/L):葡萄糖60,蛋白胨25,玉米浆10,NaNO32,MgSO4·7H2O 1,K2HPO4·3H2O 1.5,pH值自然。
发酵培养基(g/L):黏米粉120,大豆水解液40,玉米浆5,NaNO33.5,MgSO4·7H2O 1.5,K2HPO4·3H2O 2.5,pH 4.5。
1.3 培养条件及方法
斜面培养:挑取1环菌种接种于斜面培养基中,在30 ℃培养箱中培养至菌丝长满斜面。
种子液培养:用10 mL无菌水洗涤试管斜面孢子,接种至含有100 mL种子液培养基的500 mL三角瓶中,在30 ℃ 200 r/min的旋转摇床上培养48 h。
液体摇瓶发酵培养:将种子液按12%(体积分数)接种量接种于装有100 mL发酵培养基的500 mL三角瓶中,在30 ℃ 180 r/min的旋转摇床上培养 3 d,然后于24~25 ℃发酵至22 d。
1.4 分析方法
菌体量的测定:菌体量采用干重法测定。取发酵液,用3 层纱布过滤,蒸馏水洗涤2~3 次,拧干,在60 ℃ 烘箱中烘干至恒重。菌体量[生物量(dry cell weight,DCW)]的计算如公式(1)[14]所示:

(1)
MK的测定按QB/T 2847—2007《国家轻工行业标准 功能性红曲米(粉)》执行:发酵液的预处理。称取发酵液或发酵液滤液5 g,加入35 mL 75%(体积分数)分析纯乙醇,超声波萃取50 min,然后再加入适量的75%分析纯乙醇,再超声波萃取10 min,冷却,定容至50 mL,离心分离10 min(3 500 r/min),然后用0.45 μm的有机微孔滤膜过滤,滤液用于测定MK,测定的MK为总MK。胞外MK的测定是以发酵醪液经滤纸过滤后的滤液为样品,样品预处理方法和测定方法与总MK的测定相同。
色谱条件:色谱柱:C18柱(250 mm×4.6 mm),柱温20~25 ℃,紫外检测器:238 nm检测波长,流动相:V(甲醇)∶V(水)∶V(磷酸)=385∶115∶0.14,流速为1.0 mL/min,进料量为20 μL。
桔青霉素的测定:按GB 5009.222—2016《食品安全国家标准 食品中桔青霉素的测定》中的第一法执行。
乳糖醇的测定:按GB 1886.98—2016《食品安全国家标准 食品添加剂 乳糖醇 (又名4-β-D吡喃半乳糖-D-山梨醇)》执行。
1.5 数据统计分析
使用IBM SPSS®Statistics 20(NY,USA)对不同糖醇添加条件下菌丝体生物量和MK产率进行单因素方差分析(one-way ANOVA),组间比较采用最小显著差法(least significant difference,LSD)方法。每组的样本量为20,显著性水平为0.05。
2 结果与分析
2.1 糖醇种类及部分对应糖对紫色红曲菌TY02生长和MK代谢的影响
以1.2培养基中的发酵培养基为基本发酵培养基,在发酵初始时(0 d)分别添加30 g/L麦芽糖醇、山梨糖醇、甘露糖醇、木糖醇、赤藓糖醇、乳糖醇、异麦芽糖醇、木糖、麦芽糖、乳糖,按照1.3的方法进行培养,菌体DCW、MK质量浓度与糖醇种类及部分相应糖的关系如图1所示。
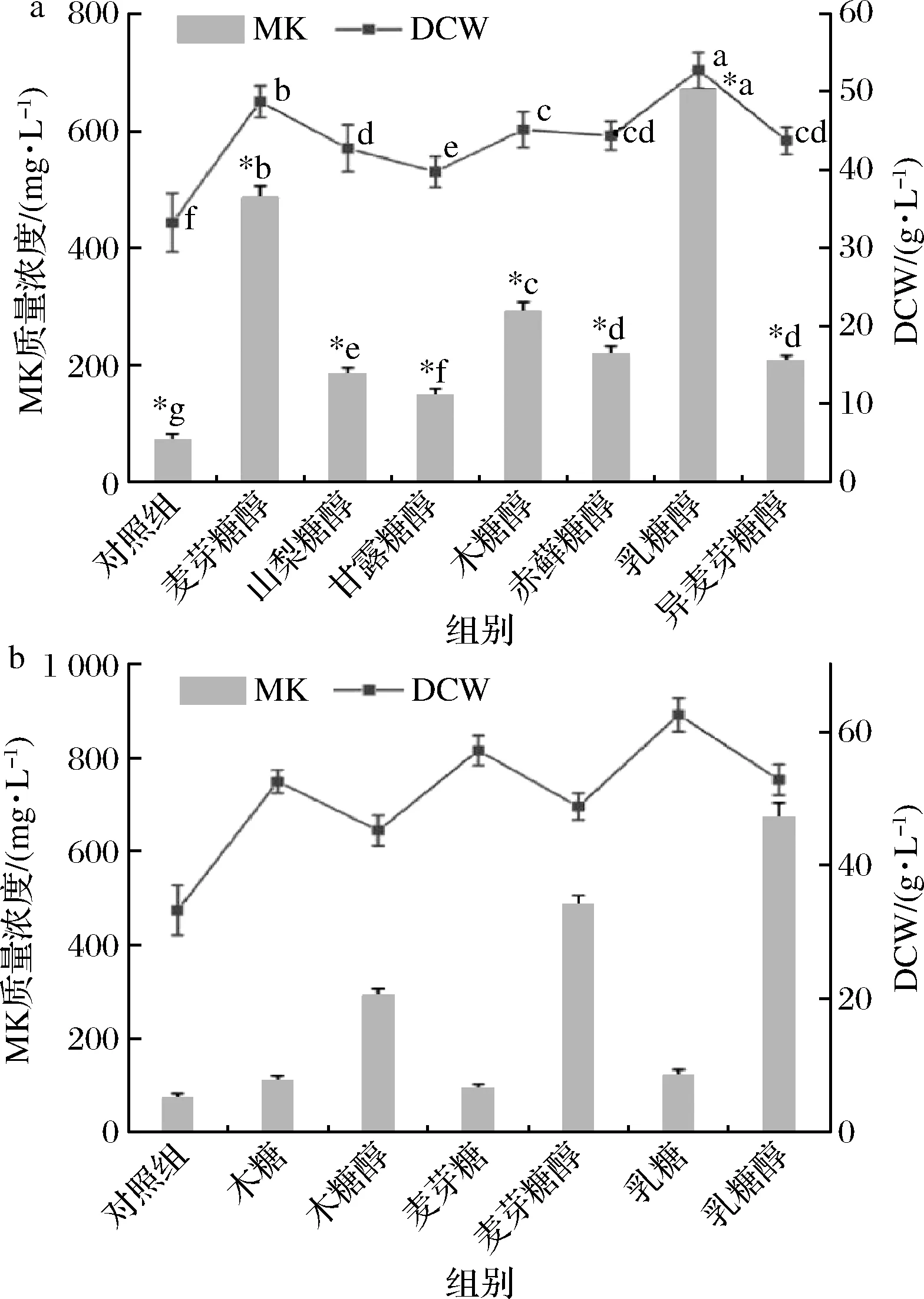
a-糖醇;b-糖以及对应的糖醇图1 糖醇和糖种类对紫色红曲菌TY02菌丝体DCW和MK产量的影响Fig.1 Effects of sugars and sugar alcohols on the mycelial biomass DCW and MK yield of Monascus purpureus TY02注:a~f,*a~*g不同标记字母分别表示菌丝体DCW和MK产率在不同糖醇种类添加下组间差异显著(P<0.05)
由图1-a可知,在不同种类糖醇添加的条件下,紫色红曲菌TY02的生长与MK代谢均呈正增长,菌体DCW与产MK呈正相关的关系。其中,添加木糖醇、麦芽糖醇、乳糖醇效果较佳,尤以添加乳糖醇效果最佳,菌体DCW与MK质量浓度分别为45.96、48.83、52.65 g/L和291、482、665 mg/L,分别为对照组(DCW 33.08 g/L、MK 75 mg/L)的1.39、1.48、1.59倍和3.88、6.43、8.87倍(P<0.05)。实验表明紫色红曲菌TY02能够利用糖醇作为碳源,糖醇对菌体生长具有促进作用[15],同时能显著提高MK 的代谢能力。
由图1-b可知,不同种类的糖和对应的糖醇均能显著促进紫色红曲菌TY02的菌体生长,但添加糖类的菌体DCW均高于对应的糖醇,这说明紫色红曲菌TY02优先利用糖类作为碳源。与对照组相比,糖类虽能显著促进紫色红曲菌TY02的生长,但其产MK能力明显不足,这表明代谢过程中产生的葡萄糖可显著地抑制红曲菌TY02的MK代谢[16]。实验表明,相对于添加糖类,糖醇更能促进紫色红曲菌TY02合成MK,因此可推测,糖醇既可作碳源,还影响紫色红曲菌TY02的MK代谢途径。
2.2 乳糖醇添加量及添加时间对紫色红曲菌TY02生长和MK代谢的影响
以1.2培养基中的发酵培养基为基本发酵培养基,分别在发酵初始时(0 d)添加20、40、60、80、100、120 g/L乳糖醇,以及在发酵0、2、4、6、8、10、12 d分别添加80 g/L乳糖醇,按照1.3的方法进行培养,菌体DCW、MK质量浓度与乳糖醇质量浓度和添加时间的关系如图2所示。
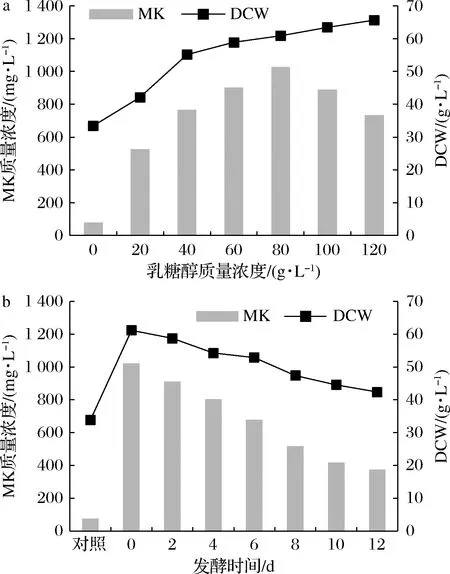
a-DCW和MK质量浓度;b-DCW和MK质量浓度图2 乳糖醇添加量及添加时间对紫色红曲菌TY02DCW和MK产量的影响Fig.2 Effects of lactitol concentration and addition time on the mycelial biomass DCW and MK yield of Monascus purpureus TY02
由图2-a可知,紫色红曲菌TY02的菌体DCW与乳糖醇的浓度呈正相关的关系,产MK的质量浓度随着乳糖醇浓度的增加而增加,至乳糖醇质量浓度为80 g/L时,MK达极值。此时DCW为60.92 g/L,MK为1 018 mg/L,分别为对照组(乳糖醇添加量为0 g/L)(DCW 33.47 g/L、MK 78 mg/L)的1.82倍和13.05倍,此后随着乳糖醇浓度的进一步提高,MK呈递减趋势。
实验表明,添加过多的糖醇,紫色红曲菌TY02会趋向菌体生长,而不利于合成MK,这可能是碳氮比过高会导致紫色红曲菌TY02将更多的能量用于菌体生长[17]。上述结果表明,红曲菌发酵过程中添加适量的乳糖醇极利于MK的合成,乳糖醇添加的最佳质量浓度为80 g/L,这与文献报道的以甘油为碳源的发酵产MK类似[18]。
由图2-b可知,在不同的发酵时间添加乳糖醇对紫色红曲菌TY02的菌体生长与MK代谢的影响程度各不相同。与对照组相比,菌体DCW均呈正增长,MK产量均得到提高,两者均为正效应,两者均在0 d添加最大,此时DCW为61.21 g/L、MK为1 023 mg/L,分别为对照组DCW 33.81 g/L、MK 76 mg/L的1.81倍和13.46倍。乳糖醇最佳的添加时间节点为发酵初始时间(0 d),这与文献报道的红曲黄色素发酵类似[19]。
2.3 乳糖醇对总MK、胞外MK、开环MK代谢的影响
以1.2培养基中的发酵培养基为基本发酵培养基,在发酵初始时(0 d)添加80 g/L乳糖醇,以及在发酵初始时(0 d)分别添加0、20、40、60、80、100、120 g/L乳糖醇,按照1.3的方法进行培养,总MK质量浓度、胞外MK质量浓度、胞外MK占比与发酵时间的关系和开环MK占比与乳糖醇添加量的关系如图3所示。

a-总MK、胞外MK、胞外MK占比;b-开环MK占比图3 紫色红曲菌TY02发酵过程中总MK产量、胞外MK产量以及胞外MK比例的变化及乳糖醇添加量对开环MK比例的影响Fig.3 Changes of yields of total MK and extracellular MK,as well as the ratio of extracellular MK during fermentation,and effects of lactitol additives on the ratio of open-loop MK in the broth of Monascus purpureus TY02
由图3-a可知,紫色红曲菌TY02在发酵初始时(0 d)添加0 g/L乳糖醇,其代谢的总MK、胞外MK、胞外MK占比的走势基本上一致,表现为随着发酵时间的增加而递增,发酵至22 d,上述三者均达最大值,此时总MK、胞外MK、胞外MK占比分别为87、37 mg/L和42.53%。在发酵初始时(0 d)添加80 g/L乳糖醇,产总MK的走势与前者相似,但胞外MK、胞外MK占比与对照组明显不同。其中胞外MK方面:在8~16 d即发酵前、中期时的MK产率增长显著,至16 d开始放缓,产率达极大值,发酵后期MK产率渐趋平稳并逐步下降,至发酵20 d,胞外MK达极值780 mg/L。胞外MK占比方面:在发酵的前、中期时其走势为随发酵时间的增加而递增,至16 d达极大值,此时胞外MK占比为86.71%,为对照组同期(35%)的2.48倍,此后随发酵时间的增加而呈下降趋势。实验组发酵至22 d,总MK达极值,其总MK、胞外MK、胞外MK占比分别为1 031、754 mg/L和73.13%,分别为对照组的11.85倍、20.38倍和1.72倍。可见发酵初始时(0 d)添加80 g/L乳糖醇能大幅提高紫色红曲菌TY02的MK产量与胞外MK占比,这与文献报道的红曲霉产黄色素的发酵相类似[19]。胞外MK占比的大幅提高,乳糖醇可能类似于甘油通过影响脂肪酸的组成从而增加细胞膜的通透性,进而有利于代谢产物外排[20-21]。
MK分为内酯型和酸型两种结构,在一定的条件下两者可以转换[22]。由图3-b可知,发酵液中开环MK占比随着乳糖醇浓度的增加,呈现快速递增趋势,至乳糖醇添加量为80 g/L时开始放缓,此时开环MK占比为98.56%,为对照实验开环MK占比25.33%的3.89倍,此后随着乳糖醇浓度的进一步提高,开环MK占比渐趋平稳,维持在98%~99%。这说明,乳糖醇能大幅提高紫色红曲菌TY02的开环MK的合成比例,从而使生产水溶性的高开环功能红曲MK成为可能[23]。
2.4 乳糖醇添加量对乳糖醇残留及桔青霉素代谢的影响
以1.2培养基中的发酵培养基为基本发酵培养基,在发酵初始时(0 d)分别添加0、20、40、60、80、100、120 g/L乳糖醇,按照1.3的方法进行培养,乳糖醇残留量、桔青霉素的质量浓度与乳糖醇添加量的关系如图4所示。
由图4-a可知,发酵结束后发酵液中乳糖醇的残留量随着培养基中添加的乳糖醇浓度的增加而增加,残留量变化范围为0.17~5.83 g/L,符合GB 2760—2014《食品安全国家标准 食品添加剂使用标准》。紫色红曲菌TY02对乳糖醇的利用率会随着培养基中乳糖醇浓度的增加而逐渐降低,利用率变化趋势为99.13%~95.14%。当添加乳糖醇质量浓度至80 g/L时,乳糖醇利用率明显下降,此时乳糖醇残留量为1.84 g/L,利用率为97.70%。实验表明,紫色红曲菌TY02能够适应高渗透压的培养基环境,在生长与MK代谢过程中能较充分地利用乳糖醇。此外因过高的乳糖醇浓度利于长菌而不利于产MK,同时会增加在发酵液中的残留量,给后处理及产品质量带来隐患,故选择乳糖醇的添加量为80 g/L较为合适,这与前面的实验结论一致。

a-乳糖醇残留量;b-桔青霉素质量浓度图4 乳糖醇添加量对乳糖醇残留量及桔青霉素含量的影响Fig.4 Effects of amount of lactitol additive on content of residual lactitol and citrinin after fermentation
由图4-b可知,发酵液中桔青霉素随着乳糖醇浓度的增加,其质量浓度由对照组的112 μg/kg呈快速递减趋势,两者呈负相关。当乳糖醇添加量增至80 g/L时,其含量仅为6 μg/kg,此后随着乳糖醇浓度的进一步提高,桔青霉素含量无法检出。实验表明,乳糖醇能抑制紫色红曲菌TY02合成桔青霉素的酶系。
2.5 添加乳糖醇条件下紫色红曲菌TY02发酵MK的收获时间
以1.2培养基中的发酵培养基为基本发酵培养基,在发酵开始时(0 d)添加80 g/L乳糖醇,按照1.3的方法进行培养,MK质量浓度、pH值、菌体DCW与发酵时间的关系如图5所示。
由图5-a可知,在发酵前期,pH不断上升,至12 d时至最高,此时pH值为6.95,此后略有下降,并渐趋平稳,维持在6.7左右至发酵结束。当pH<6.0时为菌体的生长期,pH>6.0时为MK的合成期,8~16 d为菌体合成MK的高峰期,16 d时MK合成开始放缓,此后MK合成渐趋平稳,至22 d时MK达极值1 031 mg/L。
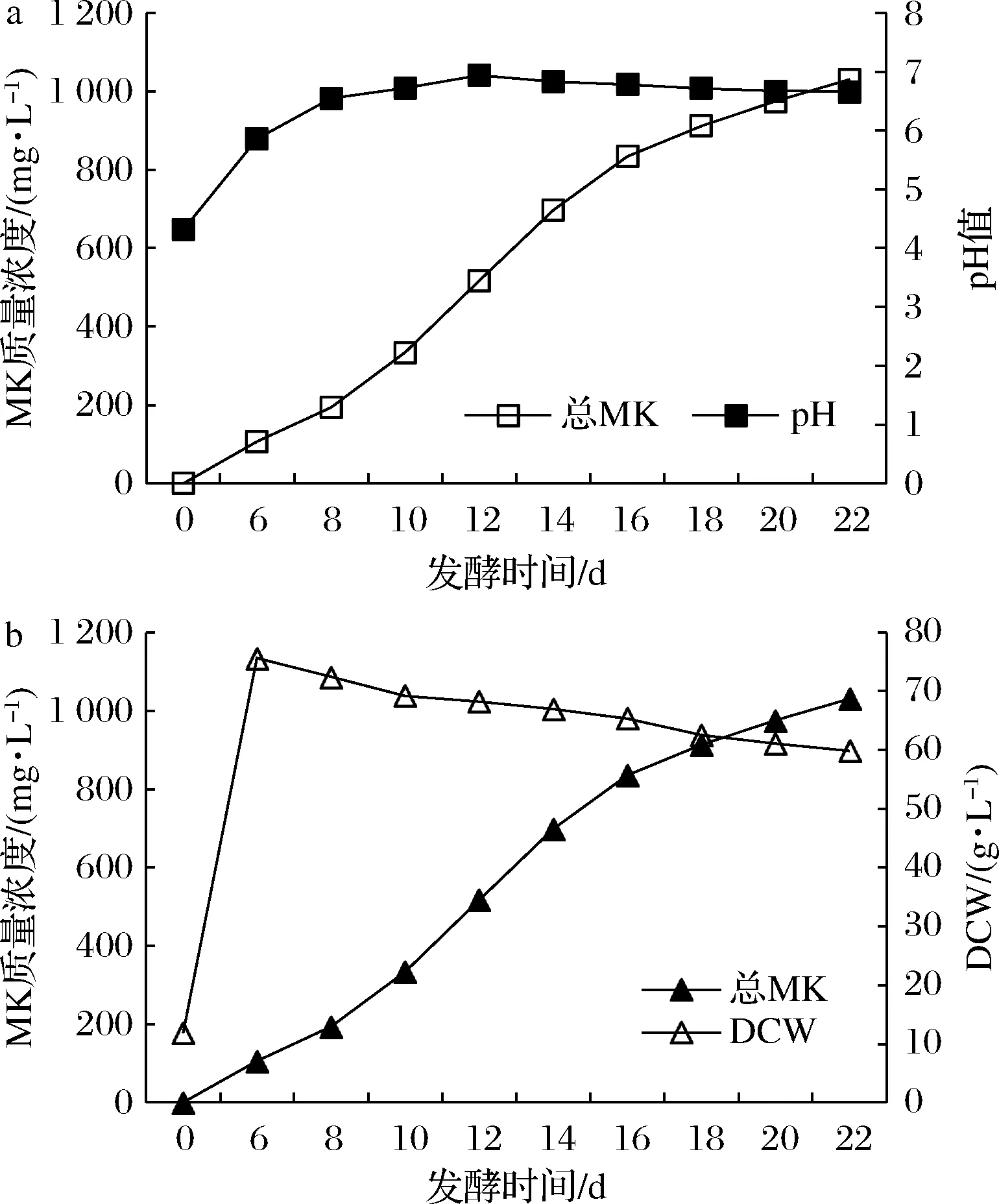
a-pH值与MK质量浓度;b-生物量DCW和MK质量浓度图5 发酵过程中MK质量浓度、pH值、菌体生物量DCW的变化Fig.5 Changes of MK yields,pH values and mycelial biomass DCW during the fermentation
由图5-b可知,在发酵前期,菌体快速增殖,至6 d时,DCW由初始的11.86 g/L快速增长至75.62 g/L,此后缓慢降低,至发酵结束降至59.87 g/L。当DCW从72.41 g/L降至65.33 g/L(8~16 d)期间为MK合成的高峰期,在DCW降至65.33 g/L时(16 d)MK合成开始放缓,此后MK合成渐趋平稳,至22 d时MK达最大值1 031 mg/L。从DCW与MK合成的关系图可知功能红曲液态发酵为典型的次级代谢,并且为高密度发酵。
3 结论
研究结果表明,乳糖醇对紫色红曲菌TY02的生长及MK代谢具有重大的影响。
研究发现该菌株在以黏米粉为碳源,在发酵初始时(0 d)添加80 g/L乳糖醇的高渗透压培养基中能够进行高密度发酵,菌体DCW可达75.62 g/L,能够高效合成高开环、高含量的MK,其中发酵液开环MK占比可达98%,总MK可达1 031 mg/L,从而突破了以不含甘油成分的淀粉质作为碳源、且符合QB/T 2847— 2007《国家轻工行业标准 功能性红曲米(粉)》与GB 2760—2014《食品安全国家标准 食品添加剂使用标准》的原料进行液态发酵低产MK的技术瓶颈,使生产水溶性的功能红曲制品成为可能。研究还发现,该菌株能高效利用乳糖醇作为碳源,在发酵初始时(0 d)添加80 g/L乳糖醇,发酵22 d,经检测发酵液中乳糖醇的残留量为1.84 g/L,符合GB 2760 —2014《食品安全国家标准 食品添加剂使用标准》,从而解决了乳糖醇残留量过高会引起腹泻的隐患;同时发现,乳糖醇不仅可作为碳源,还可调节紫色红曲菌TY02的MK代谢途径。乳糖醇能够抑制紫色红曲菌TY02合成桔青霉素的酶系,在发酵初始时(0 d)添加80 g/L乳糖醇,发酵22 d,经检测发酵液中桔青霉素的质量浓度由对照组的112 μg/kg降至6 μg/kg,符合QB/T 2847—2007《国家轻工行业标准 功能性红曲米(粉)》,从而保证了以后量产的产品质量安全。本研究成果对突破当前液态发酵功能红曲的技术瓶颈,进而实现量产,提供了理论参考和技术支持。受条件的限制,本研究未能采用实时荧光定量qPCR测定MK合成关键基因的表达量,对乳糖醇影响紫色红曲菌TY02产MK的机理未能进行充分的解析。因此,研究糖醇促进红曲菌产MK的机理将是今后工作的重点。

