异源表达黑芥子酶及其用于制备萝卜硫素的研究
黄河鸥,郑璞,吴丹,陈鹏程
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
黑芥子酶(myrosinase, MYR, EC 3.2.1.14 7)是一种糖苷水解酶,可以催化硫代葡萄糖苷生成一分子葡萄糖和一分子中间体糖苷配基,不稳定的糖苷配基自发重排生成异硫氰酸酯等物质[1]。黑芥子酶存在于植物、昆虫和微生物中[2-3],但在昆虫及微生物中均活性较低,目前主要来源为植物中提取[4],但该酶提取过程中容易受重金属离子危害,对压力等较为敏感[5],易被氧化还原,提取纯化困难。
萝卜硫素作为一种自然界存在的活性最强[6]的异硫氰酸酯类化合物,具有很强的抗氧化、防癌、抗癌活性,可以降低多种癌症的发病率[7-8]。自西兰花副产物[9]、西兰花[10]、西兰花种子[11]中提取得到萝卜硫素产量分别为151.39 μg/g、(408.74±0.83)μg/g DW、14.80 mg/g;以邻苯二甲酰亚胺钾盐[12]、三甲基硫丙醇[13]为原料合成萝卜硫素,收率分别为16.0%、4.4%。由于植物中存在上皮硫特异蛋白(epithiospecifier protein,ESP)会使中间体转化为萝卜硫腈等不具有生物活性的物质[14-15],提取转化率及产品纯度较低,提纯复杂。化学合成需要大量使用有机试剂,副产物多,且萝卜硫素存在手性原子[16],合成的萝卜硫素比天然萝卜硫素安全性低,功能减弱。
因此,高效表达异源黑芥子酶并对其应用开发具有重要意义。在大肠杆菌中诱导表达油菜来源黑芥子酶[17],浓缩后得到酶液,酶活力为3.1×10-3U/mg,拟南芥黑芥子酶在解脂耶氏酵母中表达后可使每1 g萝卜种子生成6.1 mg莱菔素[18]。本研究选用西兰花来源黑芥子酶BoTGG1[19]和甘蓝蚜虫来源黑芥子酶BMYR[20]进行异源表达,糖基化预测表明该酶具有糖基化位点,毕赤酵母(Pichiapastoris)表达外源基因具有一定的翻译后修饰能力,得到的蛋白质具有一定程度上的糖基化修饰作用,本文选择P.pastoris作为异源表达的宿主,诱导表达后得到具有活性的黑芥子酶粗酶液,并利用该粗酶液催化西兰花种子提取液合成萝卜硫素,为萝卜硫素的制备提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒及引物
大肠杆菌(Escherichiacoli)JM109、P.pastorisGS115、P.pastorisX33以及质粒pPIC9K、pPICZα均保藏于本实验室。西兰花来源黑芥子酶BoT-GG1、甘蓝蚜虫来源黑芥子酶BMYR、基因及所用引物皆于金唯智生物科技公司合成,如表1所示。

表1 本研究中所用引物序列Table 1 Primers used in this study
1.1.2 酶、试剂及培养基
PrimeSTAR HS DNA Polymerase、QuickCutSacI,TaKaRa公司;质粒DNA抽提试剂盒、DNA胶回收试剂盒、博莱霉素,北京索莱宝科技有限公司;基因、引物的合成以及测序由金唯智生物科技有限公司完成;SDS-PAGE凝胶快速配制试剂盒,碧云天生物技术有限公司;标准品萝卜硫苷(纯度≥ 98%)、萝卜硫素(纯度≥ 95%),上海源叶生物科技有限公司。所用培养基为LB、MD、YPD、BMGY、BMMY及BSM培养基。
1.1.3 仪器与设备
台式高速冷冻离心机,上海卢湘仪仪器有限公司;PCR仪,德国Eppendorf公司;高效液相色谱,美国Waters公司;Amethst C18-H反向柱(4.6 mm×250 mm,5 μm),美国赛分科技有限公司;生物传感分析仪,西尔曼科技有限公司。
1.2 实验方法
1.2.1 表达载体的构建
以BoTGG1-F/R为引物扩增出目的基因botgg1基因片段,以BOTGG1-9K-F/R为引物扩增出载体pPIC9K片段,通过琼脂糖凝胶电泳验证PCR产物,并使用胶回收试剂盒分别回收botgg1基因片段和pPIC9K载体片段。通过一步克隆试剂盒将回收的片段和载体按照2∶1的摩尔比,在37 ℃下反应30 min连接。以同样的方法分别连接bmyr基因片段和pPIC9K载体片段,bmyr基因片段和pPICZα载体片段。以上连接产物均热激法转化至大肠杆菌E.coliJM109感受态细胞中,37 ℃孵育30 min后涂布在对应抗性平板上,获得的转化子进行菌落PCR验证,对筛选得到的阳性转化子扩增,并提取质粒测序。
1.2.2 重组毕赤酵母的构建
将测序验证正确质粒pPIC9K-BoTGG1、pPIC9K-BMYR和pPICZα-BMYR均用SacI线性化,PCR产物纯化试剂盒纯化回收后,分别电转法转入毕赤酵母P.pastorisGS115感受态中,同时质粒pPICZα-BMYR还转入毕赤酵母P.pastorisX33感受态中。于30 ℃孵育2 h后涂布于MD平板,30 ℃培养2~3 d后,逐步挑取单菌落于含有0.5、1、2、4 mg/mL相应抗性的平板上进行抗性筛选,得到重组菌株P.pastorisGS115/pPIC9K-BoTGG1、P.pastorisGS115/pPIC9K-BMYR、P.pastorisGS115/pPICZα-BMYR和P.pastorisX33/pPICZα-BMYR。
1.2.3 培养方法
摇瓶培养:将重组毕赤酵母工程菌株接种到30 mL BMGY培养基中,30 ℃、220 r/min培养24 h,然后4 ℃、5 000 r/min离心5 min,除去上清液后收集菌体,菌体用30 mL BMMY诱导培养基重悬后于28 ℃、220 r/min培养96 h,每24 h添加1次终体积分数为1%的甲醇进行诱导。培养结束后离心并保留上清液,为黑芥子酶粗酶液。
发酵罐培养:挑取单菌落接种于100 mL YPD培养基中,30 ℃、220 r/min培养24 h左右直至OD600值为13,接种至900 mL BSM发酵培养基中。设置温度为30 ℃、pH为5,通气量2 L/min,初始转速400 r/min并设置溶氧关联搅拌,控制溶氧为20%,最高转速为800 r/min。当发酵约20 h时,培养基中甘油耗尽,溶氧值(dissolved oxygen,DO)下降为0左右又回升时,进入甘油补料阶段开始补加50%甘油(4.92 mL/L PTM1)。甘油补料培养至OD600值为120左右时停止,并饥饿培养1 h,DO上升后,根据菌株生长情况及DO补加含12 mL/L PTM1的甲醇,温度设置为25 ℃ 进行诱导培养,每隔12 h取样,诱导至OD600值不再显著增加后停止发酵。
1.2.4 萝卜硫素的合成及酶活力测定
称取1 g西兰花种子清洗后于110 ℃烘箱中30 min使内源酶失活,研磨粉碎后加入10 mL去离子水,在80 ℃、150 r/min水浴摇床中反应2 h,8 000 r/min离心2 min,并用0.22 μm滤头过滤得到西兰花种子提取液,即5 g/L萝卜硫苷溶液。取40 μL黑芥子酶粗酶液与一定量的西兰花种子提取液混合,37 ℃反应30 min后利用HCl调节pH至2~3终止反应,高效液相色谱测定产物萝卜硫素浓度。
以萝卜硫苷(10 mg/mL)为底物,在pH 5.5,37 ℃ 的条件下反应30 min,煮沸5 min终止反应,通过生物传感分析仪测定生成葡萄糖量,计算酶活力。每分钟催化生成1 μmol葡萄糖所需要的酶量,定义为1个活力单位(U)。
1.2.5 催化条件优化
进行单因素试验优化制备萝卜硫素条件。取40 μL黑芥子酶粗酶液分别与40、80、120、160 μL的西兰花种子提取液混合,并添加去离子水至200 μL,于 37 ℃ 反应30 min,选取产物浓度最高时的底物浓度作为催化反应底物浓度。确定催化反应底物浓度后,利用相应催化体系在37 ℃分别反应10、20、30、40、50、60、70、80 min,测定产物浓度,确定产物浓度最高时时间作为催化反应时间。在确定的催化底物浓度及催化时间下,分别在pH值为3.5、4.5、5.5、6.5、7.5、8.5条件下反应,选取产物浓度最高时作为催化反应pH。在确定的催化底物浓度、时间及pH条件下,分别于20、30、37、45、50、60、70、80 ℃下进行催化反应,选取产物浓度最高时温度作为催化反应温度。
1.2.6 萝卜硫素的定量检测
采用高效液相色谱法进行萝卜硫素的定量检测。
检测条件:色谱柱为Amethyst C18-H(4.6 mm×250 mm,5 μm)反相色谱柱,检测波长205 nm,柱温30 ℃,流动相为V(乙腈)∶V(超纯水)=20∶80,进样量为10 μL,流速1 mL/min。
2 结果与分析
2.1 黑芥子酶重组菌株的构建
以bmyr、botgg1基因为模板,进行目的片段的扩增得到相应的PCR产物,并经过琼脂糖凝胶电泳验证其大小。目的基因bmyr、botgg1大小分别为1 404、1 647 bp(图1-a)。将各片段使用无缝克隆试剂盒连接后,将获得的重组质粒导入到E.coliJM109的感受态中,涂布于含相应抗性的平板,将转化子菌落PCR验证(图1-b),得到阳性转化子。挑取阳性转化子培养,并提取重组质粒进行测序验证,测序正确,质粒pPIC9K-BoTGG1、pPIC9K-BMYR和pPICZα-BMYR构建成功。将构建好的质粒转入毕赤酵母感受态中,获得重组菌株P.pastorisGS115/pPIC9K-BoTGG1、P.pas-torisGS115/pPIC9K-BMYR、P.pastorisGS115/pPICZα- BMYR和P.pastorisX33/pPICZα-BMYR。
2.2 黑芥子酶重组菌发酵特性评价
对重组菌株进行摇瓶发酵,各个菌株OD600值随着诱导时间的延长而增大,菌株生长情况良好。诱导96 h后生长状况最好菌株为X33/pPICZα-BMYR,OD600值为70.9(图2-a),蛋白质量浓度为0.15 g/L(图2-b),明显高于其余菌株,黑芥子酶在毕赤酵母中良好表达。酶活力测定(图2-c)表明,GS115/pPIC9K-BoTGG1粗酶液酶活力最低,菌株GS115/pPICZα-BMYR酶活力高于GS115/pPIC9K-BMYR,相比质粒pPIC9K,质粒pPICZα似乎更有利于黑芥子酶的表达;菌株X33/pPICZα-BMYR粗酶液酶活力可达0.083 U/mL,毕赤酵母X33比GS115更有利于黑芥子酶的生产。利用各粗酶液进行催化反应后测定得到萝卜硫素浓度(图2-d),所得结果与酶活力结果相符,菌株X33/pPICZα-BMYR所产酶催化后得到萝卜硫素浓度最高。鉴于以上结果,重组表达菌株X33/pPICZα-BMYR各项性能均优于其余菌株,故后续研究该菌株发酵产重组黑芥子酶的情况。
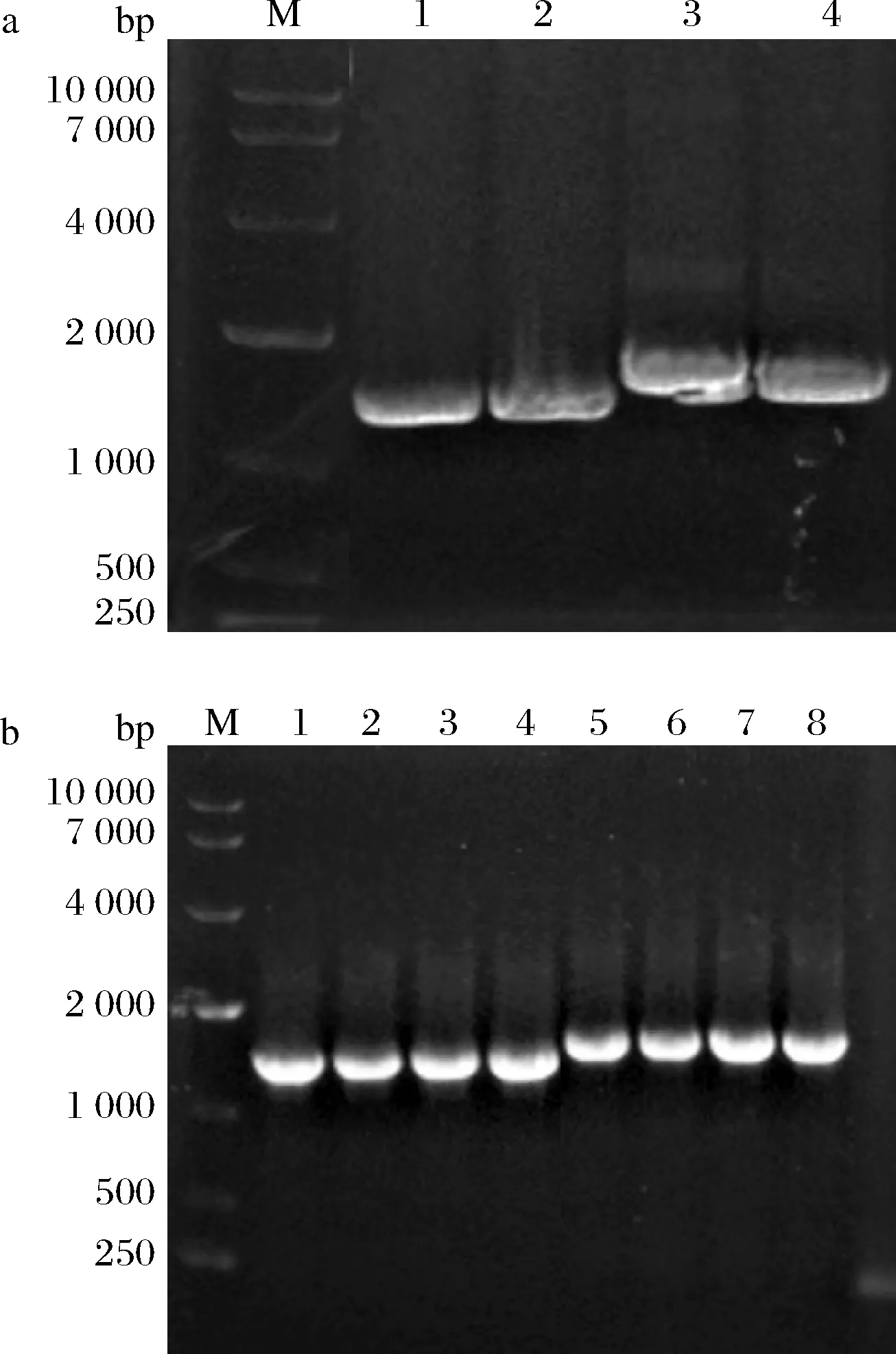
a-PCR扩增电泳图(M-DNA marker;1、2-目的基因bmyr 的PCR产物;3、4-目的基因botgg1的PCR产物);b-转化子的PCR鉴定结果(M-DNA marker;1~4-阳性转化子中BMYR的PCR产物;5~8-阳性转化子中BoTGG1的PCR产物)图1 PCR扩增和转化子的PCR鉴定结果电泳图Fig.1 Agarose gel electrophoresis of PCR amplification and identification of transformant
2.3 3 L发酵罐高密度培养
菌株X33/pPICZα-BMYR的高密度发酵培养过程在3 L发酵罐中进行,培养19.4 h至培养基中甘油完全消耗,发酵罐中DO值下降至将近为0后迅速回升,达到78%,此时OD600值为80,开始进行甘油补料培养,以增加生物细胞量。培养至OD600值达到120时,停止补加甘油并饥饿培养1 h,开始甲醇补料培养诱导产酶。在诱导过程中菌体生长良好,甲醇诱导120 h时,OD600值达到545且不再增加(图3-a)。黑芥子酶BMYR理论分子质量为53.7 kDa,将发酵过程所取样品进行SDS-PAGE分析,由于在毕赤酵母中表达时发生糖基化反应,所以结果显示在约63 kDa处有明显条带(图3-b),即为黑芥子酶表达蛋白。随着诱导时间的延长,此条带愈发明显,酶活力也逐渐增大,诱导120 h时,酶活力为0.64 U/mL,是摇瓶水平的8倍。通过发酵罐补料分批发酵,使得菌株生长旺盛,酶活力得到提升。
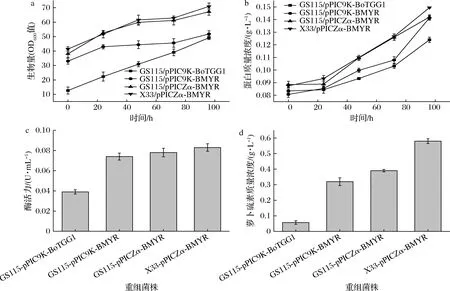
a-生物量;b-蛋白质量浓度;c-酶活力;d-萝卜硫素质量浓度图2 重组菌摇瓶发酵性能Fig.2 Fermentation performance of recombinant strains in shaking flasks
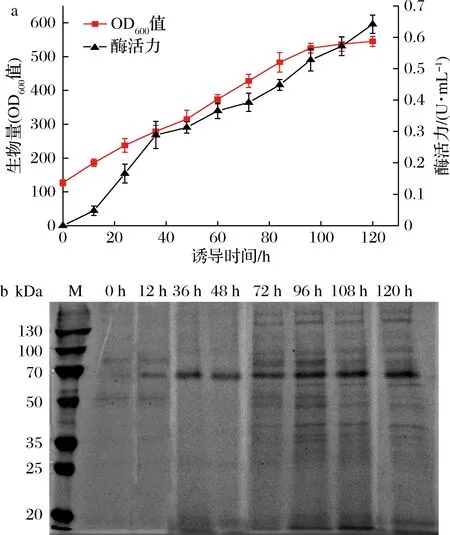
a-发酵过程中酶活力和细胞OD600值曲线图;b-不同时间发酵上清液SDS-PAGE图图3 重组菌在3 L发酵罐中高密度发酵过程Fig.3 Time course of recombinant P.pastoris high-cell density fermented in a 3 L fermenter
2.4 重组酶BMYR制备萝卜硫素
底物浓度对催化反应进行有重要影响,底物浓度过低反应易达到饱和造成酶的浪费,底物浓度过高可能产生抑制作用且造成底物浪费。于底物质量浓度1~4 g/L进行催化反应(图4-a),产物浓度先是随着底物浓度的增大而增大,当底物质量浓度为1 g/L时产物质量浓度为0.41 g/L,此时底物全部转化为产物,反应达到饱和,当底物质量浓度为3 g/L时产物浓度最高,此时产物质量浓度为0.55 g/L,底物质量浓度继续增加至4 g/L后产物浓度反而下降,此时黑芥子酶可能受到底物抑制作用,MAHN等[21]也曾在西兰花来源黑芥子酶中发现这种抑制作用。故选择3 g/L作为催化反应中底物质量浓度。
催化时间对生成产物的浓度有直接的影响,时间过短反应未完全,时间过长时,由于产物萝卜硫素不稳定,反而降低产物浓度。分别在10~80 min进行催化反应(图4-b),产物浓度随着反应时间的延长而增加,当催化时间为60 min时,产物质量浓度为1.15 g/L,此时底物萝卜硫苷的摩尔转化率为94.7%,之后产物浓度增加趋势变缓几乎不再增加,故选取催化反应时间为60 min。
不同的酶在不同的pH条件下催化效率不同,分别考察黑芥子酶在不同缓冲液,pH在3.5~8.5时的催化效率(图4-c)。在pH为4.5时反应,催化得到的产物浓度最高,萝卜硫素含量为1.13 g/L,之后随着pH的上升,生成萝卜硫素浓度逐渐下降,萝卜硫素在酸性条件下更稳定。同时在相同pH的不同缓冲液中,催化后得到产物浓度也不同,这种不同是缓冲液中的不同成分与金属离子等的结合造成。
反应温度可以直接影响酶的反应,在一定温度范围内,升高温度可以提高酶的反应速率,但同时高温可能会使产物萝卜硫素降解。分别测定反应温度在20~80 ℃时产物浓度(图4-d)。随着反应温度的升高,产物萝卜硫素的浓度先上升,在反应温度为45 ℃ 时,产物质量浓度最高,达到1.21 g/L,此时底物萝卜硫苷的摩尔转化率为99.6%,之后随着温度的上升,产物浓度开始下降,高温容易使萝卜硫素降解且加快了酶活力的衰减速度。当催化温度为60 ℃时,产物质量浓度为1.11 g/L,是45 ℃时的91.7%,催化温度继续上升后产物浓度开始急剧下降,温度为80 ℃时,萝卜硫素质量浓度为0.16 g/L,仅为最高浓度的13.2%。在45 ℃时得到最高产物浓度,因此选取45 ℃作为催化反应温度。
综上结果,重组酶产萝卜硫素的反应条件为底物质量浓度3 g/L、反应时间60 min、反应pH 4.5、反应温度45 ℃。在此条件下,可生成萝卜硫素1.21 g/L,即每1 g西兰花种子可生成萝卜硫素20.2 mg。添加外源黑芥子酶可以显著提高西兰花种子中萝卜硫素的产量[7],但目前此类研究相对较少,而对西兰花内源酶生成萝卜硫素的反应参数进行优化,得到萝卜硫素的最大产量为每1 g西兰花种子可生成萝卜硫素14.8 mg[11]。相比而言,由重组菌株X33/pPICZα- BMYR所得到的黑芥子酶能够有效水解西兰花种子中的萝卜硫苷生成萝卜硫素,在萝卜硫素的大规模制备中显示出应用潜力。
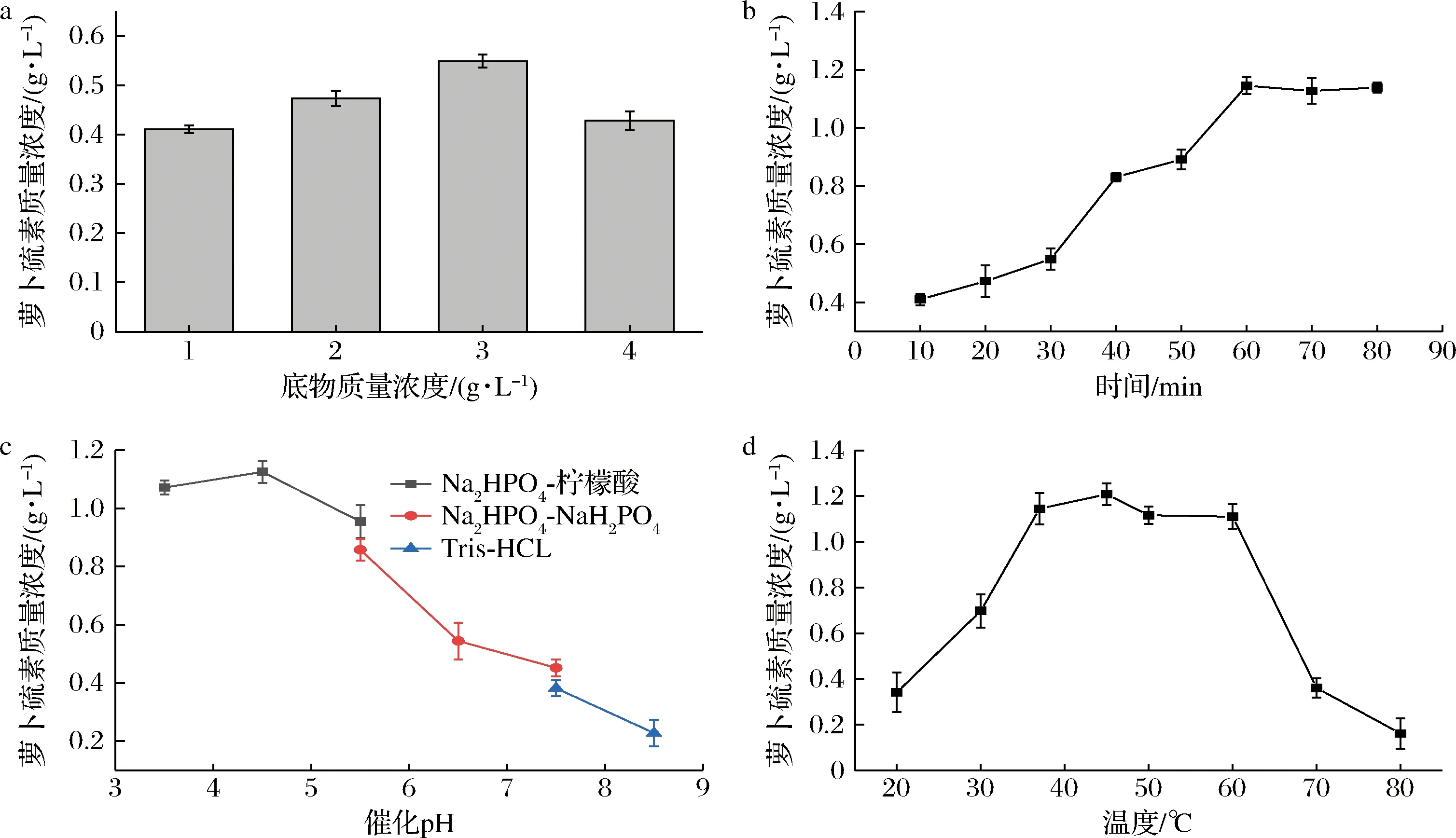
a-底物质量浓度;b-催化时间;c-催化pH;d-催化温度图4 反应条件对萝卜硫素制备的影响Fig.4 Effects of reaction conditions on the preparation of sulforaphane
3 结论
本研究首次将来源于西兰花的黑芥子酶基因bot-gg1及甘蓝蚜虫的黑芥子酶基因bmyr在毕赤酵母中异源整合表达,成功获得可生产具有活性黑芥子酶粗酶液的菌株。结果表明,载体pPICZα、宿主毕赤酵母X33表达BMYR更适用于黑芥子酶的生产。重组菌X33/pPICZα-BMYR在3 L发酵罐上进行高密度发酵,诱导表达120 h后酶活力为0.64 U/mL,是摇瓶酶活力的8倍。以西兰花种子提取液为底物,进行催化条件优化后,生成萝卜硫素达到1.21 g/L,萝卜硫苷的摩尔转化率达到99.6%,即每1 g西兰花种子可生成萝卜硫素20.2 mg,是目前萝卜硫素制备的最高水平。本研究一方面探索不同来源黑芥子酶异源表达的可能性,一方面利用所得到黑芥子酶进行催化反应,成功提高萝卜硫素的产量,因此可为黑芥子酶的生产及萝卜硫素的制备提供参考。

