Th2CysPrx基因提高酿酒酵母多种胁迫耐受性研究
王媛媛,刘百超,姜 波,王丹妮,高彩球
(东北林业大学,林木遗传育种国家重点实验室,黑龙江 哈尔滨 150040)
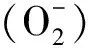
Prxs是一类广泛存在于生物体内的酶,它们可以通过还原过氧化物保护细胞免受氧化损伤[3]。自1988年首先在酿酒酵母中发现Prxs酶后[4],陆续在细菌、动物、植物中被发现并进行一系列研究[5-7]。植物中Prxs主要分为4类:1CysPrx、2CysPrx、PrxQ和Ⅱ型Prx(PrxIIB/C/E/F),其中,2CysPrxs是一种基质蛋白,其C端与N端均有一个保守的半胱氨酸残基,并以同型二聚体形式存在,具有信号传导、生理代谢、分子伴侣及非生物胁迫耐受等功能[8]。在本氏烟草(Nicotianabenthamiana)中,2CysPrx通过再生抗坏血酸影响脱落酸(ABA)生物合成,进而影响ABA信号传导,在ABA生物合成以及光合作用的保护中具有直接作用[9]。将小球藻(Chlorellapyrenoidesa)2-CysPrx基因,转入酵母中单独或协同表达时,能显著提高酵母对冷冻、高温、甲萘醌诱导的氧化应激胁迫的耐受性[10]。在H2O2、高温、甲基紫精等非生物逆境胁迫条件下超表达拟南芥At2-CysPrx基因能显著提高马铃薯(Solanumtuberosum)对非生物逆境胁迫的耐受性[11]。2013年张会慧等[12]研究发现,过表达烟草2-CysPrx基因能降低盐胁迫和高光作用下转基因烟草植株的氧化损伤,抑制抗坏血酸过氧化物酶活性,有效清除细胞中过量H2O2,提高光合电子传递链稳定性,降低PSⅡ光抑制程度。
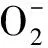
为了分析Th2CysPrx基因是否还参与其他多种非生物胁迫,本研究将Th2CysPrx基因构建到pYES2酵母表达载体上,转入INVSC1酿酒酵母中,通过比较多种非生物胁迫下酵母细胞生长和活性,探究Th2CysPrx基因是否能提高植物对多种非生物胁迫的耐受能力。
1 材料与方法
1.1 菌种和载体
酿酒酵母(Saccharomycescerevisiae)INVSCl菌株和pYES2载体为东北林业大学林木遗传育种国家重点实验室保存。
1.2 试验方法
1.2.1Th2CysPrx基因酵母表达载体构建
根据Th2CysPrx基因全长序列设计酵母表达载体引物(pYES2-Th2CysPrx-F和pYES2-Th2CysPrx-R),上游引物为5′-ATGGGGTACCATGGCGTGCGCAGCCCCAACT-3′;下游引物为5′-ATGCTCTAGATTAAATTGCAGCGAAGTACTC-3′(下划线为KpnI和XbaI酶切位点序列)。以刚毛柽柳cDNA为模板,PCR克隆带有酶切位点的Th2CysPrx基因。PCR反应程序:94 ℃ 5 min预变性;94 ℃ 30 s变性;58 ℃ 30 s退火;72 ℃ 1 min延伸,30个循环,72 ℃延伸10 min。用凝胶回收试剂盒回收PCR扩增产物。利用KpnI和XbaI 在37 ℃双酶切目的基因和pYES2载体质粒,T4DNA连接酶16 ℃过夜连接。转化到大肠杆菌(Escherichiacoli)感受态Top10,随机挑取单克隆经检验后送生工生物工程(上海)股份有限公司测序。将测序正确的重组质粒命名为pYES2-Th2CysPrx。
1.2.2 pYES2-Th2CysPrx酵母细胞转化与鉴定
采用醋酸锂法将pYES2-Th2CysPrx质粒转化到酿酒酵母菌株INVSC1中,同时将空pYES2载体转入INVSC1作为阴性对照,二者分别标记为INVSC1(pYES2-Th2CysPrx)和INVSC1(pYES2)。挑取转化后的单克隆于SC-U液体培养基中过夜培养,4 000 r/min离心10 min,液氮速冻并研钵研磨进行PCR检测。选择含有目的条带的单克隆用于后续实验。
1.2.3Th2CysPrx基因酵母细胞抗逆性分析
分别挑取INVSC1(pYES2-Th2CysPrx)和INVSC1(pYES2)接种于SC-U液体培养基,30 ℃振荡培养24 h后测定OD600值,将菌液重悬于诱导培养基(SC-U+质量分数20%β-半乳糖)中使菌体OD600为0.4,30 ℃诱导表达24 h后测定OD600值,重悬使1 mL体积中菌体OD600值为2,在9 000 r/min条件下离心1 min,弃上清液。将菌体重悬于1 mL分别含有5 mol/L NaCl、3 mol/L KCl或0.01%(质量分数)LiCl溶液中,4 ℃振荡24 h;或0.01%(质量分数)LiCl、0.01%(质量分数)CdCl2、0.001%(体积分数)H2O2、2 mol/L山梨糖醇或6%(质量分数)NaHCO3,30 ℃振荡1 h;或重悬SC-U液体溶液中并于-20 ℃冷冻24 h,或52 ℃培养0.5 h。稀释100、1 000、10 000、100 000倍接种于SC-U固体培养基。30 ℃培养2~4 d,观察菌落存活率。
为进一步定量分析,将1 mL上述处理OD600为2的菌体重悬于5 mL培养液中,在SC-U液体培养基中分别加入终浓度1、2、3、4或5 mol/L NaCl,0.1、0.5、1.0、2.0、3.0 mol/L KCl,质量分数为0.001%、0.003%、0.005%、0.007%、0.010%LiCl,质量分数为0.001%、0.003%、0.005%、0.007%、0.010%CdCl2,体积分数为0.000 1%、0.000 3%、0.000 5%、0.000 7%、0.001 0%H2O2,0.1、0.5、1.0、1.5、2.0 mol/L山梨醇,或质量分数为1.2%、2.4%、3.6%、4.8%、6.0% NaHCO3进行培养。冷胁迫处理为,在-20 ℃放置3、6、9、12或24 h后于30 ℃下培养9 h;热胁迫处理为,在36、40、44、48或52 ℃水浴1 h后置于30 ℃培养箱培养12 h。测定各种非生物胁迫下的OD值,以此表征菌落存活率。
每组实验重复3次。实验结果用SPSS 18.0软件进行方差分析。误差棒代表标准误差,采用平均数±标准误差表示。当P<0.05时认为显著差异。
2 结果与分析
2.1 重组酵母INVSC1鉴定
以随机挑选的3个已转化重组质粒(pYES2-Th2CysPrx)的酵母单菌落总DNA为模板,用特异引物(pYES2-Th2CysPrx-F和pYES2-Th2CysPrx-R)进行PCR检测,结果如图1所示。可知:扩增片段与预期长度一致为825 bp,证明重组质粒(pYES2-Th2CysPrx)已成功转入酵母菌株INVSC1,成功获得酵母重组子INVSC1(pYES2-Th2CysPrx)。
2.2 Th2CysPrx基因对酵母多种胁迫的耐受性的影响
为了分析Th2CysPrx基因的功能,比较正常和各种胁迫条件下INVSC1(pYES2-Th2CysPrx)和INVSC1(pYES2)的生长和存活率差异。酵母细胞生长状况见图2可知:在正常条件下,pYES2和pYES2-Th2CysPrx转化酵母生长无显著差异。表明外源Th2CysPrx基因的表达不影响INVSC1的生长。而胁迫后,INVSC1(pYES2-Th2CysPrx)和INVSC1(pYES2)的生长和存活表型各不相同。
2.2.1Th2CysPrx基因对酵母盐胁迫耐受性的影响
INVSC1(pYES2-Th2CysPrx)和INVSC1(pYES2)分别暴露于NaCl、KCl、LiCl或NaHCO3等4种中性或碱性盐胁迫条件下的生长结果见图3。由图3可知,在大多数盐胁迫下,INVSC1(pYES2-Th2CysPrx)存活率明显高于NVSC1(pYES2)。为了定量地分析盐胁迫下INVSC1(pYES2-Th2CysPrx)和INVSC1(pYES2)生长差异,对4种盐不同浓度胁迫后的菌落存活率(以OD600表征)进行了测定,发现5种浓度的NaCl胁迫下,pYES2-Th2CysPrx转化酵母的存活率均显著高于pYES2。其中,在3 mol/L NaCl胁迫下,pYES2-Th2CysPrx酵母细胞浓度是pYES2的2.08倍。在NaHCO3的大部分胁迫浓度下,pYES2-Th2CysPrx转化酵母的存活率也明显提高;而在KCl和LiCl胁迫下,pYES2和pYES2-Th2CysPrx转化酵母的存活率几乎都无显著差异(除0.01%LiCl胁迫)(图3)。这表明过表达Th2CysPrx基因能提高酵母细胞对NaCl和NaHCO3胁迫的耐受性,而对KCl和LiCl胁迫的耐受性提高不明显。NaCl、KCl和LiCl 3种盐都含有Cl-,因此可以排除Cl-的影响,其可能是Th2CysPrx基因对中性和碱性Na盐胁迫的耐受效果更明显,而另外两种盐离子(K+和Li+)胁迫的应答不明显。
2.2.2Th2CysPrx基因对酵母渗透胁迫耐受性的影响
INVSC1(pYES2-Th2CysPrx)和INVSC1(pYES2)分别暴露于渗透胁迫条件下的生长和OD值测定结果见图4。
由图4可知:在渗透胁迫下,INVSC1(pYES2-Th2CysPrx)的存活率明显高于INVSC1(pYES2)。当山梨醇胁迫浓度达到0.5 mol/L时,pYES2和pYES2-Th2CysPrx转化酵母生长差异显著;随着渗透胁迫浓度的增加,pYES2-Th2CysPrx与pYES2转化酵母细胞浓度比值也主要呈升高趋势,分别为pYES2转化酵母细胞的1.03、1.07、1.30、1.29和2.06倍。这表明高浓度山梨醇胁迫时,Th2CysPrx基因的过表达有效提高了酵母的渗透胁迫耐受性。
2.2.3Th2CysPrx基因对酵母极端温度耐受性的影响
INVSC1(pYES2-Th2CysPrx)和INVSC1(pYES2)分别暴露于极端温度(高温和低温)条件下的生长和存活率结果见图5。由图5可知:在低温胁迫下,两组酵母细胞无明显差异。但当酵母细胞受到44 ℃以上高温胁迫时,INVSC1(pYES2-Th2CysPrx)酵母细胞存活率显著高于INVSC1(pYES2)。表明Th2CysPrx基因对酵母细胞的高温胁迫具有一定的耐受性。
2.2.4Th2CysPrx基因对酵母抗氧化胁迫耐受性的影响
INVSC1(pYES2-Th2CysPrx)和INVSC1(pYES2)分别暴露于H2O2胁迫下的生长和OD值测定结果见图6。在H2O2氧化胁迫下,INVSC1(pYES2-Th2CysPrx)存活率显著高于对照,且随着H2O2浓度升高,两种转化酵母细胞的差异越显著。当0.003% H2O2胁迫下,pYES2-Th2CysPrx酵母细胞浓度是pYES2的1.17倍。当0.005% H2O2胁迫下,pYES2-Th2CysPrx酵母细胞浓度是pYES2的1.52倍。表明过表达Th2CysPrx基因显著提高了酵母细胞氧化胁迫耐受性。
2.2.5Th2CysPrx基因对酵母重金属胁迫耐受性的影响
INVSC1(pYES2-Th2CysPrx)和INVSC1(pYES2)分别暴露于质量分数≤0.007%CdCl2胁迫下时,pYES2-Th2CysPrx存活率显著高于pYES2(图7)。尤其是在0.005 % CdCl2胁迫下,pYES2-Th2CysPrx酵母细胞浓度与pYES2差异最大,达到pYES2酵母细胞的1.36倍。由此可见,过表达Th2CysPrx基因显著提高了重组酵母对低浓度Cd2+胁迫(质量分数≤0.007%)的耐受性。
3 讨 论
过氧化还原蛋白是生物体调节体内氧化还原系统的一种重要蛋白质,在植物生长代谢中起重要作用;也与多种非生物胁迫相关,能够催化H2O2的还原,有效清除植物内ROS,调节细胞内抗氧化防御系统,进而控制基因转录和细胞信号传导。前期研究发现Th2CysPrx与盐胁迫相关,本研究中在NaCl胁迫下转基因酵母存活率实验进一步证实了该结果,同时进一步探究了Th2CysPrx是否还参与其他一些与活性氧相关的非生物胁迫应答,以鉴定Th2CysPrx基因的抗逆功能。具体参考酵母细胞中与多种非生物胁迫相关基因功能研究的方法[20],探究了Th2CysPrx在KCl、LiCl和NaHCO3等其他盐胁迫条件下的胁迫耐受性,以及Th2CysPrx在渗透胁迫、极端温度、氧化胁迫和重金属胁迫等多种非生物胁迫下的功能。
Th2CysPrx基因具有过氧化物酶、分子伴侣、氧化酶、细胞信号调节器等功能。同时生物体内,植物为清除自身代谢以及逆境中产生的过量ROS,进化出一套较为复杂的抗氧化防御系统,主要由低分子量的抗氧化酶组成,这些酶协同合作共同清除ROS,从而使细胞免受伤害[21-22]。例如非生物胁迫条件下,超表达2-CysPrx基因提高了糙皮侧耳抗高浓度H2O2、抗高温和抗高渗透压的能力,而2-CysPrx基因沉默导致H2O2大量积累,降低对非生物逆境胁迫敏感性。2-CysPrx基因表达情况与生物体ROS的清除能力呈正相关,2-CysPrx基因可能是胁迫应答信号转导途径的调节器[23-24]。在高羊茅(Festucaarundinacea)中转入拟南芥2-CysPrx基因结果显示,超表达Th2CysPrx可以有效清除细胞内ROS,进而提高高羊茅对高温胁迫和甲基紫精的胁迫耐受性[25]。因此,笔者推测Th2CysPrx基因是否也是通过清除胁迫后体内代谢产生的大量ROS,从而在酵母细胞抵抗多种非生物胁迫耐受性中行使功能。
在酿酒酵母中发现与Th2CysPrx基因具有51.32%同源性的yPrxII基因的位点特异性诱变通过增强其分子伴侣或过氧化物酶功能来改善热和氧化应激耐受性[26]。与Th2CysPrx基因具有50.26%同源性的Tsa1p基因具有抗氧化和过早衰老的特性[27]。Th2CysPrx基因在两种酵母同源基因突变体(TSA-B7和yPrxII基因的突变体)中表达是否会影响重组酵母的抗逆功能有待进一步研究。
H2O2对细胞的作用存在一个剂量效应和时间效应关系,高剂量会损伤细胞导致细胞凋零,低剂量会作为胁迫信号对细胞有保护作用。例如0.5 mmol/L的H2O2可促进贮存2年的水稻种子萌发,提高种子发芽率、发芽势、发芽指数、活力指数,提高水稻根系活力和叶绿素含量,促进水稻根和幼芽的生长。但是5 mmol/L的H2O2却不利于水稻种子萌发、根系和幼芽的生长[28]。本实验中,在NaCl、LiCl的胁迫下,过表达Th2CysPrx显示出更高的细胞存活率,但在H2O2胁迫下细胞却没有显示出更好的生长。笔者推测这可能与H2O2浓度有关,可能是外源施加的H2O2量过高,导致酵母细胞受损甚至凋亡。进而推测,在NaCl、LiCl胁迫中,过表达Th2CysPrx基因,除受到H2O2胁迫外,还可能存在离子胁迫和渗透胁迫,也可能存在其他作用机制。Th2CysPrx基因在柽柳非生物胁迫下的耐受机理将继续探究。

