八仙花萼片有色原生质体游离及应用
张盖天,祁惠,杨锁宁,褚志云,袁素霞,刘春
(中国农业科学院蔬菜花卉研究所,北京 100081)
八仙花(Hydrangea macrophylla)又名绣球花,为虎耳草科八仙花属植物,观赏部位为大部分不孕花及其萼片组成的伞状顶生花序[1],原产于中国、日本等国家[2-3]。八仙花品种众多、花色丰富、花型繁多,在欧美地区被广泛应用于庭院绿化、切花等。近年来,八仙花盆栽、切花和干花也受到越来越多中国消费者的喜爱。
八仙花具有特殊的栽培学特性,即在合适的土壤pH条件下,部分品种施铝处理后花萼片颜色会由原本的粉色变为蓝色[4],因此,八仙花花色变化机理逐渐成为研究热点。八仙花萼片有色细胞主要集中于花萼片上表皮下部和叶肉细胞上部的组织中[5],为方便对有色细胞独有的生理与分子特性进行深入研究,揭示花器官有色细胞中特有的膜结构、蛋白结构及功能[6-10],需将组织中的有色细胞与无色细胞有效分离,因此,必需建立八仙花萼片有色原生质体游离体系。原生质体是细胞除去细胞壁后所得的由膜包裹的结构,包括膜结构、液泡、细胞核、质体及线粒体等,其中,液泡是植物储藏色素类物质的器官,成熟细胞的液泡体积约占细胞体积的90%[11],即在显微镜下观察到的有色细胞液泡内含有色素类物质,而无色细胞液泡内不含色素类物质。
原生质体用途广泛,主要用于瞬时表达,如亚细胞定位[12]、原生质体融合[13]等,其游离受诸多因素影响,主要包括植物组织材料类型[14]、预处理方式[12]、酶浓度及配比[15]、渗透压[16]、酶解时间[17]和离心力[18]等。目前,在拟南芥(Arabidopsisthaliana)[19]和水稻(Oryza sativa)[20]中已建立了成熟的原生质体游离体系。而关于八仙花有色原生质体游离体系的研究尚未见报道,极大地限制了八仙花花色形成机理的相关研究。因此,本研究拟建立高效的八仙花有色细胞原生质体游离体系,并应用于不同品种八仙花萼片的原生质体游离,以期为后续八仙花有色细胞瞬时转化相关研究、细胞水平上的生理生化研究以及单细胞测序奠定基础。
1 材料与方法
1.1 供试材料
本研究选用种植于中国农业科学院试验基地的4个八仙花(Hydrangea macrophylla)品种‘Bailmer’‘Baby Blue’‘Bela’和‘Duro’进行研究,所有材料均选用盛花期萼片。其中,‘Bailmer’‘Baby Blue’和‘Bela’在不施铝栽培条件下花萼片呈粉色,施铝栽培条件下花萼片呈蓝色;‘Duro’在施铝和不施铝栽培条件下萼片颜色变化较小,基本均呈品红色。
1.2 试剂和仪器
试 剂:纤 维 素 酶(cellulase)、离 析 酶(macerozyme R-10)、甘露醇(D-mannitol)、吗啉乙磺酸(morpholine ethyl sulfonic acid,MES)、三羟甲基氨基甲烷(Tris)、牛血清蛋白(bovine serum albumin,BSA)、KCl、NaCl、MgSO4·7H2O、乙二醇双(2-氨基乙基醚)四乙酸(ethylene glycol tetraacetic acid,EGTA)和甘油(glycerol)购自于北京拜尔迪生物技术有限公司;聚-L-赖氨酸(poly-L-lysine)购自于西格玛奥德里奇贸易有限公司;CaCl2购自于国药集团化学试剂有限公司。
仪器:电子天平(BSM-220.4,上海卓精电子科技有限公司)、恒温震荡仪(MQT-60R,上海旻泉仪器有限公司)、离心机(BY-80C,北京白洋医疗器械有限公司)、低温离心机(1-14K,Sigma)、倒置显微镜(DMIL LED,Leica)、非损伤微测仪(NMTYG-100,Younger)。
1.3 原生质体游离
取盛花期萼片0.8~1.0 g,经预处理后,立即移至含有10 mL酶解液的离心管中;之后,将离心管放置在恒温震荡仪(28℃,40 r·min-1)内进行酶解;待酶解后,将混合液置于200目筛网过滤残渣,所得滤液倒入烧杯中;将所得滤液移至10 mL离心管中,并用改良后的W5洗液[19](154 mmol·L-1NaCl、125 mmol·L-1CaCl2、5 mmol·L-1KCl和4 mmol·L-1MES-Tris pH 6.3,灭菌,4℃保存)轻柔冲洗滤网上的残渣及烧杯,冲洗后的液体移入离心管中,2 000 r·min-1离心5 min,弃上清;沉淀由W5洗液重悬后移至1.5 mL离心管中,低温(4℃)离心5 min,弃上清;最后,用200μL储存液[5]将离心管中的沉淀悬浮,4℃保存。酶解液配制方法:将纤维素酶、离析酶、甘露醇和20 mmol·L-1pH 6.3的MES-Tris混匀后于55℃水浴10 min,待冷凉至室温后加入0.1%(质量体积比)BSA和10 mol·L-1CaCl2;储存液配制方法:甘露醇、2 mmol·L-1MgSO4、10 mmol·L-1KCl、20 mmol·L-1MES-Tris、5 mmol·L-1EGTA(pH 6.0)和2%(质量体积分数)甘油,灭菌,4℃保存。
采用单因素试验设计,分别设置不同预处理方式、酶浓度、酶解时间、甘露醇浓度、离心力、添加BSA和CaCl2,对原生质体游离体系和方法进行优化。
1.4 单因素实验
1.4.1 试验材料预处理方式 对试验材料采用2种不同的预处理方式进行处理,分别为:花萼片切丝法、花萼片上下表皮分离法。原生质体游离所用的纤维素酶和离析酶浓度分别为4%和0.4%(质量体积分数),甘露醇浓度为0.6 mol·L-1,酶解时间2 h,4℃条件下1 426 r·min-1离心;储存液甘露醇浓度为0.6 mol·L-1,其余同1.3。
1.4.2 酶浓度 设置纤维素酶质量体积分数分别为2%、4%、6%和8%;离析酶的质量体积分数分别为0.2%、0.4%、0.6%和0.8%。试验材料预处理方式采用花萼片上下表皮分离法,甘露醇0.6 mol·L-1,酶解时间2 h,4℃条件下1 426 r·min-1离心5 min,储存液甘露醇0.6 mol·L-1,其余同1.3。
1.4.3 酶解时间 酶解时间设4个水平,分别为1、2、3和4 h。试验材料预处理方式采用花萼片上下表皮分离法,纤维素酶与离析酶浓度质量体积比分数分别为4%和0.4%,甘露醇0.6 mol·L-1,4℃条件下1 426 r·min-1离心5 min,储存液甘露醇0.6 mol·L-1,其余同1.3。
1.4.4 甘露醇 对酶解液与储存液中的甘露醇分别设0.4、0.6和0.8 mol·L-13个梯度。试验材料预处理方式为花萼片上下表皮分离法,纤维素酶与离析酶质量体积分数分别为4%和0.4%,酶解时间2 h,4℃条件下1 426 r·min-1离心5 min,其余同1.3。
1.4.5 添加BSA和CaCl2酶与甘露醇融于含20 mmol·L-1MES-Tris(pH 6.3)的溶液并水浴后,加入0.1%(质量体积分数)BSA和10 mmol·L-1CaCl2,以不加BSA和CaCl2的酶解液为对照。试验材料预处理方式均为花萼片上下表皮分离法,纤维素酶与离析酶质量体积分数分别为4%和0.4%,甘露醇0.6 mol·L-1,酶解时间2 h,4℃条件下1 426 r·min-1离心5 min,其余同1.3。
1.4.6 离心力 在4℃条件下,分别用1 164、1 426、1 646和1 841 r·min-1离心5 min。试验材料预处理方式为花萼片上下表皮分离法,纤维素酶与离析酶质量体积分数分别为4%和0.4%,甘露醇0.6 mol·L-1,酶解时间2 h,其余同1.3。
1.5 游离原生质体计数
使原生质体均匀悬浮后,分别制片3张,每张滴30μL悬浮液后覆24 mm×50 mm盖玻片,镜检拍照,分别从3张制片中选取9张镜检图并统计有色原生质体数量,SPSS软件进行数据分析,Origin 2018软件进行绘图。
1.6 液泡H+流测定
将牙签尖头部用少量脱脂棉包裹成拖把状,蘸取0.008%(质量体积分数)聚-L-赖氨酸[21]涂抹在一次性培养皿中,置于冰箱冷藏层晾干备用。
使用特定检测H+流的离子交换液及质子选择性微电极制作探针,液泡H+流测试液绘制H+流测定标线。
吸取部分原生质体悬浮液移至培养皿中,加入特定液泡H+流测试液,避光条件下静置,使原生质体在重力作用下下沉,根据阴阳离子互作原理,聚-L-赖氨酸涂层吸附住原生质体,保证非损伤微测仪质子选择性微电极在运行过程中不移动。
分别随机选取‘Baby Blue’粉色、蓝色原生质体各7个,将探针置于靠近液泡的位置,对其液泡H+、Na+流进行测定并绘制相应测定曲线,导出曲线相应读数,SPSS软件进行数据分析,Origin 2018软件进行绘图。
2 结果与分析
2.1 单因素对有色原生质体酶解的影响
2.1.1 材料预处理方式对有色原生质体游离效率的影响 对‘Bailmer’和‘Baby Blue’的粉色和蓝色花萼片分别采用切丝和上下表皮分离法进行处理,结果表明,相较于切丝法,萼片上下表皮分离法更能高效地游离4种花萼片的有色原生质体(图1A),每个视野分别获得有色原生质体11~14个(‘Bailmer’)和17~22个(‘Baby Blue’)。
2.1.2 不同酶含量对有色原生质体游离效率的影响 由图1B可知,当纤维素酶与离析酶质量体积分数分别为4%和0.4%时,4份材料所获得的有色原生质体数量(每个视野)均显著高于其他含量组合。因此,4%和0.4%为纤维素酶与离析酶最佳酶解含量。
2.1.3 不同酶解时间对有色原生质体游离效率的影响 不同的酶解时长的结果(图1C)表明,对‘Bailmer’蓝色和粉色萼片来说,酶解2 h获得有色原生质体的数量均显著高于酶解1、3和4 h;而对于‘Baby Blue’蓝色和粉色萼片,酶解1和2 h所得有色原生质体的数量无明显差异,但均显著高于酶解3和4 h。综合考虑,2 h为最适酶解时长。
2.1.4 不同甘露醇浓度对有色原生质体游离效率的影响 对酶解液与储存液中甘露醇的不同浓度进行比较,结果(图1D)表明,当甘露醇浓度为0.6 mol·L-1时,其渗透压最适合有色原生质体的解离与储存。
2.1.5 添加BSA和CaCl2对有色原生质体游离效率的影响 由于前4组酶解离条件筛选试验中,同一八仙花品种不同颜色萼片的有色原生质体游离结果表现趋势一致,故本试验只选用了‘Bailmer’蓝色萼片和‘Baby Blue’粉色萼片为试验材料。结果(图1E)显示,在酶解液中添加0.1%BSA和10 mmol·L-1CaCl2后,‘Bailmer’蓝色萼片所得有色原生质体的数量与对照差异不显著;但‘Baby Blue’粉色萼片在添加0.1%BSA和10 mmol·L-1CaCl2后,酶解液中所得有色原生质体的数量显著高于对照。综合考虑,在酶解液中添加0.1%BSA和10 mmol·L-1CaCl2效果较好。
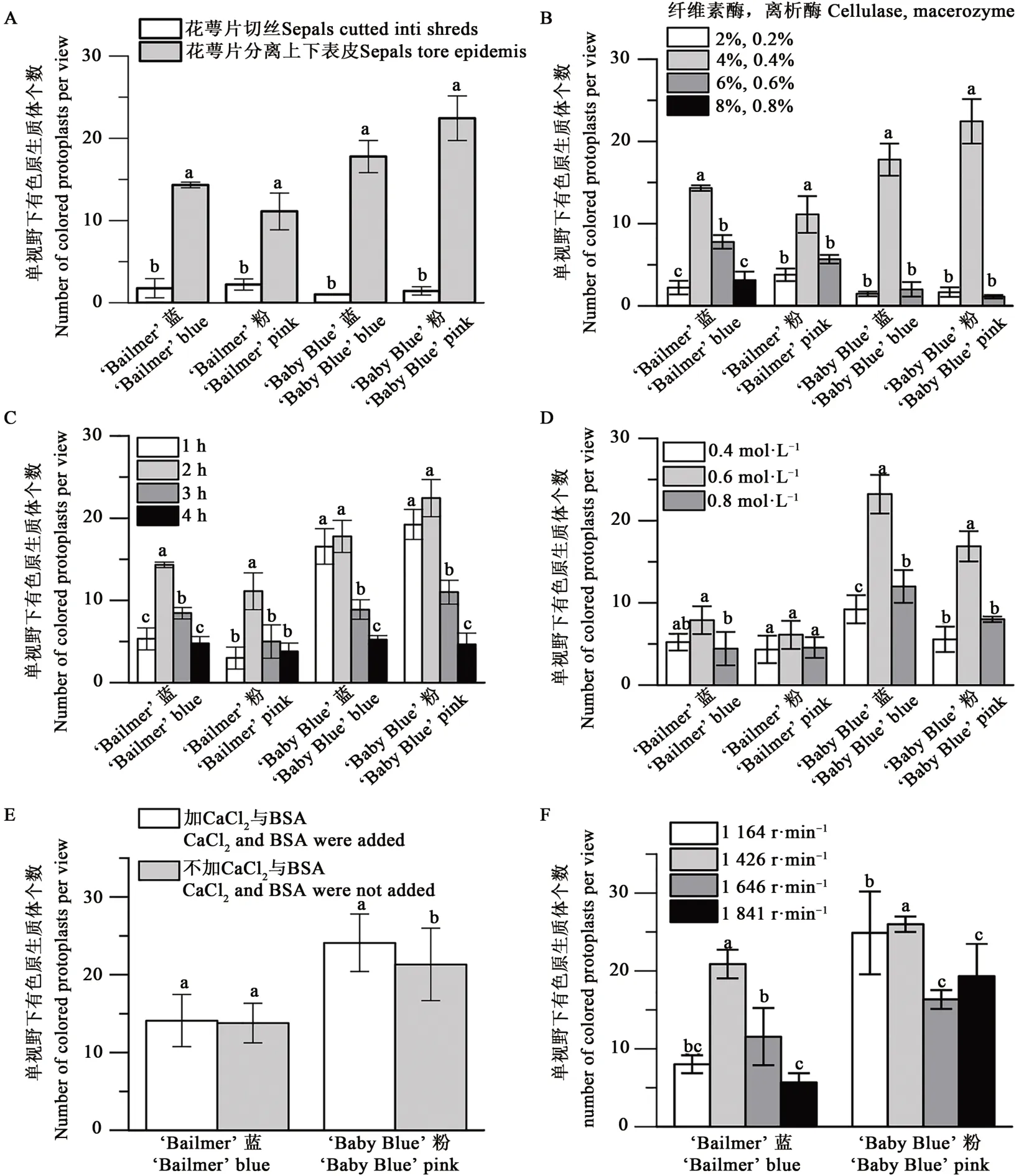
图1 单因素对有色原生质体酶解的影响Fig.1 Effect of single foctor on enzymatic hydrolysis
2.1.6 不同离心力对有色原生质体游离效率的影响 以‘Bailmer’蓝色萼片和‘Baby Blue’粉色萼片为材料,分析不同离心力下获得有色原生质体数量的差异,结果(图1F)显示,4℃条件下,1 426 r·min-1离心时获得有色原生质体的数量显著高于其他3种离心速率。离心速率过低,不能有效地沉淀有色原生质体;而离心速率过高会破损有色原生质体,降低产量。
上述研究表明,采用花萼片上下表皮分离法、纤维素酶和离析酶的质量体积分数分别为4%和0.4%、加入0.1%(质量体积分数)BSA和10 mmol·L-1CaCl2、酶解时间2 h、4℃条件下1 426 r·min-1离心5 min、甘露醇0.6 mol·L-1为八仙花萼片有色原生质体游离的最佳条件。
2.2 八仙花萼片有色细胞原生质体酶解体系应用
2.2.1 不同品种中酶解体系的应用 按上述最优酶解体系对4个八仙花品种在施铝处理(+Al3+)和未施铝处理(CK)条件下的花萼片进行有色原生质体游离。将原生质体悬浮均匀后制片,200×镜下单视野内可获得13~35个有色的原生质体(图2)。

图2 不同品种八仙花花器官及原生质体游离示意图(Bar=50μm)Fig.2 Schematic diagram of floral organs and protoplast dissociation of different species of Hydrangea(Bar=50μm)
2.2.2 液泡H+离子流分析 使用非损伤微测技术对八仙花品种‘Baby blue’粉色、蓝色液泡的H+、Na+流进行测定,结果(图3)表明,从H+流平均值来看,蓝色液泡H+流外排趋势较粉色液泡更加明显,由此推断,蓝色液泡的pH高于粉色液泡;从Na+流平均值来看,蓝色液泡Na+流吸收趋势更为明显,由此推断,H+在外流后,液泡吸收Na+来维持液泡内部原有溶质含量。

图3 ‘Baby blue’离子流Fig.3 ‘Baby blue’ion flux
3 讨论
八仙花萼片酶解游离出的原生质体分为有色原生质体与无色原生质体两种,其中,有色原生质体是研究花色形成的重要研究对象。原生质体游离的基础是酶解细胞壁释放原生质体。1960年,Cocking[22]首次利用从疣孢菌中获得的纤维素酶,以番茄根系为材料游离出了原生质体,这也是酶解法游离原生质体在植物上的首次应用。随后从木霉素中提取出纤维素酶,这也是后续大量原生质体游离试验中使用频率最高的酶[23]。酶解游离原生质体越来越广泛地应用于不同物种。
本研究发现,八仙花萼片原生质体游离的数量少于其他植物叶片、嫩茎和愈伤组织产生的原生质体数量,这可能是由组织材料的差异造成。酶解液更容易浸入疏松的组织,充分与细胞壁接触,断开纤维链并消解果胶。Yoo等[19]对拟南芥叶片原生质体游离时发现,酶解材料切丝时应避免挤压损伤,因为挤压会造成原生质体在细胞壁构筑的小室内破裂。然而,八仙花萼片组织质密、韧性强,如果对萼片采用切丝的预处理方法,会在创口处留下明显的挤压损伤,导致其原生质体游离的难度增大。本研究发现,采用分离上下表皮对八仙花萼片进行预处理,能增加酶液与材料的接触面积,有利于打破组织质密造成的酶解障碍,显著增加原生质体游离的数量。在对不同品种八仙花萼片原生质体进行游离时还发现,花萼片大且厚时,其上下表皮更易分离,更有利于原生质体游离。
为了高效地游离原生质体,必需配比合适比例的酶。若酶用量过低,则酶消解细胞壁的能力不足以支撑原生质体游离工作的完成;若酶用量过高,则会造成原生质体失活。Yoshida等[5]在游离八仙花萼片有色细胞原生质体时,采用的纤维素酶与离析酶质量体积分数分别为2%和0.2%,但本研究发现,纤维素酶与离析酶含量分别为4%和0.4%(质量体积分数)时,酶解产生的有色原生质体数量显著高于2%和0.2%(纤维素酶与离析酶水平)。另外,BSA能够有效维持酶活,保障酶解过程中酶功能的持续性[24];而Ca2+能与磷脂类物质上的负电荷结合维持细胞膜的稳定性,在一定程度上保障原生质体的活性,因此,在酶液中加入0.1%(质量体积分数)BSA和10 mmol·L-1CaCl2能获得更多的原生质体[25]。此外,若酶解时间较短,酶液无法与细胞壁充分反应;若酶解时间过长,会拉长试验周期,原生质体会失活,因此,2 h为最优酶解时长。甘露醇浓度需匹配细胞渗透压,细胞渗透压过小或过大均会造成原生质体活性降低,甚至失活,前人研究[18,26-27]中甘露醇浓度为0.4~1 mol·L-1。本研究结果表明,甘露醇浓度为0.6 mol·L-1时,八仙花有色原生质体游离效果最佳。
由于解离花萼片产生的原生质体数量较少,故需在离心过程中获得尽可能多的原生质体。纯化原生质体的方法主要有离心沉降法[18]与密度梯度自然沉降法[28]。离心速率较小或自然沉淀时,部分原生质体会重悬于上清中;若离心速率过大,原生质体会因受机械损伤而失活,甚至破裂。本研究表明,4℃条件下,最佳离心速率为1 426 r·min-1。
原生质体游离能有效地分离花萼中有色细胞和无色细胞,以便于研究有色细胞的生理生化特性。Yoshida等[5]使用质子选择微电极测得八仙花蓝色液泡pH约为4.1,红色液泡约为3.2。本研究中,‘Baby blue’蓝色原生质体液泡H+流外排,液泡内H+积累减少,pH相对较高;粉色原生质体液泡H+流吸收,液泡内H+积累增多,pH相对较低,与前人的研究结果一致。因此,本研究建立的有色原生质体游离体系为后续八仙花花色形成机理研究奠定了基础。

