铁皮石斛叶多糖结构及其益生性质初探
林雨晴,陆胜民,周万怡,邢建荣,杨 颖,*
(1.南京农业大学 食品科技学院,江苏 南京 210095; 2.浙江省农业科学院 食品科学研究所,浙江省果蔬保鲜与加工技术研究重点实验室,浙江 杭州 310021)
铁皮石斛是兰科石斛属多年生草本植物,被誉为“九大仙草之首”,是我国的传统名贵中药材,其茎作为传统药用部位列入药典,使用量较大;而石斛叶约占鲜枝条质量的30%左右,产量巨大,大部分作为副产物直接丢弃,目前未得到充分利用,造成生物资源的极大浪费。铁皮石斛叶已于2017年被国家卫生和计划生育委员会认定为新型食品原料,其组分与茎相似,其中多糖的含量为10%左右[1-2],因其功效不及茎多糖明显,对其研究主要集中在综合利用领域,不同产地、不同品种铁皮石斛叶多糖的结构、功效未见系统报道。
多糖的生物活性与其结构紧密相关,其分子量、单糖组成、空间结构与活性有直接或间接的联系[3-4]。另外,铁皮石斛多糖等非淀粉类多糖物质为大分子化合物,难以在胃和小肠等部位消化吸收,结肠菌群是其降解利用的主力军。而结肠菌群的组成和短链脂肪酸(SCFAs)含量与人体健康息息相关,健康的肠道菌群具有辅助营养吸收、保持合理体重[5]、预防糖尿病等代谢疾病[6]、增强免疫力[7]等功效。因铁皮石斛叶多糖对肠道菌群和SCFAs的调控作用还未知,铁皮石斛品种、多糖结构对肠道菌群影响的区别不明确,本研究以浙江道地产区——雁荡山主栽的3种铁皮石斛叶为原料,提取纯化多糖并初步解析其结构,研究其对结肠菌群组成及其代谢产物的调控作用,为其作为新型益生因子应用和叶片精准利用提供依据。
1 材料与方法
1.1 材料与试剂
雁斛1号、雁斛3号、圣兰8号铁皮石斛叶采集于浙江铁枫堂药业有限公司所属乐清市大荆镇北吕岙基地。
植物乳杆菌(Lactobacillusplantarum)CGMCC 1.573、干酪乳杆菌(Lactobacilluscasei)CGMCC 1.575、戊糖乳杆菌(Lactobacilluspentosus)CGMCC 1.2707、鼠李糖乳杆菌 (Lactobacillusrhamnosus) CGMCC 1.120购于中国普通微生物菌种保藏管理中心;大肠埃希菌(Escherichiacoli)ATCC25922、金黄色葡萄球菌(Staphylococcusaureus)ATCC25923、单增李斯特菌(Listeriamonocytogenes)ATCC19115购于美国模式菌种收集中心。
MRS培养基购于英国OXOID公司;其他试剂均为国产分析纯,购于中国医药集团有限公司。
1.2 主要仪器与设备
ICS-5000离子色谱仪,美国戴安公司;7 L厌氧培养盒,三菱化学株式会社;LRH-150-Z II微电脑控制震荡培养箱,广东省医疗器械厂;GC2010 plus气相色谱仪,日本Shimadzu公司;Agilent 1260 Infinity高效液相色谱仪,美国Agilent 公司;高S-3700N扫描电子显微镜,日本日立公司。
1.3 实验方法
1.3.1 石斛叶多糖制备
参照邱现创等[8]的方法,获得雁斛1号、雁斛3号、圣兰8号叶片多糖,依次命名为DOP1、DOP2和DOP3。
1.3.2 分子量测定
用凝胶渗透色谱法(GPC)[9]测定多糖分子量。准确称取多糖样品溶解于0.1 mol·L-1NaNO3中,配置成5 mg·mL-1溶液,过0.45 μm滤膜后备用。色谱条件:采用Waters 1525 GPC(配色谱柱使用UltrahydrogelTMLinear(300 mm×7.8 mm),检测器为2414示差折光检测器,柱温为45 ℃,0.1 mol·L-1NaNO3作为流动相,流速为0.9 mL·min-1。
1.3.3 单糖组成测定
参考刘卫宝[10]的方法。配制1 mg·mL-1单糖混合标准溶液(鼠李糖,阿拉伯糖,半乳糖,葡萄糖,木糖,甘露糖,果糖,核糖,半乳糖醛酸,葡萄糖醛酸),称取石斛多糖5 mg,加入2 mol·L-1的三氟乙酸(TFA)溶液300 μL,100 ℃水解12 h,冷却至室温后用氮气吹干,加入300 μL甲醇,溶解后吹干,重复3次,然后加入25 mL超纯水溶解残余物,用0.45 μm滤膜过滤,进行离子色谱仪(IC)分析。色谱柱使用CarboPac PA20,采用脉冲安培检测器,依次以水、250 mmol·L-1NaOH和1 mol·L-1NaAc为流动相,流速为0.5 min·mL-1。
1.3.4 多糖形态结构观察
分别配制质量浓度为4 g·L-1的DOP1、DOP2和DOP3溶液,滴于电镜的样品座上,转移至液氮中快速冷却,传送至Quorum PP3010T制备腔室中升华,升华温度为-80 ℃,15 min,用Hitachi Regulus 8100场发射扫描电镜观察拍照。
1.3.5 对常见益生菌与致病菌影响
对有益菌影响:参考Wichienchot等[11]的方法,以MRS培养基为基础,分别以3种多糖替代MRS培养基中的葡萄糖、3种多糖与等量葡萄糖复配、葡萄糖为单独碳源制备改良MRS培养基(对照),多糖与葡萄糖的添加量均为4 g·L-1。取活化好的植物乳杆菌、干酪乳杆菌、鼠李糖乳酸菌和戊糖乳酸菌分别接种于上述7种培养基中,接种量为20 mL·L-1,培养18~24 h。取发酵液用无菌0.9% NaCl溶液进行梯度稀释,涂布于MRS固体培养基表面,37 ℃厌氧培养48 h,进行菌落计数。
对有害菌的影响:在脑心浸液肉汤(BHI)培养基中分别添加4 g·L-1浓度的DOP1、DOP2和DOP3作为补充碳源,得到3种BHI培养基;在LB培养基中也分别添加上述3种多糖,得到3种LB培养基,以原始BHI与LB培养基作为对照。取活化好的金黄色葡萄球菌、大肠埃希菌接种于LB培养基,单增李斯特菌接种于BHI培养基,接种量20 mL·L-1,37 ℃振荡培养18~24 h,取发酵液梯度稀释、涂布于LB和BHI固体培养基表面,37 ℃培养48 h,进行菌落计数。
1.3.6 对人体结肠菌群的影响
挑选3个月没有接受过抗生素治疗并签署知情同意书的志愿者,收集新鲜粪样本,取2 g溶解于18 mL无菌磷酸盐缓冲液(PBS,0.1 mol·L-1,pH值4.7)中,充分搅拌后用3层纱布过滤。收集滤液备用。
营养培养基:参考Zheng等[12]的方法,将0.51 g KCl、0.11 g KH2PO4、7.14 g NaHCO3、2.24 g NaCl和0.07g MgCl2·6H2O溶解在0.95 L无菌水中,高压灭菌备用。
培养方法:无菌发酵管中加入3 mL细菌悬液和27 mL培养基,充分混匀,注入氮气持续10 min以除去氧气,密封并置于摇床中24 h(37 ℃,100 r·min-1),分别按照4 g·L-1的终浓度加入3种多糖,充氮10 min,密封后避光振荡(37 ℃,100 r·min-1)培养,于0 h、24 h和72 h分别取样5 mL溶液,在-80 ℃保存,进行16S rRNA测序。
菌群组成:采用16S rRNA测序,委托联川生物公司对样本的v3-v4区进行扩增,完成16S rRNA序列分析,通过生信分析平台进行微生物多样性分析及群落统计分析。
短链脂肪酸(SCFAs):参考陈军奎等[13]的方法,采用巴豆酸-偏磷酸作为内标物,用气相色谱(GC)测定,GC-2010 plus型气相色谱仪,氢火焰离子化检测器,DB-FFAP通用型气相色谱柱,参数为0.32 mm×30 m×0.50 μm。
1.3.7 数据统计分析
数据采用SPSS20.0软件分析,使用单向方差分析(ANOVA)分析数据,试验结果用平均值±标准差表示,当P<0.05时具有统计学意义。
2 结果与分析
2.1 分子量分布
分子量是多糖重要的理化指标,与生物大分子的生物活性息息相关。由图1、表1可见,3种铁皮石斛叶多糖均呈单一峰,DOP1、DOP2和DOP3的平均分子量分别为2.56×105、1.35×105、3.26×105,与报道的石斛多糖分子量范围(3×103~1×107)一致[14]。
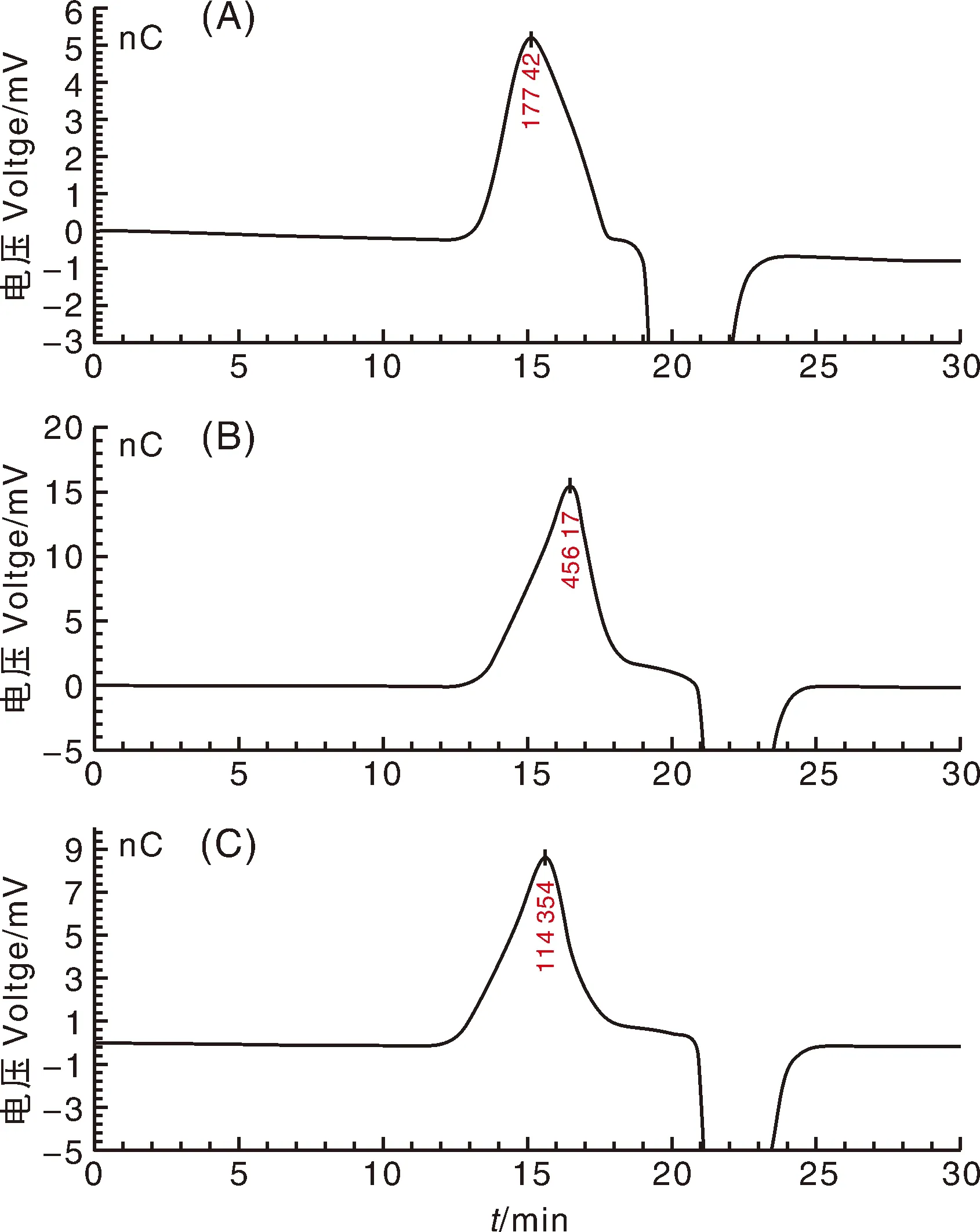
图1 三种铁皮石斛叶多糖的GPC色谱图Fig.1 GPC chromatogram of three polysaccharides from Dendrobium varieties leaves

表1 三种铁皮石斛叶多糖的分子量
2.2 单糖组成
由表2可见,DOP1、DOP2和DOP3均由葡萄糖(Glc)、甘露糖(Man)、半乳糖(Gal)和阿拉伯糖(Ara)4种单糖组成,但其单糖比例不同。以半乳糖的物质的量为1,计算葡萄糖、甘露糖和阿拉伯糖的物质的量比,DOP1中Glc、Man、Gal、Ara的比例为252∶210∶1∶0.78,DOP2为370∶245∶1∶0.87,DOP3为278∶169∶1∶0.90。

表2 三种多糖的单糖物质的量比
2.3 在水溶液中的形态
多糖在水溶液中的形态很难直接观测,一般通过Mark-Houwink指数来推测其分子构型,难以获得直观的形态特征。本研究通过控制冷冻传输系统的操作参数,将多糖溶液低温冻结,然后升华部分纯冰,显现溶液中多糖的水合或者部分水合状态,以扫描电镜观察其骨架结构,推测其在水溶液中的形态。3种多糖均呈链网状结构,DOP1在水溶液中呈链状结构,链与链之间的连接较为紧密(图2-A);DOP2在水溶液中呈丝瓜瓤结构连接,结构立体,各部分之间通过链条状连接,结构最为疏松(图2-B);DOP3在水溶液中呈片状结构,结构立体,网状结构明显(图2-C)。三者微观结构存在着较大的差异,可能与其单糖链接方式、聚集方式、分子间作用力和位置相关[15],目前未见类似的报道。

图2 DOP1(A)、DOP2(B)和DOP3(C)在水溶液中的扫描电镜图Fig.2 Scanning electron micrograph of DOP1 (A), DOP2 (B) and DOP3 (C) in aqueous solutions
2.4 对常见益生菌和致病菌增殖的影响
2.4.1对益生菌增殖的影响
以石斛叶多糖为替代碳源时,4种有益菌的生长状况良好,其中植物乳杆菌的生长量高于对照组,但无显著差异;戊糖乳杆菌和干酪乳杆菌菌落数显著(P<0.05)低于对照组;鼠李糖乳杆菌与对照组接近;表明3种多糖均能被上述益生菌利用,植物乳杆菌的利用效果更佳。以石斛多糖与葡萄糖复配作为碳源时,菌株生长量基本高于单一多糖和对照组,进一步说明石斛叶多糖对上述有益菌的增殖具有促进作用。其中,DOP1复配葡萄糖组显著(P<0.05)促进干酪乳杆菌与鼠李糖乳杆菌增长,DOP2复合组中,鼠糖乳杆菌显著(P<0.05)增加,DOP3复合组中,植物乳杆菌和戊糖乳杆菌数量显著增加,且与其他各实验组存在显著差异(P<0.05)。其原因可能是DOP3和DOP2结构较DOP1更为疏松,在水溶液中的分散性更好,更容易被益生菌利用,从而产生更强的增殖作用。

表3 三种多糖对常见益生菌增殖的影响
2.4.2 对常见条件致病菌增殖的影响
由表4可见,金黄色葡萄球菌在添加多糖的培养基中生长量无明显变化,说明3种多糖对金黄色葡萄球菌的增殖无明显促进作用,而大肠埃希菌、单增李斯特菌在含多糖培养基中增殖受到抑制,这可能是由多糖本身的抑菌特性引起的,也可能是多糖特有的功能基团合了培养基中的营养物质,影响了营养物质的传递,降低菌株的营养摄入量。DOP1组显著(P<0.05)抑制单增李斯特菌生长,DOP2和DOP3组显著(P<0.05)抑制大肠埃希菌、单增李斯特菌生长,推测这与多糖化学结构及其在水溶液中的构象相关,需对其进行深入研究。

表4 三种多糖对常见致病菌增殖的影响
2.5 对人体结肠菌群的影响
2.5.1 菌群相对丰度分析
为探索3种多糖进入人体后的益生特性,研究3种多糖对人体结肠菌群组成与短链脂肪酸的影响。选取16S rRNA测序结果绘制属水平菌群热图,结果如图3所示。与对照组相比,3种多糖均能持续促进副拟杆菌属(Parabacteroides)相对丰度上升,DOP3作用效果最明显,且能显著促进考拉杆菌属(Phascolarctobacterium)相对丰度上升;3种多糖均能显著(P<0.05)抑制克雷伯氏菌属(Klebsiella)、嗜胆菌属(Bliophila)等条件致病菌的相对丰度,DOP2和DOP3组的作用效果优于DOP1组。此外,DOP3组显著(P<0.05)抑制摩根氏菌属(Morganella)和假单胞菌属(Pseudomonas)等条件致病菌增长。

图3 三种多糖对模拟体系中菌群组成的影响Fig.3 Effects of three polysaccharides on relative abundance of microbial community in simulated fermentation broth
肠道菌群组成在肥胖和与肥胖相关的慢性炎症发病机制中起着重要作用[16-17]。副拟杆菌属的主要代谢终产物为对人体有益的乙酸和琥珀酸,狄氏副拟杆菌可以通过产生琥珀酸和次级胆酸盐减轻宿主肥胖和代谢失常[18]。考拉杆菌属相对丰度上升也有助于预防肥胖症[19]。3种多糖均能促进考拉杆菌属和副拟杆菌属相对丰度上升,其中DOP2和DOP3效果更优。克雷伯氏菌属包括肺炎克雷伯氏菌、臭鼻克雷伯氏菌和鼻硬克雷伯氏菌,其中肺炎克雷伯氏菌是重要的条件致病菌和医源性感染菌。嗜胆菌属会产生对人体上皮细胞有害的硫化氢,进而破坏人体上皮细胞屏障完整性,诱发一系列慢性炎症[20]。摩根氏菌属和假单胞菌属中大部分菌群亦为条件致病菌,可引起手术伤口感染[21]。3种多糖均能抑制克雷伯氏菌属和嗜胆菌属增加,DOP3还能显著抑制摩根氏菌属和假单胞菌属增加,可以进一步研究其预防炎症的效果。
2.5.2 多糖对SCFAs的产生的影响
如图4所示,多糖组乙酸、丙酸、丁酸、戊酸浓度变化趋势与对照组一致,均为先上升后下降,但多糖组的增加幅度大于对照组,下降幅度小于对照组,DOP2与DOP3下降幅度小于DOP1组,且DOP3组的丁酸增加幅度最大、降低幅度最小。异丁酸、异戊酸含量较低,3种多糖抑制异丁酸、异戊酸的产生,DOP2和DOP3组较DOP1组抑制作用明显,DOP3组最明显。

图4 三种多糖对模拟体系中对短链脂肪酸(SCFAs)含量的影响Fig.4 Effects of three polysaccharides on concentration of short chain fatty acids (SCFAs) in simulated fermentation broth
SCFAs是某些肠道微生物群发酵多糖、低聚糖等底物产生的代谢产物,具有维持肠上皮细胞屏障完整性的作用,与预防慢性炎症密切相关[22-23]。结肠中最主要的有机酸为乙酸、丙酸和丁酸,占总SCFA组成的90%~95%[24]。乙酸是外周血液循环过程中主要的SCFA,能够通过血脑屏障的中央稳态机制抑制食欲,对于控制体重具有一定的效果[6]。丙酸在肝中可作为糖原底物参与新陈代谢,能抑制胆固醇合成,降低血清胆固醇水平,防止饮食引起的肥胖,还可以提高细胞组织对胰岛素的敏感性,预防糖尿病[25]。丁酸主要由多糖中的半乳糖代谢产生[26],可以缓解胰岛素抵抗,还可以作为结肠上皮细胞的主要能量来源,能够通过影响宿主的基因调控、细胞分化和细胞凋亡来维持宿主的生理健康[15]。除了乙酸、丙酸和丁酸,石斛多糖还能促进戊酸的产生,目前对于戊酸的研究较少,其在肠道中的功效尚不确切。DOP2和DOP3能够降低发酵液中异丁酸、异戊酸的浓度,异丁酸、异戊酸是当肠道内可发酵的纤维供不应求时,微生物转向利用膳食中的氨基酸、内源性蛋白质或膳食脂肪后产生的代谢产物,这可能导致微生物自身活性和乙酸、丙酸、丁酸产量降低[27-28]。3种石斛叶多糖有利于乙酸、丙酸和丁酸等重要短链脂肪酸的生成。
3种多糖的分子量和单糖组成差异较小,但对常见有益菌和有害菌增殖、体外肠道菌群和SCFAs产生的影响具有一定差异,说明多糖功效不仅与其分子量、单糖组成等化学结构相关,还与其精细结构相关,石斛多糖的功能与结构之间的关系是一个复杂的体系,需要进行深入系统的研究。
3 结论
本研究提取雁荡山地区主栽的3种石斛叶多糖DOP1、DOP2和DOP3,其平均分子量(Mw)分别为2.56×105、1.35×105和3.26×105,均由阿拉伯糖、半乳糖、葡萄糖和甘露糖4种单糖组成,其物质的量比不同;3种多糖在水溶液中呈现链网状结构,DOP1结构最紧密,DOP3次之,DOP2最疏松。3种多糖均能促进植物乳杆菌、戊糖乳杆菌和鼠李糖乳杆菌的增殖,DOP3的效果较优;DOP1对单增李斯特菌的生长有抑制作用,DOP2和DOP3对大肠埃希菌和单增李斯特菌均有抑制作用。选择人体结肠菌群进行体外培养发现,3种多糖均能促进副拟杆菌属和考拉杆菌属等有益菌丰度增加,降低克雷伯氏菌属、嗜胆菌属等条件致病菌的相对丰度,DOP3还可显著抑制摩根氏菌属与假单胞菌属增长,三者还可促进乙酸、丙酸、丁酸产生,其中DOP2与DOP3的综合效果更明显,说明石斛叶多糖对维护人体肠道菌群平衡与健康具有一定意义,具有作为新型益生因子应用的潜力。

