脐带间充质干细胞外泌体对大鼠卵巢功能作用及机制研究
赵莹莹, 陈莉莎, 闫 丽, 王恺悦, 魏 威, 刘星池, 于月新
北部战区总医院 生殖医学中心,辽宁 沈阳 110003
卵巢早衰是一种严重影响女性健康的卵巢功能障碍性疾病,会出现一系列由于激素紊乱导致的临床症状[1-3]。过度激活的细胞凋亡或排卵期间无健康的卵泡发育是卵巢早衰的主要病因。目前,临床对于卵巢早衰缺少有效的治疗方法,如何修复卵巢损伤成为临床亟待解决的问题[4-6]。雌激素相关治疗可改善患者的临床症状,但对卵巢功能重建的作用甚微,不能从根本上改善卵巢功能。有研究报道,干细胞移植或卵巢冷冻移植可挽救部分卵巢早衰。脐带间充质干细胞外泌体(umbilical cord mesenchymal stem cell exosomes,MSCs-exo)是具有生物活性的纳米级囊泡,具有易提取、免疫原性低的特点,能够执行脐带间充质干细胞的生物学功能,调节目标组织器官的正常生理功能和异常病理过程[7]。有学者将MSCs-exo用于多种损伤模型,均呈现出了良好的功能修复与治疗效果,其作用机理和生物学功能是目前再生医学研究的热点[8-10]。但MSCs-exo对卵巢早衰动物模型的作用和机制尚待进一步研究。本研究旨在探讨MSCs-exo对大鼠卵巢功能的修复及保护作用,并初步研究其作用机制。现报道如下。
1 材料与方法
1.1 实验动物与试剂 24只SD大鼠购自辽宁长生生物科技有限公司,饲养于 SPF级实验室,温度维持(22±3)℃,湿度维持45%~65%,自由饮食饮水。MSCs-exo购自辽宁润基生物科技有限公司;去氧乙烯基环己烯(VCD)购自上海阿拉丁生化科技股份有限公司;大鼠ELISA试剂盒和细胞染料购自南京森贝伽生物科技有限公司;Western blot抗体购自abcam公司。适应性饲养大鼠7 d后,将其随机分为空白组、模型组和干预组3组,每组各8只。空白组腹腔注射芝麻油,模型组和干预组腹腔注射VCD溶液(160 mg/kg),连续注射15 d后干预组尾静脉注射MSCs-exo悬液(150 μg/kg)。
1.2 细胞培养 大鼠处死后使用75%乙醇浸泡10 min消毒,取卵巢置于预冷的DMEM/F12培养液(含10%胎牛血清、100 U/ml青霉素和100 U/ml链霉素)中,剪碎后加入0.25%胰酶(含0.01% EDTA),室温消化,滤网过滤,离心后DMEM/F12培养液制成颗粒细胞悬液,置于培养箱(37℃、5% CO2、饱和湿度)中培养,每隔48 h更换1次培养液。模型组、干预组采用VCD浓度为30 μmol/L的完全培养基建立颗粒细胞损伤模型,干预组加入10 μg MSCs-exo。
1.3 细胞活力检测 每孔加入10 μl的CCK-8试剂,置于培养箱培养4 h,于酶标仪450 nm处测定吸光度值。检测细胞活力,每2 d测定1次,连续测定10 d。以细胞活力为纵坐标、时间为横坐标绘制细胞生长曲线。
1.4 激素分泌检测 细胞接种于24孔板后进行分组处理,在含10%胎牛血清的DMEM/F12培养液,37℃、5% CO2的条件下培养,3 d后收集培养液,按照ELISA 检测试剂盒说明书检测雌二醇和孕激素水平。
1.5 细胞凋亡检测 利用流式细胞仪,采用Annexin-V/PI双染法检测各组颗粒细胞中的存活细胞、凋亡早期细胞及凋亡晚期细胞的比例。细胞经消化、离心、重悬、计数后加入染料,孵育后上机检测。
1.6 血清激素水平测定 大鼠麻醉后眼眶取血,将取好的血液在室温下静置30 min,4℃、1 500 r/min离心15 min,取上清液,采用ELISA法测定血清激素水平。
1.7 Western blot法 提取细胞和组织蛋白,测定总蛋白,将蛋白样品经SDS-聚丙烯酰胺凝胶电泳并转移至PVDF膜上,室温封闭1 h,分别用Ras(abcam,ab52939,1∶1 000)、Erk(abcam,ab109282,1∶1 000)、Bax(abcam,ab32503,1∶1 000)、Caspase-3(abcam,ab184787,1∶1 000)一抗4℃孵育过夜。TBST漂洗3次,加入相对应二抗室温孵育1 h。TBST漂洗3次,用ECL Western印迹试剂盒进行化学发光检测。
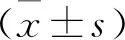
2 结果
2.1 各组大鼠颗粒细胞增殖率比较 CCK-8实验结果表明,模型组、干预组干预2 d、4 d、6 d、8 d、10 d的颗粒细胞增殖率均低于空白组,且模型组低于干预组,差异有统计学意义(P<0.05)。见图1。
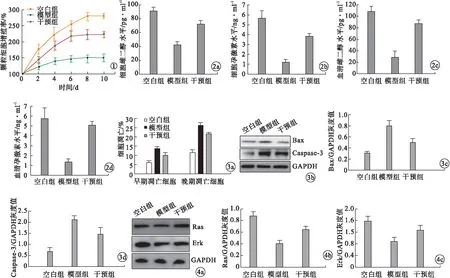
图1 各组大鼠颗粒细胞增殖率变化 图2 各组大鼠激素水平比较(a.颗粒细胞雌二醇水平;b.颗粒细胞孕激素水平;c.血清雌二醇水平;d.血清孕激素水平) 图3 各组大鼠细胞凋亡情况及凋亡相关蛋白水平比较(a.各组细胞三周之情况;b~d.各组Bax、caspase-3蛋白表达) 图4 各组大鼠Ras、Erk蛋白表达水平比较(a.Western blot法检测Ras、Erk表达;b.Ras相对表达量;c.Erk相对表达量)
2.2 各组大鼠激素水平比较 模型组、干预组颗粒细胞雌二醇水平、颗粒细胞孕激素水平、血清雌二醇水平、血清孕激素水平均低于空白组,且模型组低于干预组,差异有统计学意义(P<0.05)。见图2。
2.3 各组大鼠卵巢细胞凋亡情况及凋亡相关蛋白水平比较 模型组、干预组颗粒细胞凋亡数量高于空白组,且模型组高于干预组,差异有统计学意义(P<0.05)。模型组、干预组大鼠卵巢组织Bax和Caspase-3表达水平高于空白组,且模型组高于干预组,差异有统计学意义(P<0.05)。见图3。
2.4 各组大鼠Ras、Erk蛋白表达水平比较 模型组、干预组卵巢组织Ras、Erk蛋白表达水平低于空白组,且模型组低于干预组,差异有统计学意义(P<0.05)。见图4。
3 讨论
卵巢能够产生卵细胞并分泌激素,卵巢中的卵母细胞或者颗粒细胞被机体内外的各种生理病理因素损伤会导致卵巢功能下降或衰竭[11]。有研究发现,细胞凋亡会对卵巢功能造成严重影响[12-14]。闭锁卵泡中的大部分颗粒细胞均发生了凋亡,而发育卵泡中的颗粒细胞并没有出现明显的凋亡,因此,颗粒细胞凋亡可能是卵巢早衰的重要原因[15]。本研究成功建立了卵巢损伤模型,采用MSCs-exo干预后,颗粒细胞增殖和卵巢激素分泌功能有所改善,提示颗粒细胞凋亡影响了激素分泌功能。本研究结果显示,模型组、干预组大鼠卵巢组织Bax和Caspase-3表达水平高于空白组,且模型组高于干预组,差异有统计学意义(P<0.05)。Bax是促进细胞凋亡的基因,其蛋白表达主要定位于细胞浆。细胞浆内活化的Bax蛋白可以插入并改变线粒体膜的通透性,引起细胞色素C释放,Caspase-3被激活,启动级联反应,诱导细胞凋亡[16]。Caspase-3是细胞凋亡发生的标志性蛋白酶,正常状态下以酶原形式存在,当凋亡刺激因子激活Caspase-3,可引起一系列级联反应,最终导致细胞凋亡[17-19]。
Ras-Erk信号通路在卵巢颗粒细胞激素分泌和细胞凋亡中发挥关键作用。EGFR/Ras通路下游靶激酶Erk1/2在卵巢早衰颗粒细胞中被破坏会影响细胞凋亡、增殖和迁移,导致激素分泌功能降低[20]。因此,本研究在明确了MSCs-exo干预对卵巢的作用后,进一步检测了Ras-Erk信号通路的变化,阐明了MSCs-exo可能通过Ras-Erk减少卵巢颗粒细胞凋亡,促进卵巢功能。
综上所述,MSCs-exo能够有效调节卵巢功能,促进细胞增殖,其可能通过调节Ras-Erk通路,减少细胞凋亡。

