不同光-暗周期对企鹅珍珠贝足丝分泌的影响
杨 蕾, 严 杰, 陈 一, 张佳谊, 战 欣
不同光-暗周期对企鹅珍珠贝足丝分泌的影响
杨 蕾1, 2, 严 杰1, 2, 陈 一1, 2, 张佳谊1, 2, 战 欣1, 2
(1. 海南大学 海洋学院, 海南 海口 570228; 2. 海南大学 南海海洋资源利用国家重点实验室, 海南 海口 570228)
企鹅珍珠贝()是生产附壳珍珠的大型海水经济贝类, 依靠强壮的足丝将自身固定在硬质基质上, 抵抗水流的冲击和抵御被捕食。足丝分泌和形状易受环境影响, 本实验研究了三种光-暗周期(全黑暗组、6 h光-暗组、12 h光-暗组)对企鹅珍珠贝足丝分泌、足丝直径和足丝拉力的影响。结果表明: 光照条件下6 h光-暗组和12 h光-暗组企鹅珍珠贝足丝首次附着率和足丝分泌数量显著低于全黑暗组(<0.05); 光照条件下几乎不分泌足丝, 光照严重抑制了足丝分泌, 抑制率最高可达100%, 恢复黑暗条件后企鹅珍珠贝重新分泌足丝, 且分泌数量增加, 最多每小时增加(1.94±1.00)根; 不同光-暗周期条件下企鹅珍珠贝0~24 h、24~48 h、48~72 h期间足丝首次附着率和足丝分泌数量无显著性差异(>0.05)。全黑暗条件下足丝远端直径(0.45±0.09) mm和近端直径(0.38±0.09) mm存在显著性差异(<0.05), 足丝直径发生改变; 但不同光-暗周期条件下, 企鹅珍珠贝足丝远端、中端和近端直径无显著性差异(>0.05)。全黑暗组、6 h光-暗组、12 h光-暗组中, 企鹅珍珠贝单根足丝拉力分别为(3.40±2.76) N、(2.68±1.10) N、(3.86±2.05) N, 三种光-暗周期条件下足丝的拉力无显著性差异(>0.05)。综上, 光照会显著抑制企鹅珍珠贝足丝的分泌, 但一旦恢复黑暗条件, 企鹅珍珠贝可重新分泌足丝, 新足丝的拉力和直径不受影响; 不同光-暗周期不会对企鹅珍珠贝的足丝附着、足丝直径和足丝拉力造成显著性影响。研究结果可以为企鹅珍珠贝的野外吊养和游离珠生产提供基础资料。
企鹅珍珠贝; 光-暗周期; 足丝附着; 足丝性能
企鹅珍珠贝(), 属软体动物门Mollusca, 双壳纲Bivalvia, 珍珠贝科Pteriidae, 珍珠贝属, 其生长环境为热带、亚热带海域, 多用于大型优质海水附壳珍珠、像形珍珠的培育, 是重要的海水养殖种类[1-3]。企鹅珍珠贝通过其足部分泌的足丝, 黏附在水下基质上营附着生活, 黏附有利于其获取生存必需品, 免受捕食者的侵害, 增加基因交流的几率; 黏附与其他生理功能密切相关, 如变态、蜕皮、生物矿化[4]。环境因素, 如盐度、温度、pH值、季节和基质[5-8], 以及生物因素, 如年龄和代谢状态等[9-10], 都会对足丝分泌产生影响, 从而影响足丝附着在基质表面的效率和强度。盐度在29和32时, 6 h内珍珠贝()稚贝足丝附着率最高(>70%)[6]; 温度也会对足丝附着率产生影响, 但是影响程度不如盐度大, 当温度超过26 ℃时, 紫贻贝()死亡, 无足丝产生[5-6]; 与动态的海水相比, 在静置状态下足丝产量减少了约40%[5]; 随着企鹅珍珠贝年龄的增长, 足丝形成率逐渐降低[10]。
光照是水生环境中重要的生态因子, 显著影响水生生物的行为和潜在的生理生化机制, 控制水生生物的行为[11]。对于双壳贝类来说, 光照可能提供重要的信息, 影响其在水流中的位置和环境位置。有光照说明离水面很近, 这对固着生物来说可能是危险的, 因为有脱水的可能。此外, 有光照的地点很可能没有庇护所, 因此更容易受到捕食者的攻击或被水流冲走, 另一方面, 对于密集聚集的斑马贻贝()来说, 光线的存在可能表明它位于群体的表面, 那里的食物和氧气条件更好[12]。仅Vasquez等[13]报道在黑暗条件下企鹅珍珠贝(壳高: 7.2~24.1 mm)在附着时对基质具有选择性。
贻贝更喜欢在阴暗处活动[14-16], 光照会减少斑马贻贝的向上运动[17], 并降低它们的初始附着强度[18]。沼蛤()具有光照诱导的运动变化, 它在黑暗中不选择运动方向, 在光亮环境中更倾向于向下移动[19]。光照抑制企鹅珍珠贝稚贝(壳高: 7.2~24.1 mm)的运动和足丝的再附着, 稚贝在黑暗环境中6 h的平均移动距离极显著高于在光照条件下6 h的平均移动距离[13]。
近年来有关光照对双壳贝类影响的研究主要集中在贻贝科及其运动行为方面, 而光照对企鹅珍珠贝足丝分泌相关行为的影响尚未见报道。本研究通过分析不同光-暗周期下企鹅珍珠贝足丝分泌行为、足丝直径和足丝拉力等, 探究不同光-暗周期对企鹅珍珠贝足丝的影响, 为提高企鹅珍珠贝野外海区吊养的成活率提供参考。
1 材料与方法
1.1 实验材料
海南三亚蜈支洲岛海洋牧场提供实验所需的1.5~2.0龄贝[壳高: (57.56±3.03) mm, 壳宽: (18.79± 0.73) mm], 运送至海南文昌市内六村海昌对虾种苗繁育中心, 清理贝体表面附着污损物后暂养两周(光照周期为12 h光-暗周期), 暂养期间投喂鲜藻[球等鞭金藻(), 扁藻()]饵料(浓度为2.5×105~3.0×105cell/mL), 挑选正常附着的个体, 用消毒的解剖剪剪去贝壳外部足丝(沿着贝壳边缘将其剪断, 确保对内部结构没有损伤)用于正式实验。
1.2 实验方法
1.2.1 不同光-暗周期实验
以LED灯作为光源, 将实验桶上方光照强度控制在3 000 lx。水温控制在(26±1) ℃, 盐度为35, 每天定时投喂一次鲜藻饵料(浓度为2.5×105~3.0× 105cell/mL)。
实验设置全黑暗组、6 h光-暗组(非自然光-暗周期)、12 h光-暗组(自然光-暗周期), 每组设置3组平行组, 每组平行组样本量为20个, 即本实验共计180个样本。全黑暗组全程黑暗无光照; 6 h光-暗组以6 h光照开始再接着6 h完全黑暗反复交替进行(6 h光-暗组光照时间段为: 0~6 h, 12~18 h, 24~30 h, 36~42 h, 48~54 h, 60~66 h; 黑暗时间段为: 6~12 h, 18~24 h, 30~36 h, 42~48 h, 54~60 h, 66~72 h); 12 h光-暗组以12 h光照开始再接着12 h完全黑暗往复交替进行(12 h光-暗组光照时间段为: 0~12 h, 24~36, 48~60 h; 黑暗时间段为: 12~24 h, 36~48 h, 60~72 h); 实验周期均为72 h, 全黑暗组每隔6 h记录足丝分泌情况, 6 h光-暗组、12 h光-暗组在每次光照和黑暗条件结束后记录足丝分泌情况。
1.2.2 足丝首次附着率测定
企鹅珍珠贝在剪断旧足丝后, 可重新分泌新足丝发生附着。通过计算足丝首次附着率[13], 衡量企鹅珍珠贝的附着行为和足丝分泌时间段。足丝首次附着率=单位时间内足丝剪断后首次分泌新足丝的企鹅珍珠贝数量/企鹅珍珠贝样本量×100%。
1.2.3 足丝直径和拉力测定
72 h光照处理后, 收集企鹅珍珠贝的足丝, 使用Mustcam显微镜UM016(深圳市迈克视讯电子有限公司)对足丝直径进行测量。由于企鹅珍珠贝的足丝不是规则的圆柱形, 因此测量每组中单根足丝远端区域、中端区域、近端区域的直径。使用塑料夹片将足丝两端用胶水固定, 使用艾德堡推拉拉力器HP-10(乐清艾德堡仪器有限公司)对足丝中间区域的拉力进行测定。
1.3 数据统计分析
实验所得数据使用Excel 2016进行统计分析, 结果用平均值±标准差(Mean±SD)表示, 并作图。采用DPS 7.05软件对不同光-暗周期下的足丝首次附着率、足丝分泌数量、直径和拉力进行单因素试验统计分析, 最小显著差数法(LSD法)进行显著性分析, 差异显著水平为<0.05。
2 结果
2.1 光照和光-暗周期对足丝首次附着率的影响
2.1.1 光照对足丝首次附着率的影响
全黑暗组企鹅珍珠贝个体首次分泌足丝时间段集中在0~54 h, 6 h光-暗组企鹅珍珠贝个体首次分泌足丝时间段集中在0~48 h(图1)。6 h光-暗组在0~6 h (光照时间段)期间企鹅珍珠贝足丝首次附着率显著低于相同时间段全黑暗组足丝首次附着率(8.33%±2.89%)(< 0.05); 6 h光-暗组在6~12 h(黑暗时间段)期间首次分泌足丝的个体增加, 足丝首次附着率达到最大值(25.00%± 12.00%)。实验过程中, 6 h光-暗组在6个光照时间段, 均只出现少量个体或者无个体首次分泌足丝; 在6个黑暗时间段首次分泌足丝个体增加, 但与相同时间段全黑暗组足丝首次附着率无显著性差异(>0.05)。

图1 不同光-暗周期企鹅珍珠贝足丝每6 h足丝首次附着率
注: 不同字母表示有显著性差异(<0.05)
12 h光-暗组企鹅珍珠贝个体首次分泌足丝时间段集中在0~48 h(图2)。12 h光-暗组在3个光照时间段内均未发现首次分泌足丝的企鹅珍珠贝个体, 在0~12 h、24~36 h(光照时间段)期间, 12 h光-暗组足丝首次附着率显著低于相同时间段全黑暗组首次附着率(<0.05); 在黑暗时间段企鹅珍珠贝首次分泌足丝个体数量增加, 在12~24 h(黑暗时间段)期间, 12 h光-暗组企鹅珍珠贝足丝首次附着率达到最大值(26.67%±7.64%), 而全黑暗组在此期间足丝首次附着率为(5.00%±5.00%), 显著低于12 h光-暗组(<0.05)。

图2 不同光-暗周期企鹅珍珠贝足丝每12 h足丝首次附着率
注: 不同字母表示有显著差异(<0.05)
2.1.2 光-暗周期对足丝首次附着率的影响
在0~24 h时间段, 全黑暗组、6 h光-暗组、12 h光-暗组足丝首次附着率分别为(21.67%±2.89%)、(28.33%±15.28%)、(26.67%±7.64%), 三组无显著性差异(>0.05); 在24~48 h时间段, 全黑暗组、6 h光-暗组、12 h光-暗组足丝首次附着率分别为(16.67%± 7.64%)、(16.67%±7.64%)、(13.33%±7.64%), 三组无显著性差异(>0.05); 在48~72 h时间段, 全黑暗组足丝首次附着率为(5.00%±5.00%), 6 h光-暗组、12 h光-暗组无个体首次分泌足丝, 三组无显著性差异(>0.05) (图3); 说明不同光-暗周期不会影响企鹅珍珠贝足丝附着行为, 6 h光-暗组和12 h光-暗组在48 h后无新个体发生附着行为, 全黑暗组在48~72 h仍有新个体发生附着行为。

图3 不同光-暗周期企鹅珍珠贝每24 h足丝首次附着率
2.2 光照和光-暗周期对足丝分泌数量的影响
2.2.1 光照对足丝分泌数量的影响
全黑暗组在每个检测的时间段企鹅珍珠贝均有新足丝分泌, 66~72 h足丝分泌数量最多为(8.00± 5.00)根, 54~60 h足丝分泌数量最少。6 h光-暗组在光照时间段足丝分泌数量较少或者不分泌足丝, 在0~6 h、12~18 h、24~30 h、36~42 h、48~54 h(光照时间段)期间, 6 h光-暗组足丝分泌数量显著低于相同时间段全黑暗组足丝分泌数量(<0.05); 6 h光-暗组在黑暗时间段足丝分泌数量迅速增加, 42~48 h (黑暗时间段)足丝分泌量最多为(11.67±6.03)根, 在6~12 h、18~24 h、30~36 h、42~48 h、66~72 h(黑暗时间段)期间, 6 h光-暗组足丝分泌数量与相同时间段全黑暗组足丝分泌数量无显著性差异(>0.05), 在54~60 h(黑暗时间段)期间分泌量最少为(3.00± 1.00)根足丝, 显著高于相同时间段全黑暗组足丝分泌量(<0.05)(图4)。
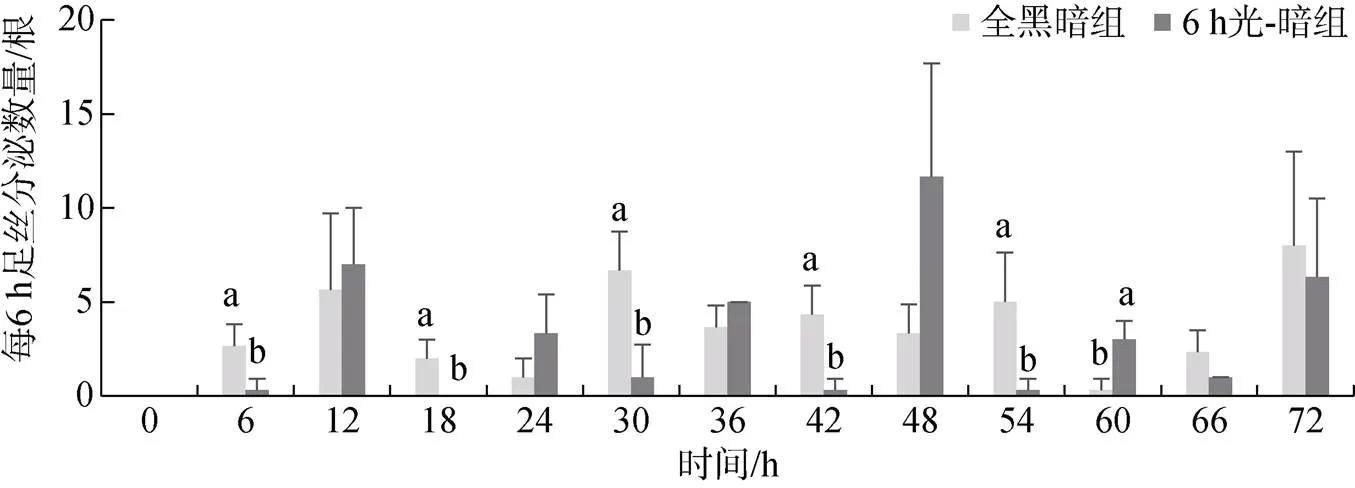
图4 不同光-暗周期企鹅珍珠贝每6 h足丝分泌数量
注: 不同字母表示有显著性差异(<0.05)
12 h光-暗组在光照时间段企鹅珍珠贝足丝分泌量较少或者不分泌足丝(图5), 在0~12 h和24~36 h (光照时间段)期间, 12 h光-暗组足丝分泌数量显著低于相同时间段全黑暗组足丝分泌数量[0~12 h: (8.33±3.21)根, 24~36 h: (10.33±2.08)根] (<0.05), 在48~60 h(光照时间段)期间, 12 h光-暗组足丝分泌数量与全黑暗组足丝分泌数量无显著性差异(>0.05); 12 h光-暗组在黑暗时间段, 足丝分泌数量增加, 36~48 h(黑暗时间段)足丝分泌最多, 分泌数量为(18±5.57)根, 12~24 h(黑暗时间段)足丝分泌最少, 分泌数量为(10.00±2.65)根, 均显著高于相同时间段全黑暗组足丝分泌数量[12~24 h: (3.00±1.00)根, 36~48 h: (7.67± 1.53)根] (<0.05)。

图5 不同光-暗周期条件下企鹅珍珠贝每12 h足丝分泌数量
注: 不同字母表示有显著性差异(<0.05)
2.2.2 光-暗周期对足丝分泌数量的影响
在0~24 h时间段, 全黑暗组、6 h光-暗组、12 h光-暗组足丝分泌数量分别为(11.33±4.16)根、(10.67± 3.79)根、(10.00±2.65)根, 三组无显著性差异(>0.05); 在24~48 h时间段, 全黑暗组、6 h光-暗组、12 h光-暗组足丝分泌数量分别为(18.00±2.65)根、(18.00± 8.19)根、(19.00±4.00)根, 三组无显著性差异(>0.05);在48~72 h时间段, 全黑暗组、6 h光-暗组、12 h光-暗组足丝分泌数量分别为(15.67±4.04)根、(10.67± 3.79)根、(15.00±6.24)根, 三组无显著性差异(>0.05) (图6); 说明不同光-暗周期未对企鹅珍珠贝足丝分泌数量造成较大影响。
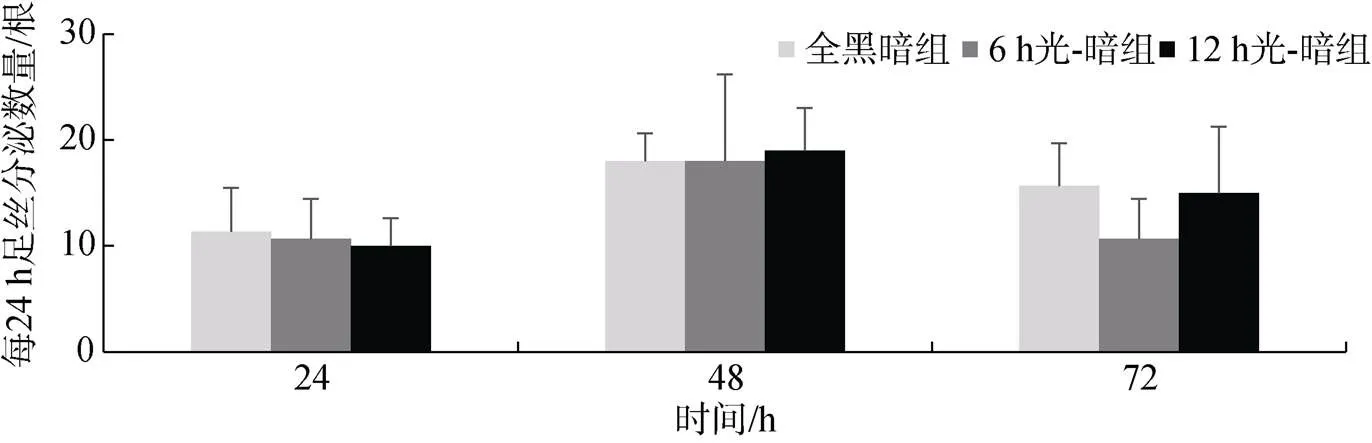
图6 不同光-暗周期企鹅珍珠贝每24 h足丝分泌数量
2.3 光-暗周期对足丝直径的影响
不同光-暗周期条件下, 三组企鹅珍珠贝足丝远端、中端、近端直径均无显著性差异(>0.05)(图7); 全黑暗组企鹅珍珠贝足丝远端直径(0.45±0.09) mm显著大于近端直径(0.38±0.09) mm(<0.05), 而在有光照的条件下, 足丝远端直径[6 h光-暗组: (0.48± 0.19) mm, 12 h光-暗组: (0.52±0.2) mm]、近端直径[6 h光-暗组: (0.37±0.12) mm, 12 h光-暗组: (0.40± 0.23) mm]无显著性差异(>0.05); 说明不同光-暗周期对企鹅珍珠贝足丝远端、中端、近端直径影响较小, 但全黑暗条件下企鹅珍珠贝足丝远端直径显著大于近端直径。

图7 不同光-暗周期企鹅珍珠贝足丝远端、中端、近端直径
注: 有相同字母代表无显著性差异(>0.05), 不同字母表示有显著性差异(<0.05)
2.4 光-暗周期对足丝拉力的影响
全黑暗组、6 h光-暗组、12 h光-暗组企鹅珍珠贝单根足丝拉力分别为(3.40±2.76) N、(2.68±1.10) N、(3.86±2.05) N(图8), 不同光-暗周期条件下, 三组企鹅珍珠贝单根足丝拉力无显著性差异(>0.05), 说明不同光-暗周期对企鹅珍珠贝足丝拉力无显著性影响。

图8 不同光-暗周期企鹅珍珠贝单根足丝拉力
3 讨论
企鹅珍珠贝主要是在黑暗中进行足丝分泌, 光照会强烈抑制足丝分泌, 光照条件下几乎无足丝分泌, 恢复黑暗条件后足丝分泌数量增加, 最多每小时增加(1.94±1.00)根, 这种现象可能与光照的“冲击”效应有关, 导致足丝分泌反应增强[13]。企鹅珍珠贝在光照和黑暗两种条件下足丝分泌数量的差异表明: 企鹅珍珠贝对光敏感。双壳纲动物的光敏感器, 主要包括两种类型: 有结构的和无结构[20-25], 扇贝的光敏感器(外套眼)得到广泛的研究[20, 23], 目前尚未对企鹅珍珠贝的光敏感性进行深入研究。Wu等人[26]研究了与企鹅珍珠贝亲缘关系相近的太平洋长牡蛎()的光敏感性, 当牡蛎暴露在光照下时, 牡蛎的开壳程度增加, 而黑暗条件下牡蛎的开壳程度减少。
大多数生物体都是生活在以24 h为周期明暗交替的环境中, 生物钟调节和优化细胞、器官、系统和行为的功能呈近日节律[27]。不同光-暗周期会影响生物体的生理、生化过程及行为[28], 在低等生物中, 昼夜节律周期与自然光-暗周期相匹配的基因型具有较高的适应性, 可以很好地适应环境[29]。小鼠的活动性周期与光-暗周期相适应, 不同光-暗周期会影响小鼠的生长速度, 并可能与能量代谢有关[30]。本研究中, 不同光-暗周期对企鹅珍珠贝足丝分泌、足丝直径和足丝拉力无显著性影响(>0.05)。
黄超敏[31]发现在自然光-暗周期(12 h光-暗周期)下, 野生翡翠贻贝()(壳高约7~11 cm, 样本数量35个)在足丝剪断后48 h内所有个体均会重新分泌新足丝, 足丝首次附着率为100%, 分泌数量较多, 足丝平均分泌数量在45~60根间; 马氏珠母贝()(1龄贝, 壳高约6~7 cm, 样本数量32个)在足丝剪断后48 h所有个体均有新足丝的分泌, 足丝首次附着率为100%, 48 h足丝平均分泌数量为12.13根; 企鹅珍珠贝(1龄贝, 壳高约12~13 cm, 样本数量30个)在足丝剪断48 h后有部分个体开始分泌足丝, 120 h后30个样品中18个样品分泌新足丝, 足丝首次附着率为60%; 野生珠母贝() (壳高约8~10 cm, 样本数量30个)在足丝剪断后120 h后没有新足丝分泌, 足丝首次附着率为0%, 且没有分泌足丝的珠母贝死亡率更高。本研究中在12 h光-暗周期条件下, 企鹅珍珠贝(1.5~2.0龄贝)60个样品在48 h内仅有25个样品分泌新足丝进行附着行为, 足丝首次附着率为41.67%, 共分泌了87根足丝, 48 h后无新增个体发生附着行为, 72 h足丝分泌数量为132根。与翡翠贻贝和马氏珠母贝相比, 48 h内企鹅珍珠贝足丝首次附着率较低, 且足丝分泌数量较少; 而48 h内野生珠母贝无足丝分泌, 说明足丝分泌存在物种差异。企鹅珍珠贝1.5~2.0龄贝足丝附着率比1龄贝足丝附着率低, 这种现象可能与贝的年龄和重量等有关。随着年龄的增加, 大珠母贝()分泌的足丝数量减少, 当重量足以承受水流引起的影响时, 就会停止分泌足丝[9]。剪去原有足丝的企鹅珍珠贝对新环境的适应能力较差, 需要消耗较长的时间脱落残留的旧足丝并寻找稳定基质重新分泌新足丝进行附着。没有新足丝生长的情况下, 企鹅珍珠贝无法稳定附着在基质上, 外部环境将会对个体造成较大影响, 可能会增加个体的死亡率。
足是企鹅珍珠贝稚贝的运动器官, 通过控制足肌群规律收缩而达到运动的目的; 在运动过程中同时也伴随着旧足丝的脱落和新足丝的产生, 足丝对企鹅珍珠贝的运动起辅助作用。在黑暗条件下, 企鹅珍珠贝的移动距离和位移距离都显著高于光照条件下, 且移动过程中较小的企鹅珍珠贝稚贝(壳高: 7.2~12.7 mm)表现出较高的足丝再附着率, 这可能表明足丝形成活动的增加[17]。强光已经被充分证明可以减少贻贝的运动[12], 而Toomey等[16]和Coons等[32]并没有发现这种行为, 但是观察到斑马贻贝更倾向于远离光源, 斑马贻贝在光照下的运动距离比在黑暗中的远, 它们的移动方向都是远离光源。在黑暗环境中, 斑马贻贝附着的数量更多[15], 产生更多的足丝线, 因此附着能力更强[18]。光照是影响海洋无脊椎动物幼虫定居地选择的重要因素[33], 地中海贻贝()的幼虫在接近定居地时呈负趋光性[34]。因此我们猜想在黑暗条件下足丝分泌量增加将有助于企鹅珍珠贝选择更加安全的环境, 例如更深和更隐蔽的场所, 并快速附着在基质上, 以此来提供更好的保护, 从而抵御捕食者和进行迁移活动; 而且在黑暗环境中, 企鹅珍珠贝远端直径显著大于近端直径(<0.05, 图7), 足丝近端靠近足部, 远端靠近黏附盘, 直径较小的近端使得在足组织的有限区域可以分泌大量的足丝, 而直径较大的远端促进内部纤维伸展以形成较大的黏附盘, 这可能有益于足丝的形成和黏附; 虽然不同光-暗周期对单根足丝的拉力无显著影响(>0.05), 但是黑暗环境中产生更多的足丝, 有益于足丝与基质更加牢固的结合[35]。
4 结论
不同光-暗周期并不会影响企鹅珍珠贝足丝附着在基质表面的数量和强度, 但是光照对足丝的分泌有着强烈的抑制作用, 将不利于其对基质的黏附; 因此野外海区吊养时, 选择黑暗的环境可以促进企鹅珍珠贝足丝的分泌, 有利于足丝迅速附着, 减少吊养过程中因足丝分泌延迟导致的个体脱落问题, 这对提高企鹅珍珠贝养殖成活率具有积极意义。
[1] 郭奕惠, 范嗣刚, 黄桂菊, 等. 企鹅珍珠贝研究现状与展望[J]. 江苏农业科学, 2014, 42(2): 195-198.
GUO Yihui, FAN Sigang, HUANG Guiju, et al. Research status and prospect of[J]. Jiangsu Agricultural Sciences, 2014, 42(2): 195-198.
[2] MARTÍNEZ-FERNÁNDEZ E, ACOSTA-SALMÓN H, RANGEL-DÁVALOS C. Ingestion and digestion of 10 species of microalgae by winged pearl oyster(Gould, 1851) larvae[J]. Aquaculture, 2004, 230(1/4): 417-423.
[3] 梁飞龙, 谢绍河, 林伟财. 企鹅珍珠贝珍珠培育技术的研究现状[J]. 水产养殖, 2014, 35(4): 37-41.
LIANG Feilong, XIE Shaohe, LIN Weicai. Progress on pearl production of pearl oyster[J]. Journal of Aquaculture, 2014, 35(4): 37-41.
[4] KAMINO K. Underwater adhesive of marine organisms as the vital link between biological science and material science[J]. Marine Biotechnology, 2008, 10(2): 111-121.
[5] WINKLE W V. Effect of environmental factors on byssal thread formation[J]. Marine Biology, 1970, 7(2): 143-148.
[6] O'CONNOR W A, LAWLER N F. Salinity and temperature tolerance of embryos and juveniles of the pearl oyster,Röding[J]. Aquaculture, 2004, 229(1): 493-506.
[7] CRISP D J, WALKER G, YOUNG G A, et al. Adhesion and substrate choice in mussels and barnacles[J]. Journal of Colloid and Interface Science, 1985, 104(1): 40-50.
[8] CARRINGTON E. Seasonal variation in the attachment strength of blue mussels: causes and consequences[J]. Limnology & Oceanography, 2002, 47(6): 1723-1733.
[9] TAYLOR J J, ROSE R A, SOUTHGATE P C. Byssus production in six age classes of the silver—lip pearl oyster,(Jameson)[J]. Journal of Shellfish Research, 1997, 16(1): 97-101.
[10] VASQUEZ H E, ZHENG X, ZHAN X, et al. Byssus growth in winged pearl oyster(Röding, 1798)[J]. Journal of Shellfish Research, 2018, 37(3): 515-519.
[11] MCFARLAND W N. Light in the sea—correlations with behaviors of fishes and invertebrates[J]. American Zoologist, 1986, 26(2): 389-401.
[12] KOBAK J, NOWACKI P. Light—related behaviour of the zebra mussel (, Bivalvia)[J]. Fundamental and Applied Limnology, 2007, 169(4): 341-352.
[13] VASQUEZ H E, ZHENG X, ZHAN X, et al. The effect of light on the locomotion and byssal reattachment of winged pearl oyster(Röding, 1798) juveniles[J]. Journal of Shellfish Research, 2018, 37(5): 1061-1066.
[14] ZHANG Y, STEVENS S E, WONG T Y. Factors affecting rearing of settled zebra mussels in a controlled flow-through system[J]. The Progressive Fish-Culturist, 1998, 60(3): 231-235.
[15] KOBAK J. Light, gravity and conspecifics as cues to site selection and attachment behaviour of juvenile and adultPallas[J]. Journal Molluscan Studies, 2001, 67(2): 183-189.
[16] TOOMEY M B, MCCABE D, MARSDEN J E. Factors affecting the movement of adult zebra mussels ()[J]. Journal of the North American Benthological Society, 2002, 21(3): 468-475.
[17] KOBAK J. Geotactic behaviour of(Bivalvia)[J]. Malacologia, 2006, 48(2): 305-308.
[18] KOBAK J. Factors influencing the attachment strength of(Bivalvia)[J]. Biofouling, 2006, 22(3/4): 141-150.
[19] URYU Y, IWASAKI K, HINOUE M. Laboratory experiments on behaviour and movement of a freshwater mussel,(Dunker)[J]. Journal of Molluscan Studies, 1996, 62(3): 327-341.
[20] MORTON B. The function of pallial eyes within the Pectinidae, with a description of those present in[J]. Geological Society London Special Publications, 2000, 177(1): 247-255.
[21] MORTON B, PEHARDA M. The biology and functional morphology of(Bivalvia: Arcidae) from the Adriatic Sea, Croatia, with a discussion on the evolution of the bivalve mantle margin[J]. Acta Zoologica, 2008, 89(1): 19-28.
[22] ADAL M N, MORTON B. The fine structure of the pallial eyes of(Bivalvia: Anomalodesmata: Pandoracea)[J]. Journal of Zoology, 1973, 170(4): 533-556.
[23] BARBER V C, EVANS E M, LAND M F. The fine structure of the eye of the mollusc[J]. Z Zellforsch Mikrosk Anat, 1967, 76(3): 295-312.
[24] MALKOWSKY Y, GTZE M C. Impact of habitat and life trait on character evolution of pallial eyes in Pectinidae (Mollusca: Bivalvia)[J]. Organisms Diversity & Evolution, 2014; 14(2): 173-185.
[25] RAMIREZ M D, SPEISER D I, PANKEY M S, et al. Understanding the dermal light sense in the context of integrative photoreceptor cell biology[J]. Visual Neuroscience, 2011, 28(4): 265-279.
[26] WU C L, WANG J, YANG Y J, et al. Adult Pacific oyster () may have light sensitivity[J]. PloS One, 2015, 10(10): e0140149.
[27] VOIGT R M, FORSYTH C B, GREEN S J, et al. Circadian rhythm and the gut microbiome[J]. International Review of Neurobiology, 2016, 131: 193-205.
[28] DJERIDANE Y, EURIN J, TOUITOU Y. Daily variation in the concentration of neuropeptide Y in the rat atrium: effects of age and photoperiodic conditions[J]. Peptides, 2004, 25(7): 1153-1157.
[29] OUYANG Y, ANDERSSON C R, KONDO T, et al. Resonating circadian clocks enhance fitness in cyanobacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(15): 8660-8664.
[30] 江舟, 刘延友, 郭莉等. 不同周期光暗循环对小鼠生长的影响[J]. 西部医学, 2005, 17(2): 97-98, 101.
JIANG Zhou, LIU Yanyou, GUO Li, et al. Effects of light-dark cycles on growth of mice[J]. Medical Journal of West China, 2005, 17(2): 97-98, 101.
[31] 黄超敏. 四种海水双壳贝类腹足和足丝的比较解剖研究[D]. 海口: 海南大学, 2011.
HUANG Chaomin. Studies on the comparative anatomy of four marine Bivalve molluscs gastropods and byssus[D].Haikou: Hainan University, 2011.
[32] COONS K, MCCABE D J, MARSDEN J E. The effects of strobe lights on zebra mussel settlement and movement patterns[J]. Journal of Freshwater Ecology, 2004, 19(1): 1-8.
[33] ETTINGER E P, WHALAN S, BATTERSHILL C N, et al. A hierarchy of settlement cues influences larval behaviour in a coral reef sponge[J]. Marine Ecology Progress, 2008, 365(1): 103-113.
[34] CARL C, POOLE A J, VUCKO M J, et al. Optimising settlement assays of pediveligers and plantigrades of[J]. Biofouling, 2011, 27(8): 859-868.
[35] LI S G, XIA Z Q, CHEN Y Y, et al. Byssus structure and protein composition in the highly invasive fouling mussel[J]. Frontiers in Physiology, 2018, 9: 418-431.
Effects of different light-dark cycles on byssus attachment in the winged pearl oyster
YANG Lei1, 2, YAN Jie1, 2, CHEN Yi1, 2, ZHANG Jia-yi1, 2, ZHAN Xin1, 2
(1. Ocean College, Hainan University, Haikou 570228, China; 2. State Key Laboratory of Marine Resource Utilization in South China Sea, Hainan University, Haikou 570228, China)
The winged pearl oyster () is a large marine commercially valued bivalve that produces a half pearl. This oyster relies on a strong byssus to anchor itself to the substrate and resist the effects of water flow and predators. The byssal attachment and its properties are affected by environmental factors. In this study, three light–dark cycles (dark group, 6-h light–dark cycle group, and 12-h light–dark cycle group) were used to investigate the effects of the light–dark cycle on byssus attachment, the number of byssuses, the diameter of byssus, and the breaking force of the byssus in. The results showed that under different light conditions, the first byssal attachment rate and the number ofbyssuses in the 6-h and 12-h light–dark groups were significantly fewer than those in the dark group (0.05). Light strongly inhibited secretion of the byssus, with an inhibitory rate of up to 100%. The number of new byssusesincreased to (1.94±1.00) per hour under dark condition. However, no significant differences in the first byssal attachment rate or the number of byssuses at 0–24, 24–48, or 48–72 h were observed under the different light–dark cycle groups in(0.05). The diameter of the byssus distal region (0.45±0.09) mm and the diameter of the byssus proximal region (0.38±0.09) mm were significantly different in the dark group than the light groups (0.05), indicating that the diameter of the byssus changed in the dark group. However, no significant differences in the diameter of the byssus distal region, the diameter of the byssus middle region, or the diameter of the byssus proximal region were observed under the different light–dark cycle groups in(0.05). In the dark group, the 6-h light–dark cycle group, and the 12-h light-dark cycle group, the single byssus breaking forces were (3.40±2.76), (2.68±1.10), and (3.86±2.05) N, respectively, and no differences were detected among the three groups (0.05). Therefore, light strongly inhibited the secretion of the byssus. Thebyssus could be re-secreted under the dark condition, and the single byssus breaking force and diameter of the new byssus were unaffected. No significant differences in attachment, diameter, or breaking force of the byssus were observed under the different light–dark cycles in. These results provide basic data forculture and round pearl production.
; light–dark cycle; byssus attachment; byssus property
Oct. 27, 2021
S968.31
A
1000-3096(2022)10-0059-09
10.11759/hykx20211027001
2021-10-27;
2021-12-06
国家自然科学基金项目(31860727)
[National Natural Science Foundation of China, No. 31860727]
杨蕾(1997—), 女, 江西南昌人, 硕士研究生, 主要从事贝类遗传育种研究, E-mail: 1622830795@qq.com; 战欣(1981—),通信作者, 副教授, 主要从事贝类遗传育种研究, E-mail: zhanxinuni@ 163.com
(本文编辑: 杨 悦)

