环境因子对小刀蛏稚贝生长和存活的影响
王永旺, 于瑞海, 李春华, 李海昆, 刘 洋
环境因子对小刀蛏稚贝生长和存活的影响
王永旺1, 2, 于瑞海1, 李春华1, 李海昆1, 刘 洋2
(1. 中国海洋大学海水养殖教育部重点实验室, 山东 青岛 266003; 2. 青岛国信海洋牧场发展有限公司, 山东 青岛 266200)
采用单因子分析方法, 以小刀蛏为材料, 研究了不同盐度、温度、底质及饵料对小刀蛏稚贝生长和存活的影响。实验结果表明: 小刀蛏稚贝具有较强的盐度耐受性, 可以在较大的盐度变动范围内生长和存活; 小刀蛏稚贝生长和存活的适宜盐度范围为15~35, 最适盐度范围为20~25; 适宜的温度范围为16~28 ℃, 最适的温度范围为24~28 ℃; 随着盐度和温度的增加, 小刀蛏稚贝的生长率和存活率均呈先升高后降低的变化趋势。底质是小刀蛏生长和存活的必要环境条件, 且小刀蛏对底质环境具有明显的选择性, 稚贝以海泥底质最佳, 实验条件下海泥底质组生长率和存活率显著高于半泥半砂底质和细粉砂底质。不同饵料对稚贝的培育效果不同, 角毛藻和金藻的投喂效果最好, 稚贝生长率和存活率最高, 其次为扁藻组, 小球藻组最差。研究结果可为小刀蛏人工培育技术的优化提供参考依据。
小刀蛏; 稚贝; 环境因子; 生长; 存活
小刀蛏()隶属软体动物门(Mollusca)双壳纲(Bivalvia)帘蛤目(Veneroida)刀蛏科(Cultellidae), 在我国南北海均有分布[1]。小刀蛏软体部肉味鲜美, 营养丰富并具有一定的保健作用, 深受消费者喜爱, 价格是缢蛏的2~3倍以上。近年来由于捕捞强度增大、近海环境污染等因素的影响, 小刀蛏自然资源量逐渐减少, 并且捕捞个体规格偏小, 因此开展人工育苗工作对小刀蛏种质资源保护及开发养殖新品种具有重要意义。
盐度、温度、底质和饵料是贝类生长存活的重要环境因子, 近年来已有很多学者在此方面展开研究。温度和盐度是海洋生物最为重要的环境因子[2], 影响着海洋贝类的生长、发育和存活, 有关于温度和盐度对稚贝生长及存活方面的研究在缢蛏[3]、大竹蛏[4]、菲律宾蛤仔[5]、大珠母贝[6]等多个海洋贝类中已报道; 埋栖型贝类对底质的要求十分严格并且对底质具有一定的选择性[7-8], 张涛等[9]报道了硬壳蛤在砂质或含砂较多的底质中具有较高的成活率和日生长率; 海洋单细胞藻类是双壳类的最佳饵料, 但不同的饵料对贝类幼体的饵料效果不同[10], 对于泥蚶和缢蛏来说, 球等鞭金藻和角毛藻的投喂效果要好于青岛大扁藻、微绿球藻和绿色巴夫藻[11]。
目前, 关于小刀蛏的研究主要集中于营养成分分析、遗传多样性、系统发育、繁殖生物学[12-17]等方面, 在苗种繁育方面[18-19]只进行了初步研究。稚贝培育是小刀蛏人工育苗的重要环节, 关系到单位水体出苗量, 目前对其人工育苗中稚贝培育适宜环境条件的研究仍未见报道, 迫切需要解决小刀蛏稚贝培育的各种环境条件, 以实现小刀蛏育苗的规模化生产。为此, 本文通过研究不同盐度、温度、底质和单胞藻对小刀蛏稚贝生长及存活的影响, 探索了小刀蛏稚贝生长发育的适宜环境条件, 旨在缩短稚贝培育时间, 降低稚贝的死亡率, 提高单位水体稚贝的出苗量, 为小刀蛏的规模化人工繁育提供理论指导和基础资料。
1 材料和方法
1.1 材料
2019年6月从东营市沿海采集小刀蛏亲贝作为繁育群体, 在莱州市长渔水产有限公司进行人工繁育, 幼虫附着变态后在水泥池中继续培育至一定大小。2019年7月选取同批次培育的小刀蛏稚贝进行实验。在实验分组前, 随机抽取50个稚贝测量壳长指标。
1.2 实验设计及方法
1.2.1 盐度实验
实验设置7个盐度梯度, 分别为10、15、20、25、30、35、40。低盐海水使用自然海水与充分曝气的自来水配制, 高盐海水通过向自然海水中添加海水晶再经脱脂棉过滤配制而成。实验在60 L的水族箱(长´宽´高分别为0.5 m´0.3 m´0.4 m, 下同)中进行, 水族箱底部预先铺设2~3 mm海泥底质。每个实验组设置3个重复组, 每个水族箱中放入1 000粒稚贝进行实验。采用盐度骤变的方式进行实验, 将小刀蛏稚贝直接放入设定好的盐度梯度。实验时间15 d。实验期间日常管理: 水温为22~24 ℃, 每天换水2次, 每次换水1/2, 混合投喂球等鞭金藻、小球藻和扁藻, 投饵量为4´104个/(mL·d), 依照稚贝的摄食情况及水体中的残饵量适当调整投喂量。饵料投喂前预先调整至各组预设盐度, 防止因投饵造成盐度变动。
1.2.2 温度实验
实验分别设置5个温度组, 分别为16、20、24、28、32 ℃。实验在60 L水族箱中进行, 每组均设3个重复组, 每个处理组放入1 000粒稚贝。采用温度渐变方式进行实验, 温度变化为2 ℃/h; 低温组通过冷水机进行降温, 高温组采用加热棒加热进行升温。实验期间, 底质为海泥底质(厚度2~3 mm), 盐度25, 日常管理及投饵同1.2.1, 实验时间15 d。
1.2.3 底质实验
实验共设置无底质对照组和3种底质实验组, 分别为海泥底质, 半泥半砂底质、细粉砂底质。海泥取自于莱州自然海区, 用淡水冲洗后取悬浮海泥晒干并用150目筛绢过滤后备用; 细粉砂用150目筛绢分筛; 半泥半砂底质由海泥和细粉砂按照重量1︰1比配制而成。每种底质在经淡水浸泡、高温暴晒后方可使用。实验在60 L水族箱中进行, 每组底质厚度均为2~3 mm, 每组放入1 000个稚贝, 每个处理设置3个重复组。实验水温22~24 ℃, 盐度25, 日常管理及投饵同1.2.1, 实验时间为15 d。
1.2.4 饵料实验
实验共设置4个处理组, 分别为小球藻()、球等鞭金藻()、牟氏角毛藻()、扁藻()。每个实验均设置3个重复组, 用60 L的水族箱进行实验, 每个实验组放1 000粒稚贝。底质为海泥底质, 实验水温22~24 ℃, 盐度为25, 日常管理及投饵同1.2.1, 实验时间为15 d。
1.3 数据统计与处理
1.3.1 数据统计
存活率(%)=(实验结束时存活的稚贝数/实验开始时稚贝数)´100。稚贝以贝壳张开作为死亡标准。
壳长日增长率的测定:
=(1–0)/, (1)
式中,为壳长日增长率,1为结束时壳长(μm),0为开始时壳长,为实验天数。实验用显微镜进行拍照, 并用Image J进行壳长测量。
1.3.2 数据处理
使用Excel对数据进行汇总, 并用SPSS22.0分析软件对数据进行单因素方差分析; 用Duncan法进行多重比较, 检验数据间的差异显著性。
2 结果与分析
2.1 小刀蛏稚贝对不同盐度的耐受力
小刀蛏稚贝在不同盐度下的活动状况明显不同。在盐度10和盐度40组, 稚贝活力差, 双壳紧闭, 不潜砂。在盐度15~35组中, 稚贝活力较强, 不断伸出足和水管, 通过足的伸缩进行运动并寻找合适位置进行钻潜。将稚贝放置于显微镜下观察可发现, 盐度10和盐度40组稚贝心脏跳动缓慢, 水管紧闭, 足出现不同程度的萎缩; 盐度15~35组稚贝心脏跳动有力且不断伸出足和水管, 活力较强。图1为解剖镜下小刀蛏潜砂稚贝与未潜砂稚贝的对比图, 实验观察到未潜砂个体在2~5 d内逐渐死亡。

图1 小刀蛏潜砂稚贝与未潜砂稚贝
注: 1为未潜砂稚贝, 2为潜砂稚贝
2.2 不同盐度对稚贝生长和存活的影响
实验结束时不同盐度组的稚贝壳长如图2所示。因盐度10和盐度40组稚贝在2 d内全部死亡, 因此数据分析中不包含这两组数据。随着盐度的增加, 小刀蛏稚贝壳长表现为先升高后降低。盐度25和盐度20组壳长最大, 显著高于盐度15、30、35组(<0.05)。

图2 不同盐度下稚贝壳长的生长
注: 相同字母表示组间差异不显著(>0.05), 不同字母表示组间差异显著(<0.05)。
盐度对小刀蛏稚贝的存活率和日生长率有显著影响。稚贝在盐度10和盐度40中不能存活, 在盐度40中, 稚贝在1 d内全部死亡; 在盐度10中, 稚贝在第2天全部死亡。盐度15~35, 随着盐度增加, 稚贝存活率和生长率均先升高后降低, 盐度25存活率和生长率最高, 盐度35存活率和生长率最低(图3)。
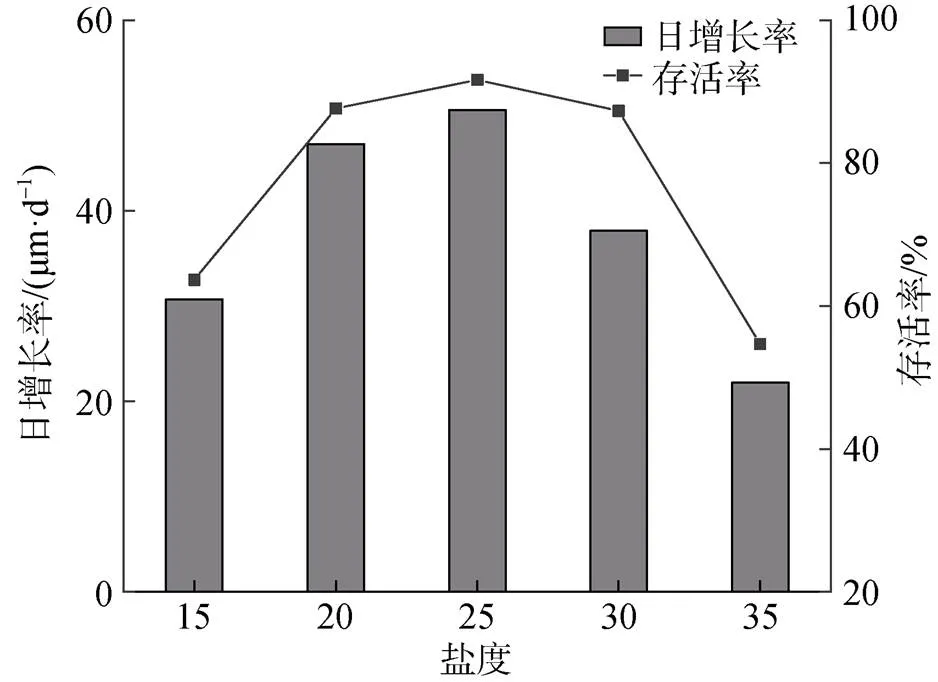
图3 不同盐度下稚贝壳长的日增长率和存活率
2.3 温度对稚贝生长和存活的影响
稚贝在不同温度下的生长情况如图4所示。小刀蛏稚贝的壳长在28 ℃达到最大, 随着温度的降低, 壳长逐渐减小。32 ℃与28 ℃相比, 稚贝的壳长显著降低(<0.05)。
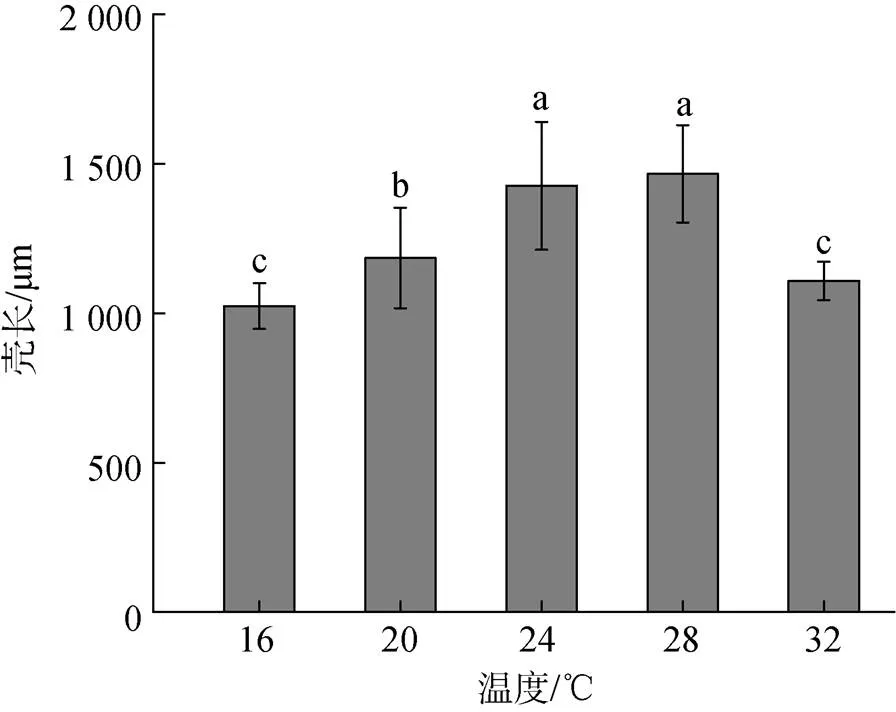
图4 不同温度下稚贝壳长的生长
注: 相同字母表示组间差异不显著(>0.05), 不同字母表示组间差异显著(<0.05)。
温度实验结果表明, 小刀蛏稚贝耐低温能力大于耐高温能力, 如图5所示,温度16 ℃组存活率为75%, 温度32 ℃组为55%, 两者之间差异显著(<0.05)。温度20、24、28 ℃存活率最高, 三者之间差异不显著(>0.05)。随着温度升高, 稚贝的生长率先升高后降低, 温度28 ℃时日生长率最大, 超过28 ℃时生长率下降。
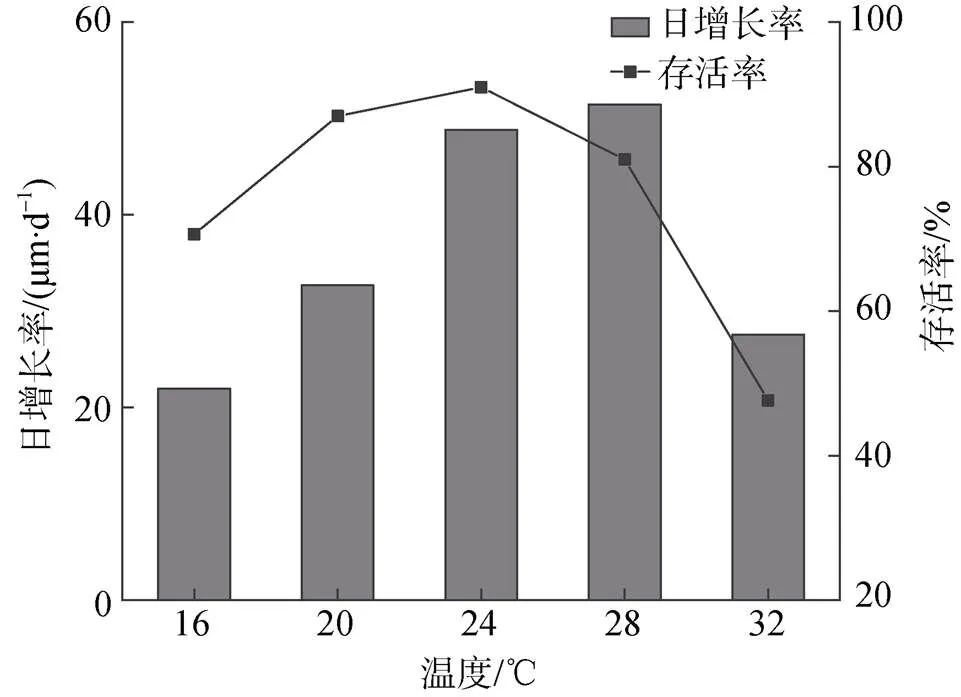
图5 不同温度下稚贝的日增长率和存活率
2.4 不同底质对稚贝生长和存活的影响
不同底质对小刀蛏稚贝生长影响显著。如图6所示, 不同底质小刀蛏稚贝壳长之间差异显著(<0.05), 海泥底质组小刀蛏壳长最大, 其次为半泥半砂组和细粉砂组, 无底质组壳长最小。

图6 不同底质条件下稚贝壳长的生长
注: 相同字母表示组间差异不显著(>0.05), 不同字母表示组间差异显著(<0.05)。
实验结果如图7所示。无底质组存活率和生长率最低, 实验过程中观察到无底质组在第10 d出现大规模死亡, 双壳张开, 稚贝堆积在一起, 最终存活率仅为7.6%。稚贝对底质具有明显的选择性, 随着海泥比例的降低, 稚贝的存活率和生长率逐渐下降。海泥底质中存活率和生长率最高, 为90%和50.02 μm/d, 细粉砂底质中存活率和生长率最低。
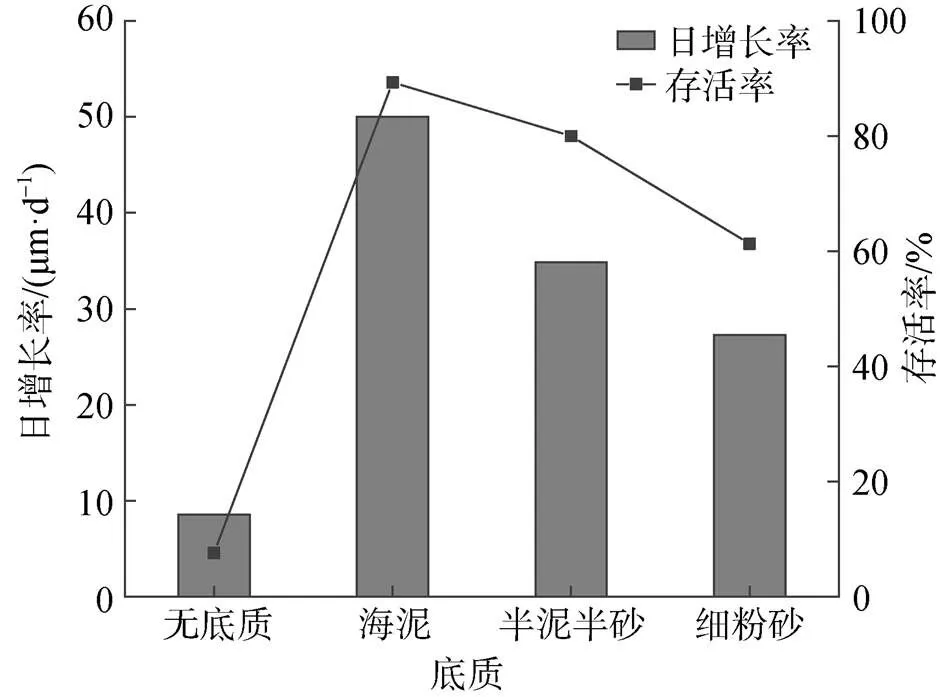
图7 不同底质条件下稚贝的日增长率和存活率
2.5 饵料种类对稚贝生长和存活的影响
如图8所示, 单胞藻对稚贝壳长生长影响显著。角毛藻组和金藻组壳长最大分别为1 480 μm和1 443 μm, 两者之间差异不显著(>0.05), 与扁藻组和小球藻组差异显著(<0.05); 其次为扁藻组, 小球藻组壳长最小, 两者之间差异显著(<0.05)。
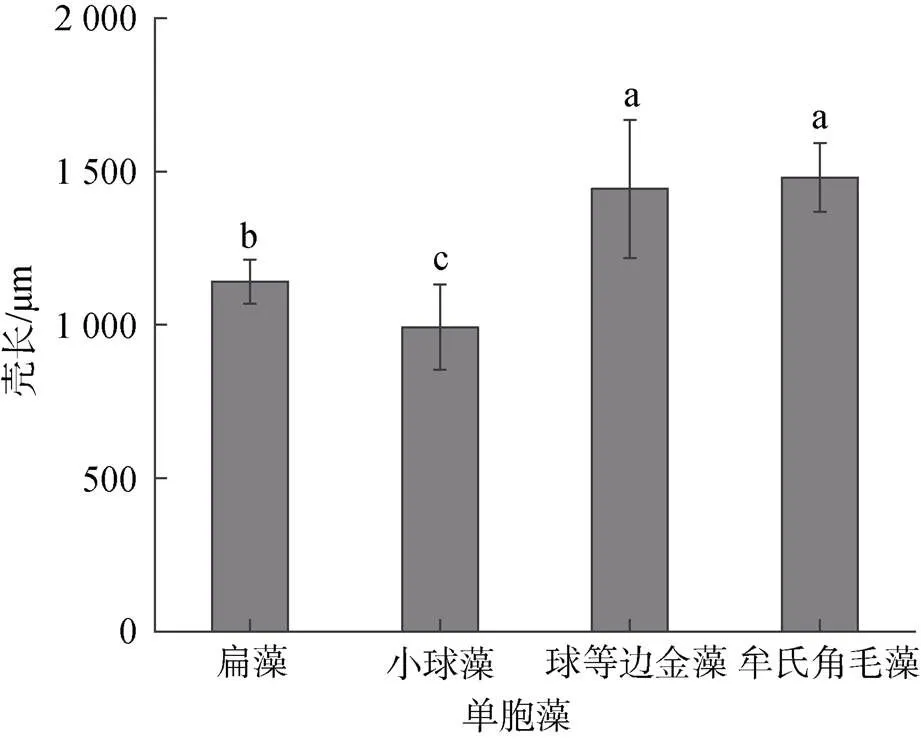
图8 单胞藻对稚贝壳长生长的影响
注: 相同字母表示组间差异不显著(>0.05), 不同字母表示组间差异显著(<0.05)。
单胞藻种类对小刀蛏稚贝日增长率和存活率影响差异显著。从日增长率看, 角毛藻组和金藻组生长率最大, 其次为扁藻组, 小球藻组日增长率最小。从存活率看, 金藻组和角毛藻组较高, 其次为扁藻组, 小球藻组存活率最低(图9)。
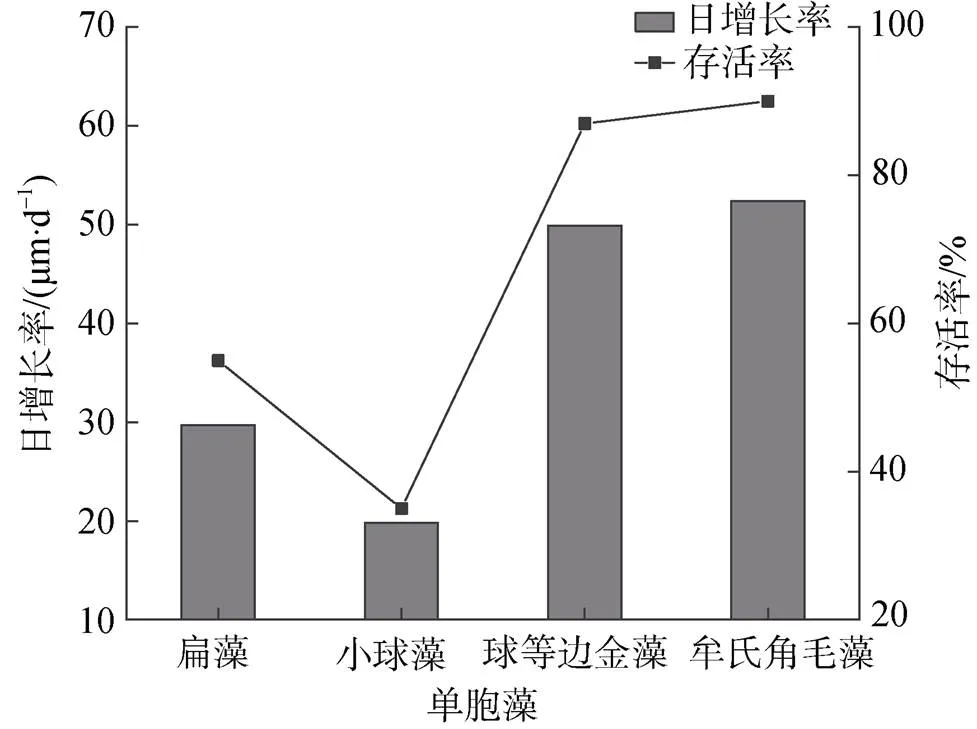
图9 单胞藻对稚贝日增长率和存活率的影响
3 讨论
3.1 盐度对稚贝生长和存活的影响
生物体对环境的适应能力受多种因素共同影响, 其中温度和盐度是两个重要的因素, 他们共同影响着生物体的生长、发育和存活。已有研究结果表明, 只有当温度或盐度其中之一接近动物耐受性极限时, 才显现出明显的联合效应[20]。本研究通过单因子实验, 将两者之一控制在适宜范围内, 因此本实验中温度和盐度不存在明显的相互影响。
贝类属于变压动物, 其对渗透压的调节能力直接决定了贝类适宜的生长和存活环境[21]。当外界盐度环境的变化幅度大于稚贝自身渗透压调节能力时, 就会降低稚贝的代谢速率和代谢效率, 并最终导致稚贝的大量死亡[22]。本研究结果表明小刀蛏属于广盐性贝类, 适宜的盐度范围为15~35, 最适盐度范围为20~25。之前已有许多贝类盐度耐受性的研究结果表明适宜的盐度有利于贝类的生长存活, 例如大竹蛏稚贝在最适盐度范围20~28时具有较高的成长率和存活率[4], 缢蛏稚贝在最适盐度12.4~16.3时生长和存活最好[3]。但此结果比于瑞海等[18]之前的研究结果高, 主要原因为本实验采用盐度骤变的方式, 此前实验采用盐度渐变的方式, 而当盐度幅度短时间变化过大时, 机体的应激反应难以适应短时间大幅度的渗透压改变而导致了低盐组幼虫死亡率增大[23]。此外小刀蛏稚贝的耐低盐能力大于耐高盐能力, 这可能与其生活在有淡水注入的沿海河口地区, 其已经适应因为降雨、河水径流增大导致的低盐环境。过高或过低的盐度会引起稚贝生长缓慢。此种现象在同为广盐性贝类的青蛤、珠母贝、彩虹明樱蛤也有报道[24-26]。当盐度剧烈变化时, 海洋贝类会封闭外套膜, 抑制与外界环境的水交换, 通过调节体腔内渗透压, 降低呼吸代谢等集体活动抵抗外界盐度变化[27-28]。这些调节活动会降低稚贝摄食量, 并且增加机体的能量消耗, 使稚贝用于生长的能量降低, 最终导致生长缓慢。因此适宜的盐度有利于稚贝的生长和存活。
3.2 温度对稚贝生长和存活的影响
海洋贝类属于变温动物, 新陈代谢水平较低、温度调节机能不完善, 因此外界环境温度对其影响较大。当环境温度不适或变动较大时会影响贝类的新陈代谢、摄食消化和免疫防御能力, 从而对其生长、发育和存活产生消极影响[29]。本研究表明, 小刀蛏稚贝适宜的生长温度为20~24 ℃, 适宜的存活温度为16~28 ℃。在适宜的生长温度区间内高温更有利于稚贝的生长, 但存活率略有下降, 这与尤仲杰等[30]对泥蚶的研究结果类似。温度对稚贝的摄食率及血细胞和酶的活性有显著影响[31-32]。低温时, 稚贝摄食率低, 消化水平较差, 导致稚贝摄取的能量不能满足生长的需求; 水温高时, 幼虫摄食活跃, 体内酶的活力增强, 对饵料的摄食和消化速度加快, 幼虫生长迅速。但温度过高时, 会造成贝类血细胞的死亡并抑制体内酶的活性, 减弱机体的防御能力; 另一方面, 高温会加速水中致病原生动物及细菌的滋生, 增加耗氧[33], 这些方面都会对贝类的摄食、生长和存活造成不利影响。
3.3 底质对小刀蛏稚贝生长及存活的影响
小刀蛏属于埋栖性贝类, 底质是其生活环境的重要组成部分。小刀蛏苗种生产中, 需进行倒池、更换底质及疏苗工作, 这就要求底质的粒径合适, 易于将底质和稚贝分离开并且底质中成分不应对海水质量造成影响, 因此本实验选取了海泥和细粉砂作为实验底质。实验结果显示, 小刀蛏稚贝对底质具有明显的选择性。无底质生长率和存活率极低, 显然不适合于小刀蛏稚贝的培育。海泥底质中稚贝的生长率和存活率最高, 随着海泥含量的减少, 稚贝的生长率和存活率会降低。这主要因为小刀蛏稚贝是埋栖生活, 底质含泥量多对它挖洞较为合适[34]。有文献报道底质厚度对埋栖型贝类稚贝具有显著影响[4], 笔者认为底质厚度应大于稚贝壳长, 以便为其提供一定的生长空间。因本实验所用稚贝规格较小, 不利于对底质厚度进行量化, 有关详细数据有待进一步研究。
3.4 饵料种类对小刀蛏稚贝生长存活的影响
饵料的数量和质量对稚贝的生长和存活影响显著。海洋单细胞藻类是双壳类幼虫和稚贝的最佳饵料[35], 但不同单胞藻的营养价值不同, 并且不同滤食性贝类对食物的大小和质量均有选择性[10, 36], 因此选择合适的单胞藻种类对于稚贝的人工培育至关重要。本实验选取了北方育苗场常用的4种单胞藻饵料进行实验, 以期寻找小刀蛏稚贝培育的适宜饵料。实验结果显示, 角毛藻组和金藻组稚贝生长率和存活率最高, 是小刀蛏稚贝的适宜饵料; 扁藻组和小球藻稚贝生长率和存活率较差, 不适宜作为小刀蛏稚贝的饵料, 这一结果与马斌等[37]对缢蛏的研究结果相似。本课题组之前的研究结果表明, 在小刀蛏浮游幼虫阶段金藻相较角毛藻有明显的优势, 但是对于已经变态完成的稚贝来说, 金藻相对于角毛藻并没有优势, 出现这种现象的原因可能是双壳贝类幼体发育的不同时期对于脂质营养的需求不同, 并且硅藻中较丰富的胆甾醇对于稚贝的生长起到一定的促进作用。扁藻个体较大, 且运动能力较强, 不宜被稚贝摄食; 小球藻细胞壁较厚, 不宜被稚贝消化, 因此扁藻和小球藻不宜作为小刀蛏的主要饵料。许多研究结果表明, 混合投喂时可以弥补单一饵料的营养缺陷, 使幼虫获得更全面的营养, 对幼体的生长更有力, 因此在实际生产中可以将金藻、角毛藻和扁藻混合投喂, 以达到更好的育苗效果。
4 结论
本文研究了不同盐度、温度、底质和单胞藻对小刀蛏稚贝生长、存活的影响。结果发现, 小刀蛏稚贝属于广盐性贝类, 具有较强的盐度适应性, 可以在较大的盐度变动范围内生长和存活; 小刀蛏稚贝生长和存活的适宜盐度为15~35, 最适盐度为20~25; 适宜温度为16~28 ℃, 最适温度为24~28 ℃; 底质是小刀蛏稚贝生长和存活的必要条件, 且稚贝对底质具有明显的选择性, 最适宜底质为海泥底质; 最适宜饵料为金藻和角毛藻。该实验结果为小刀蛏稚贝的规模化生产打下坚实基础。
[1] 徐凤山. 中国海双壳类软体动物[M]. 北京: 科学出版社, 1997.
XU Fengshan. The bivalvia mollusca in China Seas[M]. Beijing: Science Press, 1997.
[2] Kinne O. The effects of temperature and salinity on marine and brackish water animals: 2. Salinity and temperature-salinity combinations[J]. Oceanography and Marine Biology: An Annual Review, 1964, 2: 281-339.
[3] 林笔水, 吴天明. 温度和盐度同缢蛏稚贝存活及生长的关系[J]. 水产学报, 1986, 10(1): 41-50.
LIN Bishui, WU Tianming. The relations of temperature and salinity to the survival and growth of the spat of[J]. Journal of Fisheries of China, 1986, 10(1): 41-50.
[4] 陈爱华, 姚国兴, 张志伟, 等. 温度、盐度和底质对大竹蛏稚贝生长及存活的影响[J]. 热带海洋学报, 2010, 29(5): 94-97.
CHEN Aihua, YAO Guoxing, ZHANG Zhiwei, et al. Effects of temperature, salinity and sediment on the growth and survival ofDunker juveniles[J]. Journal of Tropical Oceanography, 2010, 29(5): 94-97.
[5] 林笔水, 吴天明, 黄炳章. 温度和盐度对菲律宾蛤仔稚贝生长及发育的影响[J]. 水产学报, 1983, 7(1): 15- 23.
LIN Bishui, WU Tianming, HUANG Bingzhang. The effects of temperature and salinity on the growth and development of spats of the clam ()[J]. Journal of Fisheries of China, 1983, 7(1): 15-23.
[6] 谭杰, 陈振江, 刘付少梅, 等. 温度和盐度对大珠母贝稚贝存活和生长的互作效应[J]. 广东海洋大学学报, 2016, 36(6): 44-51.
TAN Jie, CHEN Zhenjiang, LIU Fushaomei, et al. Combined effects of temperature and salinity on the survival and growth rate of juveniles of[J]. Journal of Zhanjiang Ocean University, 2016, 36(6): 44-51.
[7] 郑言鑫, 2015. 栉江珧繁殖周期及苗种培育技术的研究[D]. 上海: 上海海洋大学, 2015.
ZHENG Yanxin. Studies on reproductive cycle and larval-rearing technology of[J]. Shanghai: Shanghai Ocean University, 2015.
[8] 周珊珊, 张秀梅, 刘旭绪, 等. 魁蚶稚贝的底质选择性及其潜沙能力评价[J]. 水产学报, 2015, 39(6): 867-875.
ZHOU Shanshan, ZHANG Xiumei, LIU Xuxu, et al. Substrate preference and burrowing ability assessment of the juvenile[J]. Journal of Fisheries of China, 2015, 39(6): 867-875.
[9] 张涛, 杨红生, 刘保忠, 等.环境因子对硬壳蛤稚贝成活率和生长率的影响[J]. 海洋与湖沼, 2003, 34(2): 142-149.
ZHANG Tao, YANG Hongsheng, LIU Baozhong, et al. Effect of environmental factors on the survival and growth of juvenile hard clam[J]. Oceanologia et Limnologia Sinica, 2003, 34(2): 142-149.
[10] 陈自强, 寿鹿, 廖一波, 等. 微藻饵料对双壳贝类幼体生长影响的研究进展[J]. 科技通报, 2013, 29(7): 46-55, 67.
CHEN Ziqiang, LU Shou, LIAO Yibo, et al. Advance in the effect of microalgal diets and nutritional value on the growth of early life stages of bivalves[J]. Bulletin of Science and Technology, 2013, 29(7): 46-55, 67.
[11] 朱雨瑞, 徐继林, 严小军. 5种微藻对4种滩涂贝类稚贝生长的影响[J]. 海洋学研究, 2010, 28(3): 60-66.
ZHU Yurui, XU Jilin, YAN Xiaojun. Effect of five marine microalgae on the growth of four juvenile intertidal shellfishes[J]. Journal of Marine Sciences, 2010, 28(3): 60-66.
[12] 徐加涛, 徐国成, 许星鸿, 等. 小刀蛏软体部营养成分分析及评价[J]. 食品科学, 2013, 34(17): 263-267.
XU Jiatao, XU Guocheng, XU Xinghong, et al. Analysis of nutritional composition of edible parts ofDunder[J]. Food Science, 2013, 34(17): 263-267.
[13] 曾国权, 方军, 贾守菊, 等. 小刀蛏群体内同工酶的生化遗传分析[J]. 水产科学, 2010, 29(11): 669-673.
ZENG Guoquan, FANG Jun, JIA Shouju, et al. Biochemical genetic analysis of eight isozymes in intra- populations of razor clam[J]. Fisheries Science, 2010, 29(11): 669-673.
[14] 陈丽梅, 孔晓瑜, 喻子牛, 等. 3种蛏类线粒体16SrRNA和COI基因片段的序列比较及其系统学初步研究[J]. 海洋科学, 2005, 29(8): 29-34.
CHEN Limei, KONG Xiaoyu, YU Ziniu, et al. Sequence comparison and phylogenetic analysis of mtDNA 16S and COⅠgene fragments in three species of razor shell[J]. Marine Sciences, 2005, 29(8): 29-34.
[15] 姜绪, 韦秀梅, 冯艳微, 等. 莱州湾海域小刀蛏()繁殖生物学研究[J]. 渔业科学进展, 2017, 38(6): 107-111.
JIANG Xu, Wei Xiumei, FENG Yanwei, et al. The reproductive biology ofin the Laizhou Bay[J]. Progress in Fishery Sciences, 2017, 38(6): 107-111.
[16] 王亚. 小刀蛏性腺、胚胎及幼体发育研究[D]. 宁波: 宁波大学, 2012.
WANG Ya. Studies on development of gonads, embryos and youngs of(Bivalvia, Mollusca)[D]. Ningbo: Ningbo University, 2012.
[17] 王中霞, 孟晶, 陈树荣. 小刀蛏壳性状与活体质量、软体部重的相关分析[J]. 水产养殖, 2017, 38(10): 28-33.
WANG Zhongxia, MENG Jing, CHEN Shurong. The correlation analysis of the morphological traits, the live body weight, and edible tissue weight of the[J]. Journal of Aquaculture, 2017, 38(10): 28-33.
[18] 于瑞海, 王永旺, 张哲, 等. 小刀蛏室内人工育苗技术研究[J]. 中国海洋大学学报(自然科学版), 2019, 49(9): 42-49.
YU Ruihai, WANG Yongwang, ZHANG Zhe, et al. Studies on artificial indoor breeding technique of[J]. Periodical of Ocean University of China, 2019, 49(9): 42-49.
[19] 顾忠旗, 倪梦麟, 周民栋, 等. 小刀蛏室内人工育苗技术研究[J]. 科学养鱼, 2017(6): 47-48.
GU Zhongqi, NI Menglin, ZHOU Mindong, et al. Studies on artificial indoor breeding technique of[J]. Scientific Fish Farming, 2017(6): 47-48.
[20] Tettelbach S T, Rhodes E W. Combined effects of temperature and salinity on embryos and larvae of the northern bay scallop[J]. Marine Biology, 1981, 63(3): 249-256.
[21] Verbrugge L N H, Schipper A M, Huijbregts M A J, et al. Sensitivity of native and non-native mollusc species to changing river water temperature and salinity[J]. Biological Invasions, 2012, 14(6): 1187-1199.
[22] 刘海涛, 董占武, 徐志明. 盐度对大连湾牡蛎胚胎发育及幼虫生长的影响[J]. 水产学报, 1992, 16(1): 32-39.
LIU Haitao, DONG Zhanwu, XU Zhiming. The effects of salinity on embryonic development and growth of veliger of Oyster[J]. Journal of Fisheries of China, 1992, 16(1): 32-39.
[23] 李玉全, 李永生, 赵法箴.盐度渐变与骤变对脊尾白虾渗透、代谢及免疫相关酶活力的影响[J]. 生态学报, 2015, 35(21): 7229-7235.
LI Yuquan, LI Yongsheng, ZHAO Fazhen. Effect of salinity changes on osmotic-, metabolic-, and immune- related enzyme activities in[J]. Acta Ecologica Sinica, 2015, 35(21): 7229-7235.
[24] 王丹丽, 徐善良, 尤仲杰, 等. 温度和盐度对青蛤孵化及幼虫、稚贝存活与生长变态的影响[J]. 水生生物学报, 2005, 29(5): 495-501.
WANG Danli, XU Shanliang, YOU Zhongjie et al. The effects of temperature and salinity on the incubation ofand survival, growth and metamorphosis oflarvae and juveniles[J]. Acta Hydrobiologica Sinica, 2005, 29(5): 495-501.
[25] 谢仁政, 初庆柱, 黄海立, 等. 盐度对珠母贝幼虫和稚贝存活和生长的影响[J]. 广东海洋大学学报, 2013, 33(6): 57-61.
XIE Renzheng, CHU Qingzhu, HUANG Haili, et al. Effects of sea salinity on the growth and survival ofgranosa Larvae and juveniles[J]. Journal of Zhanjiang Ocean University, 2013, 33(6): 57-61.
[26] 顾晓英, 尤仲杰, 王一农. 几种环境因子对彩虹明樱蛤不同发育阶段的影响[J]. 东海海洋, 1998, 16(3): 41-48.
GU Xiaoying, YOU Zhongjie, WANG Yinong. Some environmental factors’ effects on the mud shailin the different growth stages[J]. Donghai Marine Science, 1998, 16(3): 41-48.
[27] 王涛, 李琪. 不同盐度和温度对熊本牡蛎()稚贝生长与存活的影响[J]. 海洋与湖沼, 2017, 48(2): 297-302.
WANG Tao, LI Qi. Effects of salinity and temperature on growth and survival of juvenile of Kumamoto oyster ()[J]. Oceanologia et Limnologia Sinica, 2017, 48(2): 297-302.
[28] Berger V J, Kharazova A D. Mechanisms of salinity adaptations in marine molluscs[M]//Interactions and adaptation strategies of marine organisms. Springer, Dordrecht, 1997: 115-126.
[29] 许岚, 李琪, 孔令锋, 等.温度和盐度对壳黑长牡蛎幼虫生长和存活的影响[J]. 中国海洋大学学报(自然科学版), 2017, 47(8): 44-50.
XU Lan, LI Qi, KONG Lingfeng, et al. Effects of temperature and salinity on growth and survival of larvae of black-shell Pacific oyster ()[J]. Periodical of Ocean University of China, 2017, 47(8): 44-50.
[30] 尤仲杰, 徐善良, 边平江, 等. 海水温度和盐度对泥蚶幼虫和稚贝生长及存活的影响[J]. 海洋学报(中文版), 2001, 23(6): 108-113.
YOU Zhongjie, XU Shanliang, BIAN Pingjiang, et al. The effects of sea water temperature and salinity on the growth and survival oflarvae and juveniles[J]. Acta Oceanologica Sinica, 2001, 23(6): 108-113.
[31] 包永波, 尤仲杰. 海洋滤食性贝类摄食率影响因子研究现状[J]. 海洋水产研究, 2006, 27(1): 76-80.
BAO Yongbo, YOU Zhongjie. The present researching status of ingestion rate’s influence factors of marinesuspension-feeding shellfish[J]. Marine Fisheries Research, 2006, 27(1): 76-80.
[32] Gagnaire B, Frouin H, Moreau K, et al. Effects of temperature and salinity on haemocyte activities of the Pacific oyster,(Thunberg)[J]. Fish & Shellfish Immunology, 2006, 20(4): 536-547.
[33] Gruffydd L D, Beaumont A R. A method for rearinglarvae in the laboratory[J]. Marine Biology, 1972, 15(4): 350-355.
[34] 何进金, 韦信敏, 许章程.缢蛏稚贝饵料和底质的研究[J]. 水产学报, 1986, 10(1): 29-39.
HE Jinjin, WEI Xinmin, XU Zhangcheng. Study on food and substrate of(Lamarck) spat[J]. Journal of Fisheries of China, 1986, 10(1): 29-39.
[35] Helm M M, Bourne N, Lovatelli A. Hatchery culture of bivalves: a practical manual[M]//FAO fisheries technical paper. Rome: Food and Agriculture Organization of the United Nations, 2004.
[36] 蒋霞敏, 郑亦周. 14种微藻总脂含量和脂肪酸组成研究[J]. 水生生物学报, 2003, 27(3): 243-247.
JIANG Xiamin, ZHENG Yizhou. Total lipid and fatty acid composition of 14 species of microalgae[J]. Acta Hydrobiologica Sinica, 2003, 27(3): 243-247.
[37] 马斌, 周海波, 徐继林, 等. 温度、盐度和底质对大竹蛏稚贝生长及存活的影响[J]. 热带海洋学报, 2010, 29(5): 94-97.
MA Bin, ZHOU Haibo, XU Jilin, et al. Screening of high-quality feed microalgae in cultivation of juvenile intertidal shellfish,[J]. Journal of Tropical Oceanography, 2010, 29(5): 94-97.
Effects of environmental factors on the survival and growth of juvenile
WANG Yong-wang1, 2, YU Rui-hai1, LI Chun-hua1, LI Hai-kun1, LIU Yang2
(1. The Key Laboratory of Mariculture (Ocean University of China), Ministry of Education, Qingdao 266003, China; 2. Qingdao Conson Oceantec Valley Development Co., Ltd., Qingdao 266200, China)
The effects of salinity, temperature, sediment, and microalgal diet on the survival and growth of juvenilewere investigated to determine the optimum culture conditions. The results showed that juvenilehad strong salinity tolerance, and it could grow and survive within a large salinity range. The suitable salinity for juvenile survival and growth ranged from 15 to 35, and the optimum salinity ranged from 20 to 25. Suitable temperatures ranged from 16℃ to 28℃, and the optimum temperature was 24℃~28℃; as salinity and temperature increased, the survival and growth rates increased and then decreased. The substrate composition affected the growth and survival of the juveniles. The results showed that the most suitable sediment was clay sediment and the survival and growth rates in the clay sediments were higher than that in the silt or sandy sediments. Different diets had different breeding effects on juveniles. The survival rate and daily rate of feedingorwere significantly higher than feeding withor. These results should be valuable to optimize artificial breeding for hatchery production ofseed.
; juvenile; environmental factor; growth; survival
Sep. 26, 2021
S968.3
A
1000-3096(2022)10-0043-08
10.11759/hykx20210926003
2021-09-26;
2021-11-05
山东省重点研发项目(2016GSF115013)
[Key Research and Development Project of Shandong Province, No. 2016GSF115013]
王永旺(1994—), 男, 山东淄博人, 硕士研究生, 主要从事水产动物繁育生物学研究, E-mail: wangyw3119@163.com; 于瑞海(1964—),通信作者, 男, E-mail: yuruihai@ouc.edu.cn
(本文编辑: 赵卫红)

