基于网络药理学和分子对接技术预测山楂治疗冠心病潜在分子机制
杨 敏,孟凡颖,孙 辉,杨柏荣,刘梦醒,陈 洁,范 奥,刘 媛✉
(1. 昆明市第三人民医院 药学部,云南 昆明 650041;2. 云南中医药大学 中药学院,云南 昆明 650500;3. 昆明市中医医院 药剂科,云南 昆明 650500)
据《2020世界卫生统计报告》中显示,心血管疾病仍是导致死亡的主要病因,自 2000年以来,全球心血管疾病死亡人数增加了四分之一,2019年达到1 790万人[1]。冠心病(coronary heart disease,CHD)是冠状动脉血管发生动脉粥样硬化病变而引起血管腔狭窄或阻塞,造成心肌缺血、缺氧或坏死而导致的心脏病,我国 CHD死亡率逐年上升,其中2018年CHD在我国的死亡率高达 114(1/10万)[2-3]。中医历代文献中并无“冠心病”病名,但有类似该病的症候记载,如《备急千金要方》中就写道“论曰:寒气卒客于五脏六腑,则发卒心痛胸痹”。《金匮要略》中也提到“夫脉当取太过不及,阳微阴弦即胸痹而痛,所以然者,责其极虚也。今阳虚知在上焦,所以胸痹心痛者,以其阴弦故也”。
中药具有多成分、多靶点的特点,在心血管疾病干预中具有内在优势。山楂是传统的药食两用药材,其功效健运脾胃,消积导滞,在CHD的治疗中有广泛的临床应用[4]。现代药理学研究表明,山楂可显著降低 CHD患者血浆中同型半胱氨酸(被认为是CHD的独立危险因素)及血脂含量[5]。同时山楂还能降低超敏C反应蛋白(颈动脉斑块形成的独立危险因素)及基质金属蛋白酶的表达水平,稳定冠状动脉粥样硬化斑块,提高患者存活率[6-7]。临床研究表明山楂能改善 CHD患者的血脂及心绞痛发作症状,减少非急性期CHD痰瘀症患者急性心血管事件的发生[8-9]。
然而山楂治疗 CHD的作用机制研究滞后于其临床应用,缺乏对山楂多成分-多靶点-多通路治疗 CHD的整体认识。网络药理学从整体的角度来认识药物与机体之间相互作用,有助于挖掘中药多成分作用的靶点及功能通路的整体情况。本研究拟通过网络药理学探究其活性成分作用靶点,构建其作用网络,并结合分子对接技术,系统阐明山楂治疗CHD的作用机制。
1 材料与方法
1.1 山楂的活性化合物及靶点预测
通过中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)(http://tcmspw.com/tcmsp.php)和相关文献收集化学成分,以“山楂”为关键词检索其化学成分。根据口服利用度(Oral bioavailability,OB)≥30%和类药性(Drug-likeness,DL)≥0.18的 2个 ADME属性值作为活性成分筛选条件,并获得活性成分的作用靶点。运用 Uniprot数据库(https://www.uniprot.org/)校正靶点蛋白名称为规范的基因名称。
1.2 CHD相关靶点预测
以“coronary heart disease”为关键词,分别检索 GeneCards数据库(https://www.genecards.org/)和OMIM数据库(http://omim.org/),获取CHD的潜在靶点。并通过 VENNY2.1软件构建韦恩图,得到山楂治疗CHD的靶点。
1.3 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建
将山楂-CHD共同靶点传至 STRING11.0数据库(https://string-db.org/),构建PPI网络模型,选择“multiple proteins”,将生物种类设定为“Homo sapiens”进行检索,设置为评分≥0.9,以提高生物信息的可信度,通过以上信息的处理导出PPI网络图。下载tsv文件,保留节点(node1,node2)和结合率评分(combine score)信息,并导入到Cytoscape 3.7.0软件,分析靶点相关的拓扑参数,并基于degree值进行排序。
1.4 靶点GO及KEGG通路富集分析
通过Metascape数据库(http://metascape.org/gp/index.html)对山楂治疗CHD的靶点进行基因本体(gene ontology,GO)功能富集分析,选择各过程富集排名前10位的分析结果(P<0.01)。进行京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)路富集分析,根据P值筛选显著性高的通路,设置P<0.05,选取最显著的10个通路。
1.5 成分-靶点-信号通路构建
基于药物-成分-靶点-信号通路,运用Cytoscape构建药理学网络。根据KEGG通路富集分析的结果所选取的主要信号通路,同时与参与相关通路的靶点建立联系,并与“成分-靶点”间相互作用关系整合并导入Cytoscape 3.7.0软件中,从而得到成分-靶点-信号通路网络图。
1.6 分子对接验证
①受体蛋白准备:从RSCB PDB数据库中获取核心靶点的3D结构pdb格式文件。蛋白导入Schrödinger 2018软件,在 Protein Preparation模块下进行蛋白加氢、补全缺失残基和 loops区、删除水分子等处理;②化合物处理准备:从PubChem数据库下载化合物3D结构的sdf格式文件,将化合物导入Schrödinger 2018软件,在LigPrep模块下进行处理优化;③蛋白活性口袋准备:查找文献找到靶点活性口袋或者用软件进行预测,Binding Site Detection模块下可发现、观察、评估蛋白结合位点;④定义活性口袋和产生格点文件:在Receptor Grid Generation模块下进行处理,生成活性口袋格点文件;⑤分子对接:选中化合物和上一步产生的格点文件,在 Lignd Docking模块下进行分子对接。亲和能越低,表明活性成分与靶蛋白的结合力越强,一般认为亲和能≤–7.0 kJ/mol的药物分子与靶点具有较好的结合活性。
2 结果与分析
2.1 山楂的活性化合物及靶点筛选
根据 ADME条件筛选得到 6个主要活性成分,见表1。通过UniProt数据库中找出化学成分对应的靶基因名称,物种限定为“Homo Sapiens”,去除重复的基因,获得166个靶点。

表1 山楂活性成分信息特征表Table 1 Crataegi Fructus active ingredient information characteristic table
2.2 CHD相关靶点的获取
检索 GeneCards和 OMIM 数据库,其中GeneCards数据库设置Score值≥3.91。两个数据库的筛选结果删除重复基因后得到 CHD靶点3 850个。并通过 VENNY2.1软件取共同靶点绘制韦恩图,得到山楂治疗CHD相关靶点140个,如图1。
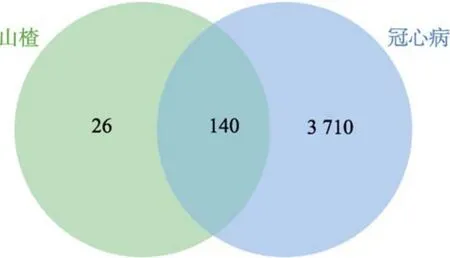
图1 山楂-冠心病共同基因靶点数Fig.1 The number of common gene targets of Crataegi Fructus-coronary heart disease
2.3 PPI网络构建
将140个共同靶点上传至STRING11.0数据库进行分析,构建山楂与 CHD的靶点 PPI网络图。该网络中发生蛋白相互作用的靶点有127个(其中13个靶点未发生蛋白相互作用,故剔除),包括192个节点,767条边,平均节点度值为7.99,见图2。运用Cytoscape 3.7.0软件对127个靶点进行拓扑分析,其中degree值越大则节点越大,表示山楂通过此靶点治疗 CHD的可能性越大。根据分析结果取degree值排名前10的靶点,依次为 JUN、AKT1、TNF、MAPK1、TP53、RELA、IL6、MAPK8、MAPK14、EGFR,推测这些靶点可能是治疗冠心病的核心靶点,见图3。
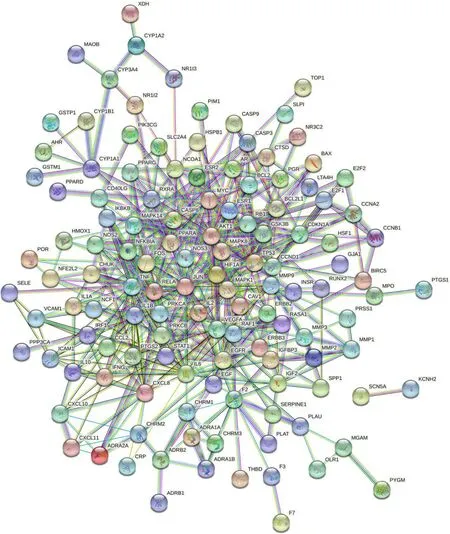
图2 山楂与冠心病交集靶点的PPI网络图Fig.2 PPI network diagram of the intersection target between Crataegi Fructus and coronary heart disease
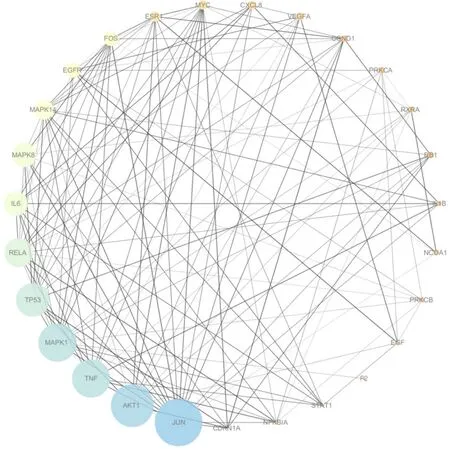
图3 山楂治疗冠心病的核心靶点Fig.3 The core target of Crataegi Fructus in the treatment of coronary heart disease
2.4 GO和KEGG通路富集结果与分析
GO富集分析结果显示,山楂治疗CHD参与的生物过程(biological process,BP)包括:对脂多糖的反应(response to lipopolysaccharide)、对无机物的反应(response to inorganic substance)、凋亡信号通路(apoptotic signaling pathway)、对受伤的反应(response to wounding)、细胞对有机环状化合物的反应(cellular response to organic cyclic compound)、血管发育(blood vessel development)等;参与的细胞组成(cellular component,CC)主要包括:膜筏(membrane raft)、转录调节复合体(transcription regulator complex)、质膜蛋白复合物(plasma membrane protein complex)、细胞器外膜(organelle outer membrane)等;分子功能(molecular function,MF)主要富集于转录因子结合(transcription factor binding)、核受体活性(nuclear receptor activity)、蛋白激酶结合(protein kinase binding)、细胞因子受体结合(cytokine receptor binding)、G 蛋白偶联胺受体活性(G protein-coupled amine receptor activity)等。
KEGG通路分析结果显示,山楂治疗 CHD的靶点主要集中在癌症通路(Pathways in cancer)、糖尿病并发症中的 AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、乙型肝炎(Hepatitis B)、MAPK信号通路(MAPK signaling pathway)、非酒精性脂肪肝(Non-alcoholic fatty liver disease)、NF-κB信号通路(NF-kappa B signaling pathway)、VEGF信号通路(VEGF signaling pathway)等,详见图5。
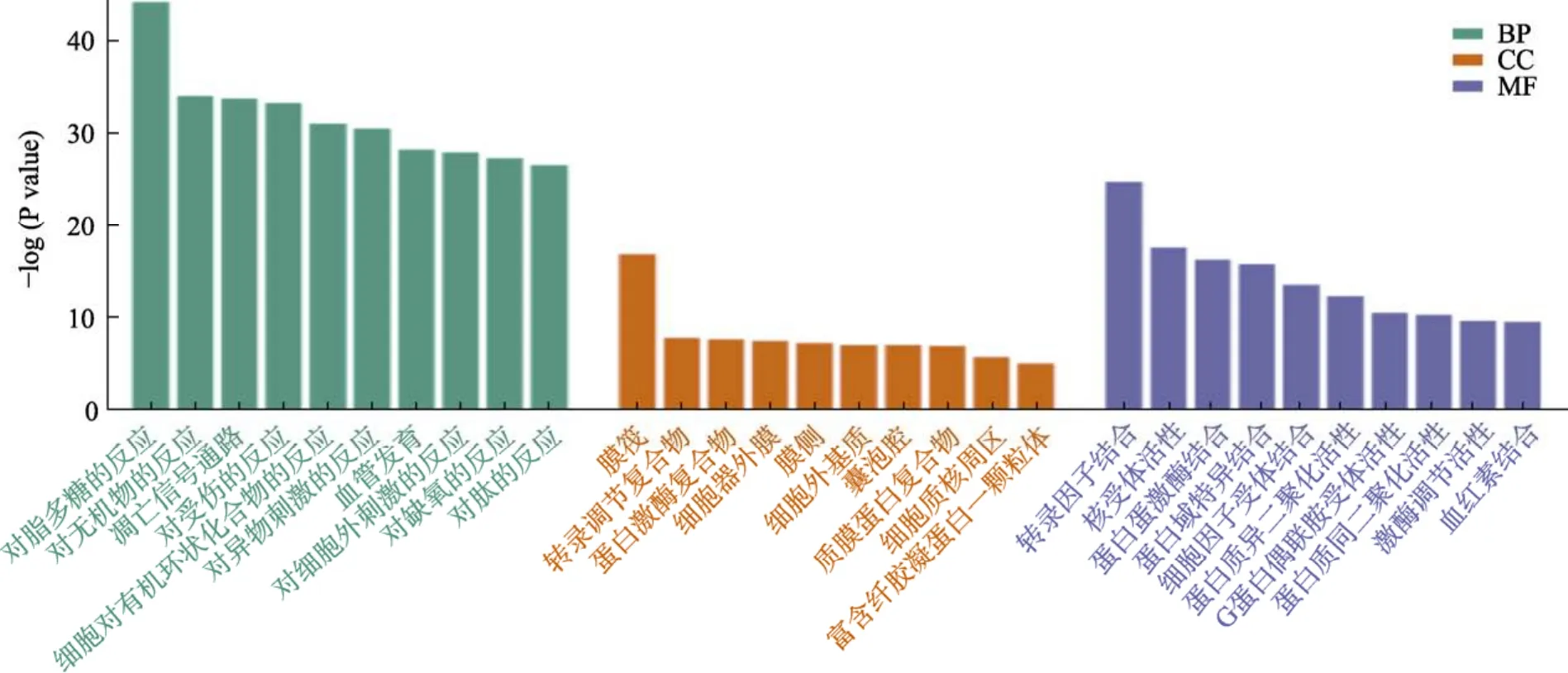
图4 山楂治疗冠心病靶点GO富集分析结果Fig.4 GO enrichment analysis results of Crataegi Fructus targets for the treatment of coronary heart disease
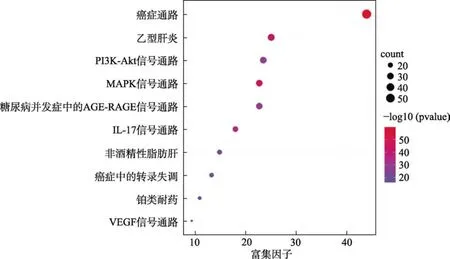
图5 山楂治疗冠心病靶点KEGG富集分析结果Fig.5 KEGG enrichment analysis results of Crataegi Fructus targets for the treatment of coronary heart disease
2.5 成分-靶点-信号通路构建
运用 Cytoscape 3.7.0软件构建山楂活性成分-作用靶点-信号通路网络。图中包括山楂活性成分6个;山楂与 CHD共同靶点 127个;信号通路10条。筛选出的山楂活性成分的作用靶点分布在不同的信号通路,相互协调,通过调控不同的信号通路发挥治疗CHD的作用,详见图6。
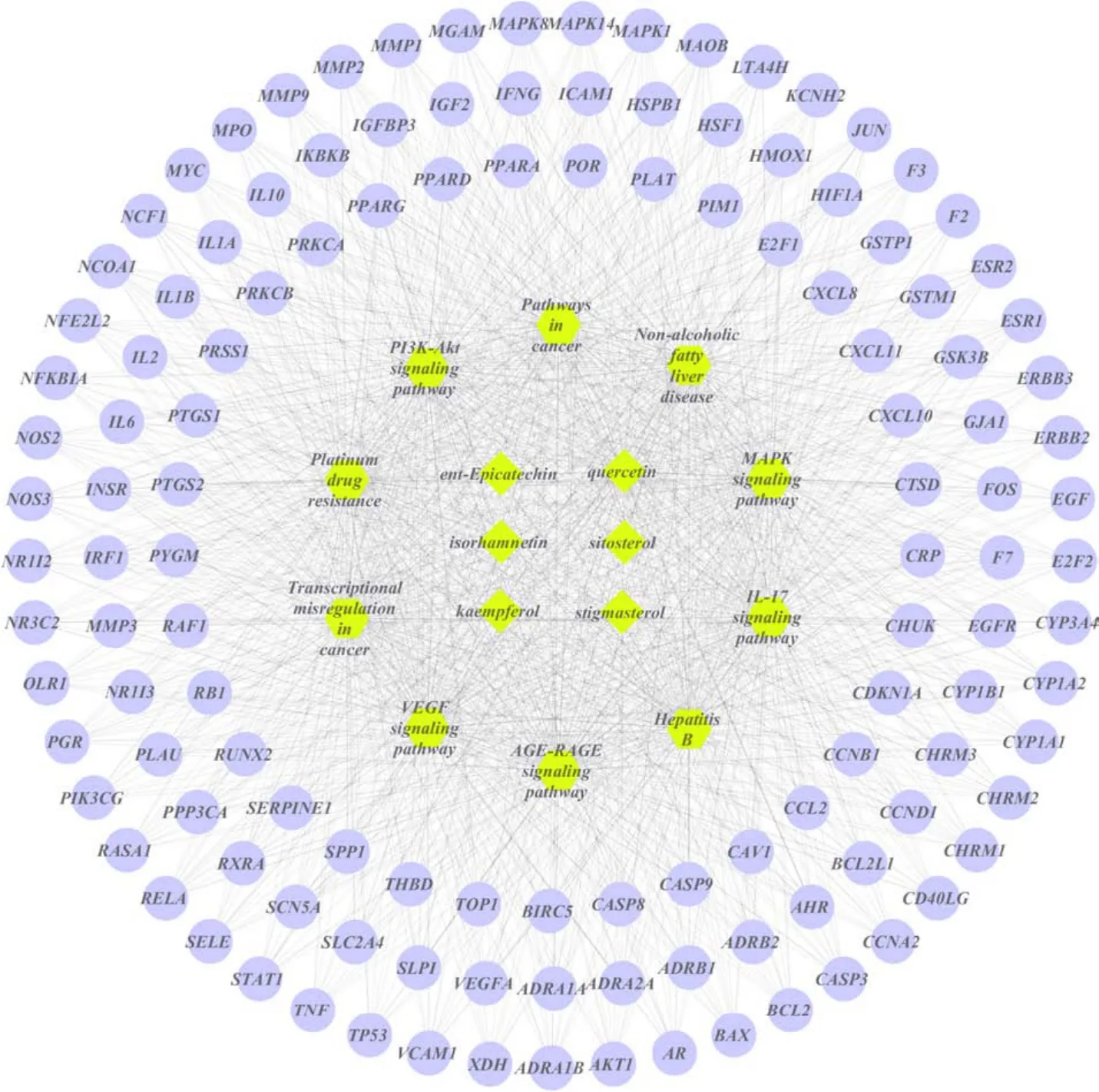
图6 山楂治疗冠心病的成分-靶点-信号通路Fig.6 Crataegi Fructus in the treatment of coronary heart disease components-target-signal pathway
2.6 分子对接验证
选取degree值前10位的核心靶点与有这10个靶点的活性成分进行分子对接验证。筛选得到异鼠李素(isorhamnetin)、山萘酚(kaempferol)、槲皮素(quercetin)3个活性成分有对应核心靶点,推测这3个活性成分可能为山楂治疗CHD的关键药效成分。在分子对接中,亲和能能值越低表示化合物与靶点蛋白结合更好,本研究筛选亲和能≤–7的成分与靶点作为研究对象,由表2可知,异鼠李素、山萘酚和槲皮素均能与 MAPK8靶点结合,且亲和能最低,表明MAPK8靶点可能为其关键靶点,见图7。其中槲皮素与MAPK8靶点结合的亲和能为–7.98,小于异鼠李素和山萘酚,槲皮素与MAPK1亦能较好的结合,表明槲皮素更易与靶点MAPK8、MAPK1靶点结合。此外异鼠李素与RELA靶点结合的亲和能为–7.19,也具有较好的结合活性。
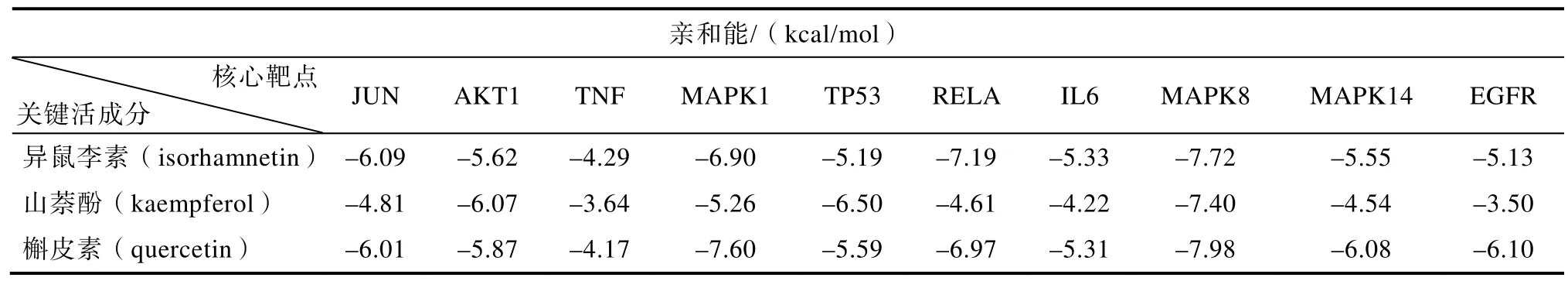
表2 山楂关键成分与对应核心靶点作用情况Table 2 The interaction of key components of Crataegi Fructus with corresponding core targets
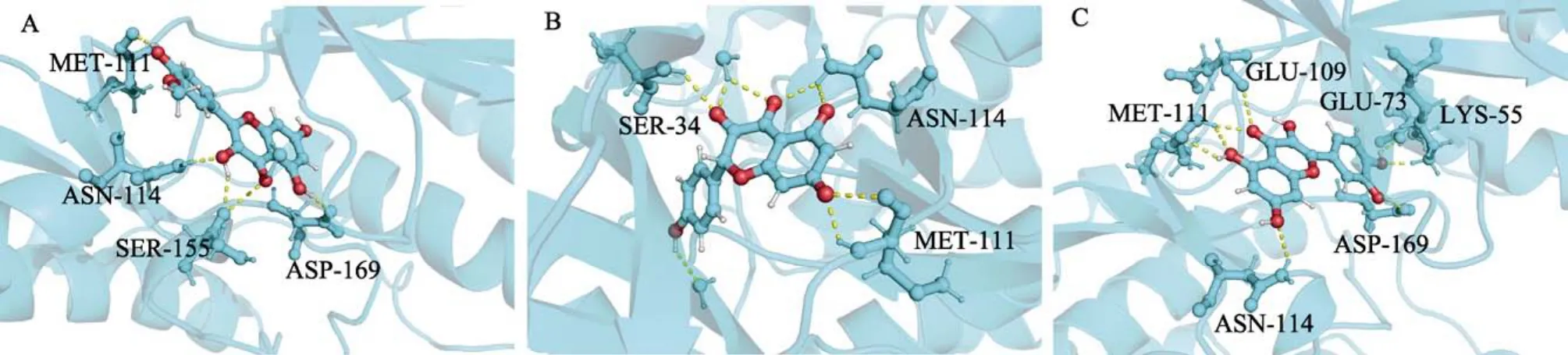
图7 核心化合物与关键靶点分子对接图Fig.7 Molecular docking diagram of core compounds and key target molecules
3 讨论
心血管疾病已成为严重的全球公共卫生问题,其发病率和死亡率居世界首位。CHD是最常见的心血管疾病,面对如此严峻的形势,开发治疗CHD的药物已成为当务之急。CHD在中医中多记载为“胸痹”范畴,与痰浊痹阻,气滞血瘀等相关。现代医学认为高脂血症、高血压、糖尿病等是其常见病因,可见糖脂代谢与 CHD密切相关[10]。中药山楂既擅长治油腻食积,又擅长活性散瘀,现代药理学研究表明山楂具有调节糖脂代谢的功效。因此,本文在中医理论的指导下,针对传统的药食同源中药山楂展开研究,为山楂治疗CHD的作用机制研究提供理论基础。
通过 TCMSP筛选出山楂活性成分为:谷甾醇(sitosterol)、山萘酚(kaempferol)、豆甾醇(stigmasterol)、槲皮素(quercetin)、表儿茶素(ent-Epicatechin)、异鼠李素(isorhamnetin)。将山楂活性成分靶点与 CHD靶点进行交集,得到140个共同靶点,提示了山楂治疗CHD的潜在作用。对共同靶点进一步拓扑分析,取degree值前10的靶点为JUN、AKT1、TNF、MAPK1、TP53、RELA、IL6、MAPK8、MAPK14、EGFR,推测这些靶点可能是治疗 CHD的核心靶点。同时KEGG富集分析结果表明,癌症通路(Pathways in cancer)、糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、乙肝(Hepatitis B)、MAPK 信号通路(MAPK signaling pathway)、非酒精性脂肪肝(Non-alcoholic fatty liver disease)、NF-κB 信号通路(NF-kappa B signaling pathway)、VEGF信号通路(VEGF signaling pathway)等可能是山楂治疗CHD的关键通路。
为验证网络药理学预测的准确性,选取主要活性成分与核心靶点进行分子对接,其结果表明异鼠李素(isorhamnetin)、山萘酚(kaempferol)、槲皮素(quercetin)3个活性化合物与核心靶点MAPK8、MAPK1、RELA均表现出良好的亲和作用,体现了中药多成分多靶点的特性。MAPKs家族是调控炎症基因表达的一类重要蛋白,MAPK8(mitogen-activated protein kinase 8)又被称为c-Jun氨基末端激酶1(cJun N-terminal kinase 1,JNK1),可通过级联反应将细胞外信号传递到细胞及核内,激活转录因子调控基因表达[11]。研究表明通过抑制p38 MAPK轴可降低CHD中内皮细胞的炎症反应、氧化应激、细胞凋亡,进而治疗 CHD[12]。MAPK1(mitogen-activated protein kinase 1)基因,也被称为ERK2基因,其参与增殖、分化、转录调节等多种细胞进程,MAPK1基因遗传多态性可能影响 CHD的血脂代谢和凝血功能,参与 CHD的炎性反应[13]。RELA又名p65,是NF-κB信号通路的重要成员[14]。在大鼠模型中 ac-p65和 NF-κB信号通路相关蛋白水平的降低,可缓解其CHD症状[15]。
槲皮素在体外具有全身和冠状动脉血管舒张作用,并在多个高血压模型大鼠中降低血压,研究表明槲皮素的摄入与较低的 CHD死亡率有关。槲皮素能抑制MAPK通路上JNK、p38的磷酸化,在急性冠脉综合征模型大鼠中,过表达miR-330通过WNT信号通路靶向MAPK8,抑制动脉粥样硬化斑块的形成,同时促进血管内皮细胞增殖[16]。槲皮素可通过调控p38 MAPK/NF-κB信号通路,减轻炎症,保护糖尿病大鼠的肾脏,缓解糖尿病[17]。这些研究支持了本文的结论。现代药理学研究表明槲皮素还可通过阻断HUVECs中NF-κB和AP-1信号通路抑制TNF-α诱导的细胞凋亡和炎症反应,通过产生H2O2激活冠状动脉中的BKCa电流促进冠脉的舒张[18-19]。本研究中未见这些通路上的靶点,也是我们后期需要继续探究的方向。
槲皮素可以经甲基化生成异鼠李素[20]。异鼠李素通过阻断HUVECs中NF-κB和AP-1信号通路抑制TNF-α诱导的细胞凋亡和炎症反应,这可能是其治疗 CHD的潜在机制之一[21]。异鼠李素通过调控 H9c2心肌细胞自噬及凋亡通路蛋白表达减轻心肌损伤,通过调节AKT-FOXO1信号通路有效改善胰岛素抵抗Hepg2细胞[22-23]。但文献报道中未见异鼠李素与MAPK8靶点的直接研究结果,笔者推测异鼠李素在MAPK通路上,更多的是作为槲皮素的代谢产物,参与CHD的治疗。
山萘酚具抗氧化、抗炎、抗凋亡作用,其摄入与较低的心血管风险呈线性相关[24]。山萘酚通过抑制ASK1/MAPK信号通路和调节氧化应激,减轻主动脉条带化引起的心肌肥厚,心肌功能改善[25],还可降低 AGE-RAGE/丝裂原活化蛋白激酶(MAPK)诱导的氧化应激和炎症,减轻糖尿病大鼠心肌缺血再灌注损伤[26]。此外,研究表明其可降低细胞内活性氧水平,抗氧化应激,保护心肌细胞,其作用机制与下调 Nox4、p67phox、p47phox的表达水平相关[27]。
综上所述,借助网络药理学手段探究了山楂治疗 CHD的核心活性成分、关键靶点,通过分子对接技术验证了其可靠性;初步揭示了山楂主要通过异鼠李素、山萘酚、槲皮素,影响MAPK8、MAPK1、RELA等关键靶点,调节 MAPK信号通路从而治疗预防CHD。本研究结果为山楂治疗CHD的临床应用提供了理论支持,为CHD治疗机制研究提供了方向。
备注:本文的彩色图表可从本刊官网(http//lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。

