一株稻田土壤梭状芽孢杆菌的分离及其固氮产氢能力研究
吴志宇,周革非,陈慧敏,汤 佳,谢章彰*,刘芳华*
1. 烟台大学生命科学学院,山东 烟台 264003
2. 广东省科学院生态环境与土壤研究所,华南土壤污染控制与修复国家地方联合工程研究中心,广东省农业环境综合治理重点实验室,广东 广州 510650
3. 广东工业大学环境科学与工程学院,广东 广州 510006
分子氢(H2)在水稻田土壤中扮演着重要角色.首先,H2作为一种理想的电子供体,能够被产甲烷菌、固氮菌、异化铁还原菌等微生物利用,并参与铁/锰氧化物、CO2等物质的还原过程[1-4]. 其次,稻田土壤重金属含量是水稻种植中需严格控制的环境因素[5-6],H2可以通过还原作用固定诸如铅、镉等重金属,减轻土壤重金属污染程度,如H2可以与硫酸盐还原过程耦合,产生的硫离子可以与铅、镉等重金属离子结合并沉降[7]. 此外,H2处理能够加快水稻种子萌发、促进幼苗根系的生长,还可以降低水稻对重金属的吸收量. 由于产氢微生物的产氢活动是稻田土壤中H2的主要来源[8],因此,产氢微生物对稻田土壤微生物的代谢活动及水稻的生长起着重要作用.
在水稻田土壤中,氮源是一种重要的营养元素,影响作物的生长及水稻田生态系统的稳定. 氮源的输入对水稻等作物的产量影响极大. 除人工施肥外,固氮微生物的固氮作用是水稻田中氮素的重要来源. 固氮微生物可以将N2在固氮酶作用下转化为氨态氮,并转化为氨基酸等有机物供给生物体生长[9]. 常见的固氮微生物有固氮菌属(Aztobacersp.)、克雷伯氏菌属(Klebsiellasp.)、假单胞菌属(Pseudomonassp.)[10-11]. 固氮反应同时也是放氢过程,但固氮菌的产氢能力有限,绝大部分固氮作用产生的H2会被固氮菌自身利用[12].
目前,针对水稻田土壤中单独具有产氢能力和固氮能力微生物的研究较多,如王永忠等[13]发现从稻田淤泥中可以筛选得到高效产氢菌;金月波[14]发现,额外施加稻田来源的固氮菌能够显著提高水稻的株高、鲜质量和干质量. 然而,关于具有协同固氮产氢能力微生物的研究却仍旧缺乏,针对此类微生物的挖掘和研究将有助于揭示稻田土壤中协同固氮-产氢微生物的生态作用,并为其实际应用提供理论基础. 该研究从华南稻田土壤样品中定向筛选具有协同固氮产氢能力的微生物,并对其固氮产氢特性进行研究,以期为研究稻田微生物协同固氮产氢过程提供新的微生物资源.
1 材料与方法
1.1 样品获取
采集华南稻田(113°52′51″E、23°03′43″N)土壤样品:于2021年12月,用取样器采集深度为0~40 cm的稻田土1.5 kg,用聚乙烯样品袋盛放样品,4 ℃下保存备用.
1.2 产氢富集物培养
将50 g土壤样品与500 mL去除氮源的MSG培养基[15](MSG-N−培养基)混合(去除蛋白胨、半胱氨酸和氯化铵),用磁力搅拌器混匀,并通入高纯氮气(N2)除氧30 min. 用移液管将混合悬浊液分装至120 mL的厌氧瓶中,每瓶50 mL,用胶塞封口,放置于37 ℃培养箱避光孵育5~7 d;之后每3 d转接一次,转接量为5%,培养基为无菌除氧的MSG培养基.
MSG-N−培养基成分:NaCl 5 g,K2HPO42.1 g,KH2PO40.54 g,微量元素溶液10 mL,葡萄糖10 g,蒸馏水1 L.
微量元素浓缩液成分:NaCl 6 g,CaCl2·2H2O 0.2 g,MgCl2·6H2O 2 g,FeCl2·4H2O 40 mg,ZnCl21 mg,MnCl2·4H2O 1 mg,CuCl2·2H2O 0.6 mg,AlCl31 mg,(NH4)6Mo7O24·4H2O 1 mg,CoCl3·6H2O 4 mg,硼酸饱和溶液20 μL,浓盐酸20 μL,生物素0.04 mg,叶酸0.04 mg,维生素B60.2 mg,核黄素0.1 mg,维生素B10.1 mg,烟酸0.1 mg,维生素B120.1 mg,对氨苯甲酸0.1 mg,泛酸0.1 mg,蒸馏水1 L.
1.3 产氢菌的分离和鉴定
将富集物逐级稀释104~107倍,用Hungate滚管法分离单菌落[16]. 将滚管后冷却的厌氧管放置于37 ℃培养箱避光培养48 h. 在厌氧箱中挑取单菌落,接入200 μL无菌生理盐水中,再转接到含有20 mL灭菌除氧的MSG培养基的厌氧瓶中,37 ℃下培养. 培养基产生明显浑浊后,取100 μL菌液作为PCR模板,对其16S rRNA基因扩增,剩余菌液用于传代和菌种保藏.
PCR扩增体系:2×Taq mix 12.5 μL,通用引物27f(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492r(5′-GGTTACCTTGTTACGACTT-3′)各1 μL,菌液模板0.5 μL,ddH2O 10 μL,体系总体积25 μL. PCR程序:预热95 ℃,5 min. 循环程序:裂解95 ℃,30 s;退火55℃,30 s;延伸72 ℃,30 s;循环30次. 终延伸72 ℃,10 min. 4 ℃下保存. 将产物进行琼脂糖凝胶电泳,并送样于生物工程(上海)股份有限公司测序. 将测序结果上传NCBI数据库(Genebank登记号为ON259312.1),并在该数据库中进行在线Blast比对. 使用MEGA X绘制系统发育树.
1.4 形态观察
取2 mL菌液于离心管中,5 000 r/min下离心3 min,用无菌水重悬重复离心,加入2.5%戊二醛5 mL重悬浮,置于4 ℃下环境过夜,依次用30%、50%、70%、90%和100%浓度的乙醇脱水,将脱水后得到的菌体冻干后喷金镀膜. 将制备好的样品置于扫描电镜(Phenom ProX)下进行微生物形态观察[17].
1.5 代谢特征检测
1.5.1生长检测
将处于生长期的菌液接种到新鲜MSG培养基中,37 ℃下避光培养,每2 h取样一次,用紫外分光光度计测量600 nm处的吸光度(记作OD600).
1.5.2底物消耗检测
使用3,5-二硝基水杨酸法测定样品中葡萄糖含量[18].
检测液成分:3,5二硝基水杨酸6.3 g,NaOH 21 g,KNaC4H12O10·4H2O 182 g,苯酚5 g,NaSO35 g,蒸馏水1 L. 4 ℃下静置7~10 d后使用.
将发酵液稀释20倍与检测液以体积比1∶3混合,100 ℃下水浴5 min. 检测540 nm处的吸光度.
1.5.3有机酸产物检测
取0.5 mL菌液,用去离子水稀释2倍,3 000 r/min下离心3 min,取上清液,通过0.22 μm滤膜. 使用液相色谱(Agilent1260,安捷伦,德国)检测培养基中有机酸产物(乙酸、乳酸、丁酸)的浓度变化.
液相色谱条件:C18柱(C18-WR 5 μm,岛津,日本),柱温35 ℃,流动相为18 mmol/L磷酸二氢钾,流速1.2 mL/min,紫外检测器,波长为218 nm.
1.5.4产氢量检测
用气相色谱进样针取顶空样品200 μL,用气相色谱(Agilent8860,安捷伦,德国)检测气体成分,根据标准曲线换算气体分压,用自由气体方程〔见式(1)〕计算H2物质的量.

式中:P为气体分压,取值为101 kPa;V为气体体积,m³;n为气体物质的量,mol;R为普适气体常数,取值为8.314 4 J/(mol·K);T为气体温度,取值为198 K.
气相色谱条件:TCD检测器,检测器温度150 ℃,进样口温度80 ℃,柱温箱80 ℃,N2作载气,流速10 mL/min.
1.5.5固氮能力检测
生物量检测:配制MSG-N−培养基,分别用高纯N2和高纯氩气(Ar)除氧并灭菌. 接种BZ-1种子液,接种量为5%. 分别检测N2试验组和Ar试验组发酵液600 nm处的吸光度以及培养体系中NH4+浓度.
NH4+浓度检测:采用靛酚蓝-分光光度法[19]. 反应体系和条件:①检测液A,苯酚10 g,1.25%亚硝基铁氰化钠溶液4 mL,蒸馏水1 L;②检测液B,NaOH 5 g,C6H5Na3O74 g,NaClO溶液7 mL,蒸馏水1 L;③将检测液A、B各5 mL混合后,加入发酵液200 μL,37 ℃下孵育15 min,测定637 nm处的吸光度.
固氮酶活性检测:使用乙炔还原法检测固氮活性. 取25 mL容积血清瓶,密封后,将气体置换为Ar,加入1%体积的乙炔气体,备用. 检测固氮酶活性时取1.5 mL菌液加入备用的血清瓶中,37 ℃下孵育1.5 h,用气相色谱检测乙烯产生量.
1.6 统计学分析
所有试验均设置3个平行,使用SPSS 23.0软件对试验数据进行统计学分析.
2 结果与讨论
2.1 产氢菌株的分离与鉴定
富集培养液经过多次传代后,用Hungate滚管法分离并纯化得到一株产氢菌,命名为菌株BZ-1. 菌株BZ-1菌落呈淡黄色,形状为光滑圆形. 如图1(扫描电镜检测结果)所示,在放大倍数为1.95万倍的视野下,菌株BZ-1呈棒状,长3~4 μm,宽0.3~0.5 μm,表面相对光滑.

图 1 菌株BZ-1扫描电镜图像Fig.1 Electron microscope image of strain BZ-1
通过16S rRNA基因序列的测序和比对确定所分离菌株BZ-1的系统发育地位. 经Blast比对,该菌株与Clostridium pasteurianumDSM525的序列相似性最高,为98.43%. 将BZ-1菌株与另外几株产氢梭状芽孢杆菌和其他典型的产氢、固氮菌株的16S rRNA基因序列构建系统发育树(见图2),发现菌株BZ-1与Clostridium pasteurianumDSM525处于同一分枝.综上,菌株BZ-1鉴定为梭状芽孢杆菌属.

图 2 基于16S rRNA基因序列构建的菌株BZ-1系统发育树Fig.2 Phylogenetic tree of strain BZ-1 based on 16S rRNA gene sequences
2.2 菌株BZ-1产氢特性
避光条件下,在37 ℃的MSG培养基中,5%接种量的菌株BZ-1在60 h内的产氢总量为42.19 mmol/L〔见图3(a)〕. 菌株BZ-1的生长迟滞期小于5 h,对数期为5~10 h,在17 h左右生物量达到最大,OD600值为1.45,随后生物量缓慢下降〔见图3(b)〕. 前27 h葡萄糖消耗较快〔见图3(d)〕,平均速率为1.30 mmol/(L·h).随着菌株BZ-1利用葡萄糖产生的有机酸不断累积,培养基pH不断下降,当pH<4.3后,菌株BZ-1代谢葡萄糖速率大幅下降,在该体系中,葡萄糖总消耗量为34.55 mmol/L.
通过气相色谱和液相色谱检测菌株BZ-1的代谢产物,其发酵葡萄糖主要产物为H2、CO2和有机酸.菌株BZ-1发酵产氢的底物转化率为1.22 mol/mol(以每mol葡萄糖产生多少mol H2计),有机酸产物主要为丁酸(15.96 mmol/L),其次为乙酸(7.14 mmol/L)和乳酸(5.09 mmol/L)〔见图3(c)〕.
2.3 菌株BZ-1固氮能力
菌株固氮生长能力检测结果如表1所示,菌株BZ-1在MSG-N−培养基中于顶空Ar环境下培养36 h后,菌株BZ-1的OD600值仅达到0.36,而在N2环境中,36 h时菌株BZ-1的OD600值为1.47,显著高于Ar试验组,说明菌株BZ-1可以通过固氮作用利用N2进行生长.
2.4 菌株BZ-1协同固氮产氢特性
菌株BZ-1在有/无氯化铵的MSG-N−培养基中培养时的产氢量检测结果如图4(a)所示,发现在以20 mmol/L葡萄糖为底物的发酵产氢试验中,无氯化铵试验组前期产氢速率较慢,但最终产氢量较高,其最高产氢量为30.85 mmol/L,相比于3 mmol/L和7 mmol/L氯化铵氮源试验组的26.25 mmol/L和26.89 mmol/L分别提高了17.49%和14.71%.
不同氮源含量的MSG培养基中,菌株BZ-1的生物量、底物浓度和pH随时间的变化以及有机酸产物的最终浓度结果表明,在以N2为唯一氮源的培养体系中,其生物量增长较慢,到达平台期的时间晚于以氯化铵为氮源的两个试验组;菌株BZ-1的最大生物量也更低,相比于添加7 mmol/L氯化铵的试验组,最大生物量降低了33.33%〔见图4(b)〕. 在前24 h,相较于未添加氯化铵的试验组,以氯化铵为氮源的试验组生物量增长较快,葡萄糖底物消耗较快〔见图4(c)〕,葡萄糖的快速消耗导致体系内有机酸发酵产物累积速度加快,使体系pH下降也较快〔见图4(d)〕. 由于氯化铵的消耗会降低体系pH,所以添加氯化铵作为氮源的试验组的最终pH也略低于未添加氯化铵的试验组. 值得注意的是,不同试验组中的乙酸产量存在明显差异〔见图4(e)〕,未添加氯化铵试验组的乙酸产量为8.79 mmol/L,相比于添加3和7 mmol/L氯化铵的试验组产乙酸浓度分别提升了63.22%和61.49%.
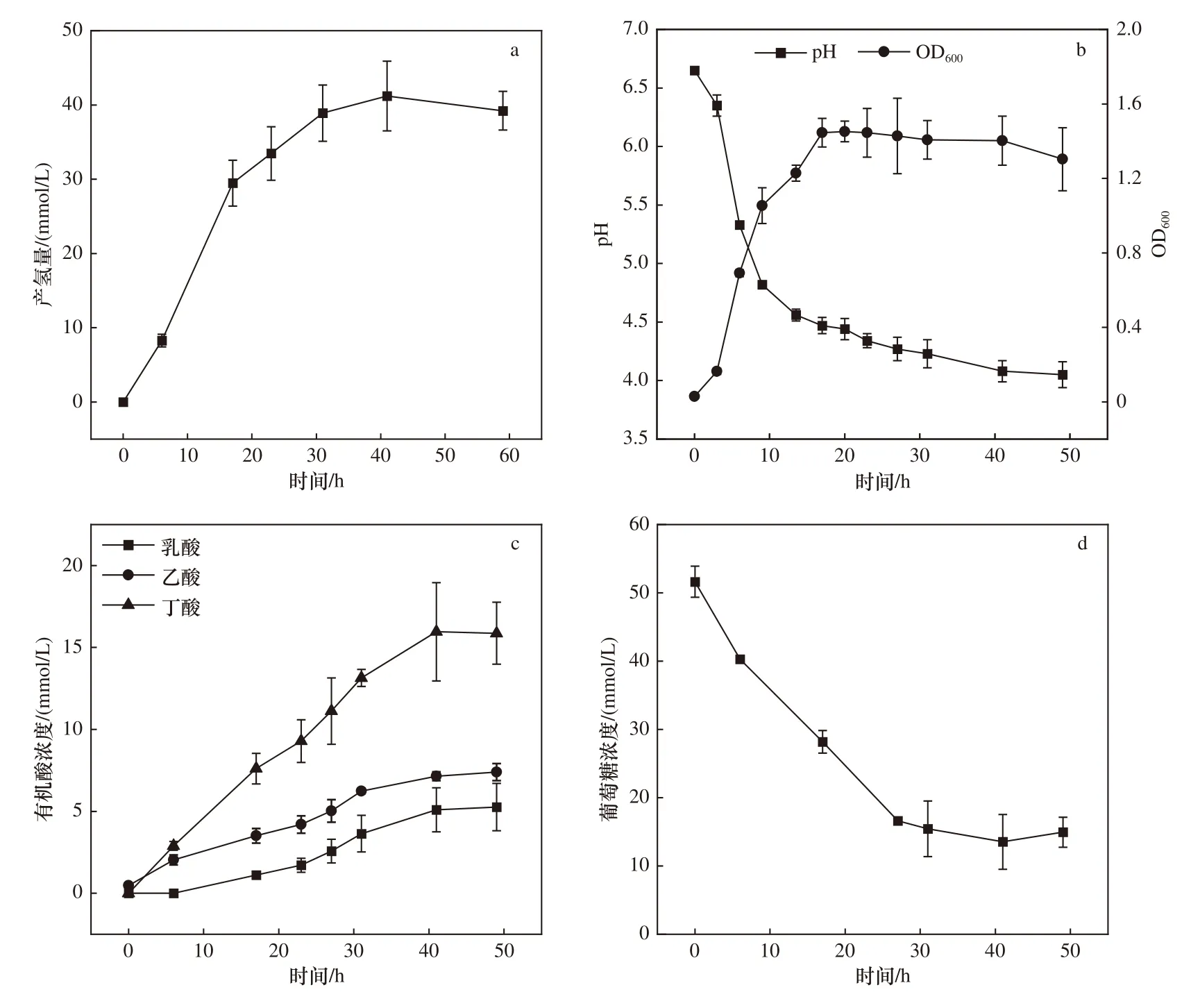
图 3 在MSG培养基中菌株BZ-1的代谢情况Fig.3 Metabolism of strain BZ-1 in MSG medium

表 1 菌株BZ-1在N2和Ar环境的无氮源培养体系中36 h内生物量和NH4+浓度Table 1 The accumulation of biomass and ammonium ions of strain BZ-1 in N2 and Ar environment without nitrogen source
该研究进一步测定了菌株BZ-1在不同培养体系中的固氮能力,发现在未添加氯化铵的试验组中,虽然生物量较低〔见图4(b)〕,但乙炔还原量显著高于添加7 mmol/L氯化铵的试验组〔见图4(f)〕. 这说明在无氯化铵的培养体系中,菌株BZ-1具有较高的固氮酶活性. 同时发现,产氢停滞后(48 h)BZ-1的固氮能力也大幅下降,表明BZ-1的固氮过程和产氢过程在时间上具有一定的同步性.
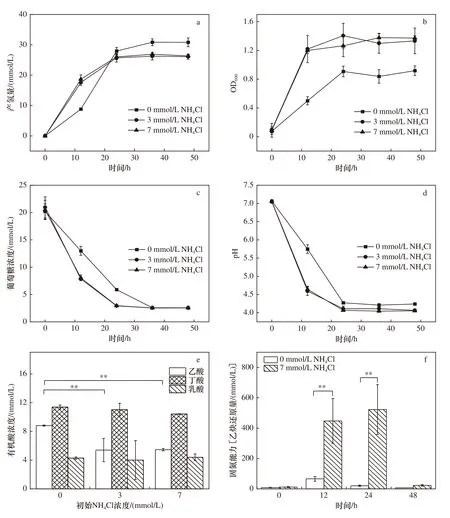
图 4 不同氮源浓度对菌株BZ-1产氢代谢的影响Fig.4 Effects of different nitrogen contents on hydrogen production and metabolism of strain BZ-1
2.5 讨论
利用厌氧培养联合亨盖特滚管技术,从华南稻田土壤样品中筛选得到了一株具有协同固氮产氢能力的梭菌BZ-1.
在菌株BZ-1的固氮能力检测中发现,菌株BZ-1可以利用N2作为氮源产生生物量,说明该菌株具有固氮生长能力. 两个试验组中均未检测到胞外NH4+,说明菌株BZ-1固定N2产生的NH4+未释放到胞外,推测BZ-1固氮作用产生的NH4+全部在胞内被用于细胞生长和代谢.
在菌株BZ-1协同固氮产氢的试验中发现,协同固氮产氢试验组的产氢量相较于添加3 mmol/L氯化铵的试验组增加了14.72%. 可以看出,当固氮作用和产氢作用同时进行时,菌株BZ-1的产氢能力得到了增强. 发酵产氢培养基中氮源含量充足时,高浓度氮源会抑制固氮酶的活性[20],因而当培养体系中存在一定浓度的氯化铵时,菌株BZ-1的固氮酶活性较低.H2是微生物固氮作用的副产物[21-22],菌株BZ-1固氮活性的提高可能有利于其产氢量的提升.
另外,菌株BZ-1协同固氮产氢时的最终生物量低于以氯化铵为氮源生长时的生物量. 由于微生物生物量的增加需要合成各类多糖、蛋白和其他物质,会消耗大量的底物以产生足够的能量与还原力[23],因而生物量的下降有利于降低底物的消耗. 在菌株BZ-1协同固氮产氢时,其较低的生物量可能会使更多的底物和还原力流向产氢途径,最终提升菌株BZ-1的产氢量.
此外,试验中还观察到,协同固氮产氢试验组的乙酸产量显著增加. 由于[Mo-Fe]固氮酶催化的固氮反应需要消耗大量的ATP与NADH[24],而相比于产乳酸与产丁酸代谢途径,产乙酸代谢途径能够产生更多的ATP与NADH,所以菌株BZ-1固氮生长时,产乙酸代谢途径会被上调,并依此提高乙酸产量. 此外,相比于产乳酸和产丁酸途径,产乙酸途径的单位底物产氢量更高[25-26],菌株BZ-1产乙酸代谢途径的上调将有利于其产氢.
在菌株BZ-1的固氮能力检测试验中发现,菌株BZ-1可以利用N2作为唯一氮源进行生长,但未在培养基溶液中检测到NH4+,说明在实验室培养条件下菌株BZ-1不会主动向胞外输送氮源. 然而在实际稻田土壤的复杂条件下,菌株BZ-1固定的氮源可能会随着细胞的死亡而释放到环境中,并被其他生物所利用[27]. 即菌株BZ-1可能同时具备向稻田土壤中输入有机氮和H2的能力. 土壤微生物固氮及产氢活性的增强有利于改善土壤肥力、提高农作物产量[28-30]. 例如:柯玉诗等[31]用耐氨固氮菌处理稻田土壤,发现在低氮条件下早稻和晚稻产量分别提高了8.41%和7.21%;Cheng等[32]发现,H2处理降低了谷物中的镉积累量,同时提高了谷物中支链淀粉的含量;Zeng等[33]发现,H2通过调节激素信号通路,从而影响水稻的抗逆性. 我国是水稻种植大国[34],菌株BZ-1的协同固氮产氢能力使其可以在提高稻田土壤肥力的同时,提高稻田土壤微生物代谢活性并缓解铅、镉等重金属对水稻的胁迫作用,有利于提高粮食产量、保障粮食安全. 此外,在“双碳”背景下,梭菌还是一类理想的产氢微生物[21,35],研究协同固氮产氢作用对提高梭菌产氢效率也有重要意义.
3 结论
a) 该研究从稻田土壤样品中分离得到一株具有协同固氮产氢能力的梭菌−Clostridium sp. BZ-1.
b) 在有机氮源充足条件下菌株BZ-1发酵20 mmol/L葡萄糖可以产生26.89 mmol/L的氢气,当以N2为唯一氮源时,菌株BZ-1产氢量可以提升至30.85 mmol/L.
c) 菌株BZ-1固氮酶活的提升、生物量的降低以及代谢途径的改变可能是其在固氮产氢条件下产氢量提升的原因.
——固氮微生物

