活性污泥萃取液的安全性及对水稻苗期生长和土壤环境的影响
童 彤,纪荣婷,许秋瑾*,宋永会,李小鸥,张 悦
1. 中国环境科学研究院,湖泊水污染治理与生态修复技术国家工程实验室,北京 100012
2. 生态环境部南京环境科学研究所,江苏 南京 210042
3. 中农国盛(北京)环境生态工程有限公司,北京 101500
4. 中国土木工程学会水工业分会,北京 100835
随着社会经济的高速发展以及人们生活水平的逐步提高,城市污水产生量不断增加,各地兴建污水处理厂,伴随产生的污泥也日益增多. 统计数据显示,截至2020年底,我国城市污水处理厂2 618座,污水日处理量为19 267×104m3,干污泥产生量高达1 162.77×104t[1]. 美国、巴西、中国、俄罗斯和日本等国家均是全球主要的污泥生产国,据统计,2018年底全球产生的城市污泥总量接近19×108t[2]. 如何安全处理处置城镇生活污泥,已经成为我国乃至全球污水处理中的关键技术难题. 没有经过合理处置的污泥直接进入环境中,不但无法达到污水处理的目的,还会对自然环境造成二次污染[3]. 因此,对污水厂污泥进行“减量化、无害化、资源化”的处理尤为重要.
包括我国在内的许多国家常用的污泥处理处置方法有水体消纳、卫生填埋、焚烧处理和土地利用等[4].其中,水体消纳是污泥处置的权宜之计,并未从根本上解决环境污染问题,这种方式现在已被淘汰. 卫生填埋虽然对污泥的无毒无害化处理成本低,但填坑中的有毒有害物质可能会通过雨水的侵蚀和渗漏作用进而对地下水产生二次污染[5]. 此外,适宜污泥填埋的场所也因污泥的大量产生而越来越有限. 焚烧处理可以迅速和较大程度地使污泥减量化,但焚烧的成本是其他处理工艺的2~4倍[6],且对技术有较高需求,焚烧后产生的SO2、NOx等有害气体也会对大气造成二次污染. 土地利用是大多数国家处理城市污泥的主要办法,常见的处理方式为堆肥[7]. 污泥中含有大量的腐殖质可以使土壤板结情况得到改善,同时污泥中丰富的有机质、N、P、K等营养元素对农作物的生长具有肥效,是一种较好的肥料[8]. 城市污水处理厂污泥农用是实现污泥“减量化、无害化、资源化”的一项具有潜力的技术措施,既能解决污泥出路问题,又能开发新资源、满足可持续发展的需求. 但污泥中含有的病原菌、重金属等物质成为制约污泥农用的重要因素[9-10]. 针对上述问题,国外研究主要采用碱性稳定化手段对污泥进行“无害化”处理,其中污泥的碱性稳定化[11]主要是向污泥中加入石灰或水泥窑灰等碱性物质使其稳定,利用强碱性和石灰放出的大量热能杀灭病原体、降低恶臭和钝化重金属,同时通过高pH和高温等因素应力组合降解病原菌代谢产物,有效去除抗生素与抗性基因[12]等物质. 碱性稳定化后的污泥可直接施用于土地,虽然我国要求污泥不能直接作为有机肥使用,但这种处理方法在澳大利亚等地正在使用[13].
实际上污泥的碱性稳定化在国际上已有研究,但国内相关的机理和应用研究还很少. 活性污泥萃取液是通过污泥的碱性稳定化手段使污泥无害化,同时通过多相混合、催化、生化反应、萃取分离等步骤将城市污水厂污泥转化成一种富钙和氨基酸的萃取液,其安全性及应用效果是当前研究和应用中的关注重点.本研究通过重金属含量测定和种子发芽生态毒理试验评估活性污泥萃取液的农用安全性,并通过水稻苗期根箱试验,分析活性污泥萃取液施用对水稻苗期生长及土壤环境的影响,旨在探明活性污泥萃取液的农用安全性及应用潜力,为污泥“减量化、无害化、资源化”和生态环境的可持续化发展提供理论和数据支撑.
1 材料与方法
1.1 供试材料
污水处理厂产生的污泥中加入熟石灰泥浆过滤,经过碱热装置进行解体、破碎、剥离、溶析,随后进行固液分离后可得到活性污泥萃取液. 供试材料−活性污泥萃取液由中农国盛(北京)环境生态工程有限公司提供,已进行批量化生产,具有均一化性质,性质稳定,可重复生产. 经测试,活性污泥萃取液中富含大量有机质、游离氨基酸、蛋白质以及丰富的Ca2+等物质,其中,萃取液中有机质含量为45.8 g/L,游离氨基酸含量为4.3 g/L,总蛋白质含量为23.47 g/L,可溶性蛋白含量为19.92 g/L,Ca2+含量为2.60 g/L. 此外,发现萃取液中含有一定浓度的植物生物刺激素,包括吲哚乙酸和羟基苯乙酸等,且有较高浓度的氨基酸螯合钙,这些物质对植物生长都具有促进作用.
供试水稻品种为粳稻南粳9108.
1.2 试验设计
1.2.1种子发芽试验
挑选饱满均一的水稻种子在2%的NaClO溶液中表面消毒30 min,用蒸馏水反复冲洗,在25 ℃恒温培养箱中避光催芽,挑选露白且长势一致的种子置于预先填充两层定性滤纸的一次性塑料培养皿(直径为6 cm)中,每皿20粒. 设置1个对照组和5个处理组. 对照组仅添加蒸馏水,各处理组分别添加不同浓度(0.33%、1%、3.3%、10%、100%)的活性污泥萃取液. 每组处理设3皿重复,各皿每日处理液添加量均为3 mL,用铝箔覆盖后置于培养箱中黑暗条件下培养,保持温度(25±1) ℃. 连续观察5 d,每日记录发芽种子数,测定种子根长,并计算种子发芽率(X)和发芽指数(GI).
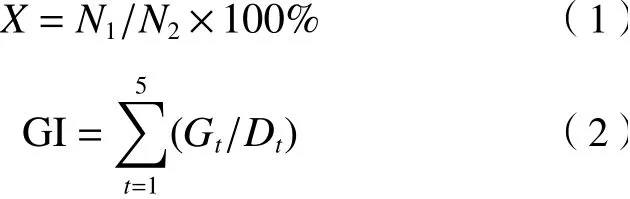
式中:X为种子发芽率,%;N1为发芽种子数;N2为供试种子数;GI为发芽指数;Gt为第t天的发芽数;Dt为相应的发芽日数.
1.2.2根箱试验
根箱试验于2021年8—10月在安徽省黄山市生态环境部南京环境科学研究所野外试验基地的日光温室中进行. 试验土壤采自基地附近的常规稻田(0~20 cm表层土壤),土壤类型为水稻土. 将取回的土壤样品去除枝叶和石块等杂质,风干磨碎,过20目(相当于0.85 mm)筛,装入用尼龙布分隔出根际、近根际和远根际区域的定制根箱(长23 cm、宽18 cm、高23 cm)中,每个根箱装土5.0 kg(干质量). 根箱试验初始理化性质:pH=5.7,可溶性有机碳含量为2.7 mg/L,电导率为105 μS/cm,硝态氮含量为3.58 mg/kg,铵态氮含量为14.52 mg/kg,土壤重金属Hg、As、Cd、Pb、Cr的含量分别为0.024、7.32、0.052、9.84、19.03 mg/kg,均低于《土壤环境质量 农用地土壤污染风险管控标准(试行)》(GB 15618—2018)中农用地重金属含量限值.设置5个处理组,包括CK(空白对照组,不施用任何肥料)、CF(常规施肥对照组,仅施用化肥)、LMF(化肥减氮30%配施低量萃取液)、HMF(化肥减氮30%配施高量萃取液)、MF(化肥减氮100%配施全量萃取液). 试验中使用尿素、磷酸二氢钾和氯化钾分别作为化肥中氮、磷、钾的来源. 各试验组设置4个平行,养分施用量见表1.

表 1 不同处理的养分投入量Table 1 Fertilizer application rates for different treatments
温室采用自然光照,设置温度为(25±1) ℃、湿度为8%~14%. 水稻育苗至三叶一心后,选取长势一致的幼苗移栽至根箱中,每根箱4株. 自移栽至取样前,各根箱始终保持1~2 cm的浅水层. 连续培养30 d后进行水稻幼苗、根际、近根际和远根际土壤样品的采集,用于后续水稻幼苗生长性状、土壤理化性质及土壤微生物等指标的测定.
1.3 指标测定方法
活性污泥萃取液中重金属Pb、Cd元素含量采用硝酸高氯酸消煮-原子吸收法测定. 其中,Pb的加标回收率为96.1%,相对误差为4.7%;Cd的加标回收率为105.3%,相对误差为6.3%. Cr元素含量采用王水提取-电感耦合等离子体质谱法测定,其加标回收率为106%,相对误差为0.98%. Hg元素含量采用冷原子吸收分光光度法测定,其加标回收率为108%,相对误差为8%;As元素含量采用自动化连续流动式氢化物原子吸收光谱法测定,其加标回收率为100%,相对误差为1%.
植物的株高、茎宽和分蘖数指标采用直接测量法测定;植株生物量(地上、地下)指标采用烘干称重法测定.
土壤pH采用电位法(土水比1∶2.5)测定;土壤电导率采用土水比1∶1饱和泥浆法测定;土壤DOC(dissolved organic carbon,可溶性有机碳)含量采用TOC仪(耶拿multi N/C2100,德国)测定.
土壤细菌微生物群落结构测定:采用16S rRNA V4~V5区 的 特 异 性 引 物F515(5′-GTG CCA GCM GCC GCG G-3′)和R907(5′-CCG TCA ATT CMT TTR AGT TT-3′)对细菌16S rRNA进行扩增,利用每个样品的引物序列中的特异性标签序列区分不同样品,Illumina MiSeq测序结果采用QIIME软件进行分析.
1.4 数据处理
使用Excel 2010软件对数据进行整理,结果以平均值±标准差表示. 采用SPSS 23.0软件对数据进行统计分析,利用单因素方差分析中的LSD多重比较检验不同处理间的结果差异显著性,统计显著性设为P<0.05. 采用Origin 2021软件制图.
2 结果与讨论
2.1 污泥萃取液安全性分析
2.1.1污泥萃取液重金属含量分析
活性污泥萃取液中的重金属含量见表2,经与《含氨基酸水溶肥料》(NY 1429—2010)中重金属含量限值对比发现,活性污泥萃取液中的重金属含量均远低于标准限值,表明该污泥萃取液中的重金属含量不会对其农用产生影响.
2.1.2活性污泥萃取液施用对水稻种子萌发的影响
种子萌芽和根部伸长是植物生长周期中最为关键和敏感的时期. 种子发芽和根伸长试验是主要的高等植物毒理试验方法[14],当种子暴露于污染物或有害环境时,发芽和根伸长常常受到抑制,一般表现为发芽率低、发芽指数低、根长较短;当环境无害时种子常表现出发芽率高、发芽指数高、根长较长.
由表3可见,与CK相比,试验第2天3.3%浓度处理显著促进了种子萌发,剩余试验期间0.33%、1%、3.3%浓度处理均对水稻种子萌发表现出显著的促进作用(P<0.05),其中3.3%浓度处理对水稻种子发芽的促进效果表现最好. 10%浓度处理试验期间发芽率和发芽指数与CK类似. 100%浓度处理对水稻种子的发芽表现出明显的抑制作用(P<0.05). 各浓度处理下根长在试验第3天出现显著差异. 与CK相比,第3天,1%、3.3%浓度处理下根长显著增加(P<0.05);第4天,3.3%浓度处理下根长显著增加(P<0.05). 100%浓度处理在试验期间对根长均表现出明显的抑制作用(P<0.05).
通过种子发芽和根伸长试验可以发现,适宜浓度的活性污泥萃取对水稻种子无毒害作用. 低浓度活性污泥萃取液对种子发芽率、发芽指数和根长均表现出显著促进作用,且其促进效果随着萃取液浓度的增加而逐渐增强. 但当萃取液浓度升至10%后,活性污泥萃取液对水稻种子萌发的促进作用开始减弱. 这主要是因为,活性污泥萃取液中既含有种子生长发育所需的有机质、腐殖质等物质,又含有一些低浓度下激励效应和高浓度下抑制效应的Ca2+等元素. 种子吸收营养物质后能刺激细胞分裂生长,分泌生长刺激素类物质,从而促进种子的萌发和生长. 同时低浓度活性污泥萃取液中的Ca2+可促进细胞中的Ca2+参与胁迫信号的感受、传递、响应与表达,进而提高了植物抗逆性[15]. 谢文辉等[16]研究表明,与无钙盐环境相比,50 mmol/L的钙盐环境中葛藤种子萌发率显著升高.活性污泥萃取液浓度过高时,其中的有机物、Ca2+等成分会超过种子所能承受阈值,致使种子产生过量活性氧自由基,破坏细胞膜,进而造成细胞内物质大量外渗和有毒物质进入[17]. 这与刘艺平等[18]研究中高浓度钙盐胁迫会对种子产生离子毒性、抑制种子萌发的结果一致. 试验研究结果表明,适宜浓度的活性污泥萃取液对种子发芽具有促进作用且无毒性.
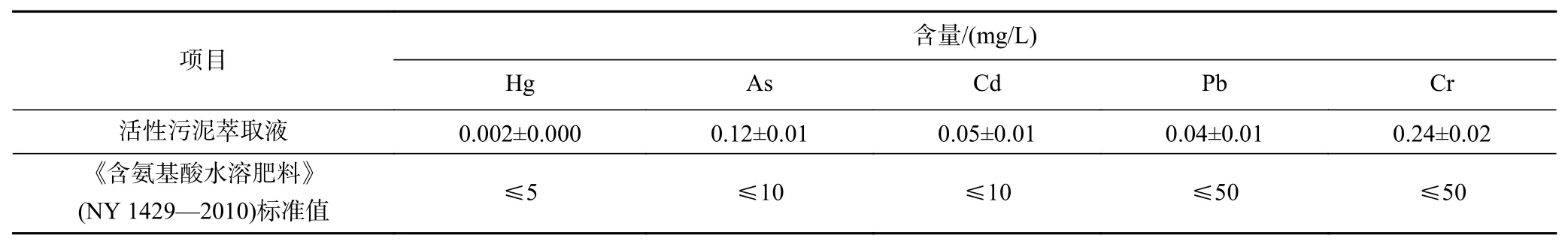
表 2 活性污泥萃取液中重金属含量Table 2 Content of heavy metal elements in Activated sludge extract
2.2 活性污泥萃取液施用对水稻苗期生长性状的影响
水稻株高和分蘖数是影响水稻产量的重要因素.水稻分蘖数通过影响水稻产生的穗数从而影响水稻的产量,水稻株高会影响水稻接触光照的多少,进而影响水稻叶片的光合作用和干物质积累[19]. 水稻茎秆形态[20]影响着水稻的抗倒伏能力,茎秆粗的水稻抗折力高、抗倒伏性强.
?
由表4可见,施用活性污泥萃取液后,LMF、HMF、MF处理组水稻的株高、分蘖数、茎粗等生长性状指标均呈增加趋势. HMF、MF处理组水稻的平均株高分别为41.00和40.25 cm,与CK相比存在显著性差异(P<0.05);LMF、HMF、MF处理组分蘖数较CK均显著增加了20%(P<0.05);MF处理组茎粗生长量最大,平均生长量为2.45 cm,与CK相比存在显著性差异(P<0.05). 与CF相比,LMF、HMF、MF处理组水稻生长量指标均有一定程度的增加,其中HMF处理组株高与CF相比显著增加了8.6%(P<0.05).这与有机肥在水稻生产中的研究结果相似,如唐雪[21]在有机肥对水稻产量、品质和生理性状的影响研究中发现,施用有机肥对水稻幼苗的茎蘖数、株高等生长性状具有促进作用.
生物量可以反映出植物的物质积累量,生物量越大,植株品质越好[22]. 本研究中,HMF、MF处理组水稻地上部平均生物量(以干质量计)分别为0.95、1.04 g,与CK相比存在显著性差异(P<0.05). LMF、HMF、MF处理组水稻地下部平均生物量较CK分别显著增加了25.5%、34.0%、57.4%(P<0.05). 与CF相 比,HMF、MF处理组地上部生物量存在显著性差异(P<0.05). MF处理组地下部生物量最高,为0.74 g,较CF显著提高了48%(P<0.05). 研究结果表明,施用适宜浓度的活性污泥萃取液可提高水稻幼苗植株的地上部与地下部生物量,这种促进效果与活性污泥萃取液的施用量有着密切关联. 这与杨利等[23]用有机肥替代化学氮肥对小麦幼苗地上部与地下部生物量的结果类似,推测活性污泥萃取液中含有与有机肥成分类似的有机质、微量元素等物质对植物生长起促进作用.

表 4 不同处理下水稻苗期生长性状Table 4 Growth traits of rice seedling stage under different treatments
2.3 活性污泥萃取液施用对土壤性质的影响
土壤pH是影响土壤肥力的重要因素之一,其过低或过高都会影响作物生长. 土壤pH过低易引起土壤板结、营养物质淋溶、土壤贫瘠化等问题,不仅会造成作物生长的必需元素缺失,还会破坏土壤环境,造成养分流失、地下水污染等环境问题. 由图1(A)可见,与CF相比,LMF、HMF、MF处理组土壤pH均有显著性增加(P<0.05),其中,根际土壤的pH分别增加了2.7%、5.2%、6.2%(P<0.05),近根际土壤pH平均值分别为5.34、5.45、5.82,远根际土壤pH的增幅为0.51%~13.80%(P<0.05). 与CK相比,LMF、HMF、MF处理组根际土壤的pH均有显著性差异(P<0.05);近根际土壤中pH分别显著减少了12.89%、11.09%、6.06%(P<0.05);远根际土壤中,LMF处理组土壤pH降低了0.06(P<0.05),HMF、MF处理组土壤pH分别增加了0.48和0.73(P<0.05). 水稻对土壤酸碱度的适宜性较强,最适宜生长的土壤pH在6.5~7.5之间,此时各种营养元素的吸收利用率最高,对作物的生长发育最为有利. 与常规施肥相比,配施活性污泥萃取液可以在一定范围内提高土壤pH,使土壤酸碱度接近水稻最适pH,本研究结果与有机肥不仅能提高土壤肥力,还能释放碱性物质中和土壤酸度、提高土壤pH[24]这一结论相似. 与CK、CF对比,各处理组土壤pH变化趋势略有差异的主要原因是,化肥为强酸弱碱盐,pH偏酸性,施用后会导致土壤pH下降. 而经过碱性稳定化的活性污泥萃取液可在一定程度上提高土壤pH,活性污泥萃取液和化肥配施对土壤pH有拮抗作用.

图 1 不同施肥处理对土壤pH、电导率、DOC含量的影响Fig.1 Effects of different fertilization treatments on soil pH, conductivity and DOC content
土壤电导率是影响植物和微生物活性的重要指标,它能影响土壤养分和污染物的转化,可反映一定条件下土壤盐分的实际状况[25]. 土壤盐分是影响作物生长发育和微生物活动的主要因素之一. 过多的土壤盐分会导致土壤透气和透水性差、表层易板结、养分降低等后果,严重影响作物的生长发育[26]. 由图1(B)可见,与CK相比,在根际土壤中,HMF和MF处理组土壤电导率显著降低(P<0.05);近根际土壤中,LMF处理组电导率显著增加4.7%(P<0.05),MF处理组电导率显著减少39.2%(P<0.05);远根际土壤中各处理与CK相比均有显著性减少,降幅为14.3%~38.7%(P<0.05). 根际、近根际、远根际土壤中,各处理下电导率与CF相比均有显著性降低(P<0.05),其中,MF处理组土壤电导率的降幅最大,各区域土壤中其降幅分别为54.6%、58.3%、66.3%(P<0.05). 与CF相比,施用活性污泥萃取液可显著降低土壤电导率.
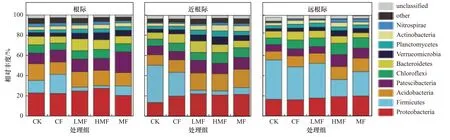
图 2 不同施肥处理下土壤微生物群落的组成结构Fig.2 Composition of soil microbial communities under different fertilization treatments
DOC是维持微生物生命活动的重要养分,是土壤可利用养分库中重要组成部分. 由图1(C)可见,与CF相比,各区域土壤中,LMF、HMF、MF处理组DOC含量均有显著性增加(P<0.05),增幅最高可达68.0%.有研究表明,污泥既可以充当DOC的来源,也可促进土壤有机质的溶解[27],增加土壤DOC含量. 与CK相比,LMF、HMF处理组DOC含量却有显著性减少(P<0.05). 这可能与CK处理组植株长势较弱、吸收转化有机碳能力有限、土壤残留较多等原因相关. 与有机肥相类似,活性污泥萃取液的施用可以提供一定数量的溶解性有机碳. 喻惠玲等[28]在施用水溶性有机肥对稻田土壤砷镉的提取效能研究中发现水溶性有机肥处理可显著增加土壤DOC含量.
研究结果表明,活性污泥萃取液类似于有机肥源,其在农业上的施用能为作物提供生长所需的矿质养分,改善土壤环境,如优化土壤物理性状和结构[29],促进作物的生长发育.
2.4 活性污泥萃取液施用对土壤微生物群落结构的影响
土壤微生物[30]参与有机质降解、养分循环等过程,是土壤生化反应的推动者和参与者,是土壤的重要组成部分,被视为土壤质量变化最敏感的指标. 土壤菌群中的优势物种在很大程度上决定着微生物群落的生态结构及功能,了解微生物群落的物种组成能有效地对群落结构的形成及改变进行分析,预测改变外界因素后土壤微生物群落的功能方向.
由图2可见,根际土壤中,与CK相比,各处理组疣微菌门(Verrucomicrobia)的相对丰度均有显著增加(P<0.05),LMF处 理组 浮 霉菌 门(Planctomycetes) 的相对丰度显著增加(P<0.05),MF处理组Patescibacteria的相对丰度显著增加(P<0.05). 与CF相比,各处理组疣微菌门的相对丰度也均有显著增加(P<0.05),LMF和HMF处理组厚壁菌门(Firmicutes)的相对丰度显著减少(P<0.05),LMF处理组拟杆菌门(Bacteroidetes)的相对丰度显著增加(P<0.05),MF处理组Patescibacteria的相对丰度显著增加(P<0.05).
近根际土壤中,与CK相比,各处理组变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、疣微菌门、放线菌门(Actinobacteria)、硝化螺旋菌门(Nitrospirae)的相对丰度均有显著性增加(P<0.05),厚壁菌门的相对丰度显著减少(P<0.05). HMF和MF处理组绿弯菌门(Chloroflexi)的相对丰度显著增加(P<0.05),LMF处理组拟杆菌门的相对丰度显著增加(P<0.05),HMF处理组浮霉菌门的相对丰度显著增加(P<0.05).与CF相比,各处理组变形菌门、酸杆菌门、放线菌门、硝化螺旋菌门的相对丰度均有显著增加(P<0.05),厚壁菌门的相对丰度显著减少(P<0.05). LMF和HMF处理组疣微菌门的相对丰度显著减少(P<0.05). LMF处理组Patescibacteria、绿弯菌门的相对丰度显著增加(P<0.05),拟杆菌门的相对丰度显著减少(P<0.05).HMF处理组绿弯菌门的相对丰度显著减少(P<0.05),浮霉菌门的相对丰度显著增加(P<0.05).
远根际土壤中,与CK相比,HMF处理组Patescibacteria、绿弯菌门、疣微菌门、硝化螺旋菌门的相对丰度显著增加(P<0.05),厚壁菌门的相对丰度显著减少(P<0.05). MF处理组硝化螺旋菌门的相对丰度显著增加(P<0.05). 与CF相比,HMF处理组绿弯菌门、疣微菌门、硝化螺旋菌门的相对丰度显著增加(P<0.05),厚壁菌门的相对丰度显著减少(P<0.05).MF处理组酸杆菌门、绿弯菌门、硝化螺旋菌门的相对丰度显著增加(P<0.05).
由图3可见,在根际区域,LMF和HMF处理组聚类成一个类群,CK、CF和MF处理组聚类成一个类群;近根际区域内,LMF、HMF和MF处理组聚类成一个类群,CK、CF处理组聚类成一个类群;远根际区域内,所有处理均可聚类成一个类群. 聚类分析结果表明,施用活性污泥萃取液后,土壤近根际区域的菌群结构变化最为明显(见图3). 研究表明,根系能通过调控根系分泌物的种类和数量来影响根际微生物的群落结构和多样性[31],土壤微生物通过趋化感应向富含根系分泌物的区域进行富集和繁殖[32]. 但植物所产生的酸性根系分泌物可能会对根际区域的微生物产生抑制作用,而远根际作为远离根际的土壤区域受根系分泌物的影响较小. 因此,近根际土壤菌群变化应最为显著.
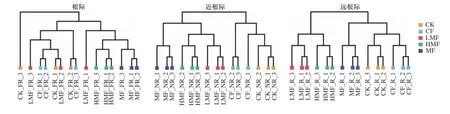
图 3 不同施肥处理下土壤微生物群落的聚类分析Fig.3 Cluster analysis of soil microbial communities under different fertilization treatments
与CK和CF相比,各处理组近根际土壤中相对丰度均显著增加的菌群为变形菌门、酸杆菌门、疣微菌门、放线菌门、硝化螺旋菌门,厚壁菌门的相对丰度则显著减少. 这些菌群的变化对植物生长起正向促进作用,其中变形菌门多含植物益生菌,在土壤的碳、氮、硫循环中起关键作用[33];疣微菌门的相对丰度和碳循环相关基因的表达呈正相关. 与碳循环呈正相关的变形菌门、疣微菌门等菌群增加,可能与土壤DOC含量的升高存在关联. 土壤有机碳含量的增加提高了土壤养分含量,有利于菌群的生长繁殖,菌群的分解代谢会促进有机化合物和其他不溶物质的降解,改善土壤环境. 酸杆菌门可参与植物残体降解;放线菌门[34]的细菌多为腐生菌,有助于土壤的生物缓冲作用,拮抗土壤病原菌并促进有机物的分解;硝化螺旋菌门是亚硝酸盐氧化细菌,在农业土壤的生物氮循环和硝化作用中发挥重要作用. 厚壁菌门常见于高盐、干旱等胁迫环境,厚壁菌门的减少可以证明活性污泥萃取液对土壤的改良作用.
与CK、CF相比,根际土壤中,与碳循环呈正相关的疣微菌门相对丰度显著增加的现象在LMF、HMF、MF处理组也均有体现;MF处理组Patescibacteria的相对丰度有显著增加,Patescibacteria没有可培养细菌,目前对其功能还不了解,但Patescibacteria菌门作为一种古菌菌门,多是原核生物,原核生物对有机肥的响应常表现为自上而下的调控菌群结构[35].远根际土壤中,与碳、氮循环相关的疣微菌门、硝化螺旋菌门相对丰度显著增加的现象在HMF处理组亦有体现. 此外,HMF处理组可吸收多种有机质酸的绿弯菌门[36]的相对丰度显著增加,绿弯菌门相对丰度的增加与污染土壤改良有关.
施用活性污泥萃取液后,与土壤碳、氮循环及植物根系相关菌群的相对丰度显著增加,常见胁迫环境的菌群相对丰度显著减少,土壤微生物群落结构朝着有利于作物生长和元素循环的方向改变.
3 结论
a) 活性污泥萃取液中Hg、As等重金属含量远低于《含氨基酸水溶肥料》(NY 1429—2010)标准限值.0.33%~10%浓度的萃取液对水稻种子有促进作用且无毒害,3.3%的萃取液对种子发芽和根伸长的促进作用最为显著.
b) 活性污泥萃取液配施化肥对水稻幼苗的株高、分蘖数、茎宽、地上部生物量和地下部生物量均有促进作用,同时还可以提高土壤pH,减少土壤盐分,增加土壤DOC含量. 化肥减氮100%配施全量萃取液处理对水稻幼苗各生长性状的促进效果和土壤改良效果最为显著,其中pH提高13.8%,电导率降低66.3%,DOC含量增加68.0%.
c) 施用活性污泥萃取液后,土壤近根际区域的菌群结构变化显著. 与土壤碳、氮循环呈正相关的变形菌门、疣微菌门和硝化螺旋菌门的相对丰度显著增加,与土壤有机物分解及植物残体降解功能相关的酸杆菌门及放线菌门的相对丰度显著增加,与土壤胁迫环境相关的厚壁菌门的相对丰度显著减少.
d) 配施活性污泥萃取液可以促进水稻生长、改善土壤环境,表现出与有机肥在农业生产中相似的促进作用,表明活性污泥萃取液可作为一种潜在的有机肥应用于农业生产.

