生物制药行业项目环境影响评价要点探析
广东智环创新环境科技有限公司 姚嫚
过去十年左右,在良好的政策环境下,我国生物医药创新进步飞快,北京、上海、苏州、杭州、广州、深圳等创新资源丰富的城市,聚集了大量研发型生物技术公司,建立了系统完整的产业服务体系,实现了“1+1>2”的区域集聚效应。要继续巩固和深化这个优势,借此来优化相关生物制药行业的发展,争取创造出具有核心竞争力与较强影响力的生物产业发展模式。生物制药行业项目环境影响日益增多,在这种日益严苛环保政策下,结合笔者实际的工作经验,本文就此类项目环评工作中七个方面(生物制药行业项目特点、环评类别判定、相关符合性分析、环境影响评价等级判定、建设项目工程分析、污染防治措施、生物安全类型及防控措施)要点进行浅析,为做好此类项目环评工作提供一些参考。
一、生物制药行业项目特点
生物制药技术本身便是一类借助于各类活体生物来开展制药工作的一种方式,而目前看来,各类较为合理与有效的生物制药技术均已成为细胞工程开展工作与落实技术的一项基本要求,而生物制药技术与生物发酵工程技术等均已成为生物制药行业发展的基本应用技术之一。常见的生物制药产品包括单克隆抗体、疫苗、重组蛋白、血液制品、诊断试剂等。
从环境影响评价角度,生物制药行业具有以下几个特点:(1)相同类别的产品生产工艺基本相似,仅仅在原料配方和工程技术参数设计略有不同,产排污情况基本相同。(2)固体废弃物种类较多,处置量较大。(3)废水生物污染程度高。(4)具有生物安全风险。
二、环评类别判定
根据相关项目环境影响的评价要求可知,若是
单纯药品复配且产生废水或挥发性有机物;仅化学药品制剂制造的应该编制环评报告表,除此之外应编制环评报告书。目前各地方有出具地方分类管理名录细化规定,存在简化环评报告表的情形。
三、相关符合性分析
生物制药项目的环评要求与影响状态均需要根据技术应用过程中的地方变化情况与地方区域所颁布的条令要求与标准进行相符性分析,例如,《产业结构调整指导目录》一类的法律法规均对相关环境影响内容加以明文表述。
生物制药项目环境影响评价还应符合所在园区规划环评中的环境准入要求、污染物排放管控、产业控制带要求以及区域“三线一单”要求。正常情况下,工业园区选址是经过慎重评估的,不会涉及到生态保护红线范围,且整体工业园经过环境影响评价也是在地区的环境质量底线和资源利用上线范畴。因此,最主要的是要根据园区规划环评要求、结论和审查意见,以及规划环评提出负面清单进行相关符合性分析,需特别关注对水污染物类型、恶臭异味物质、生物风险的管控要求。
上述相关符合性分析的进行已成为各项工程开展时的一项基本内容,并且伴随着项目开展,其受到环境影响与评价工作影响的可能性也被进一步提高,成为了这一项目的一项基本要求。建设项目相关规划不相符,应与建设单位商议调整建设项目相关内容应满足相符性。
四、环境影响评价等级判定
针对编制环评报告书和编制专章环评报告表的生物制药项目环评的落实需要按照环境要素与环境影响情况进行等级划分后才可精准评定。确定其各环境要素的环评工作内容和深度。本文基于工业园选址是符合环保要求的,自建污水处理站排放进入市政污水管网,选址及周边不会涉及敏感生态保护红线等前提情况,对各环境要素的环评工作等级进行初步判定。(见表1)
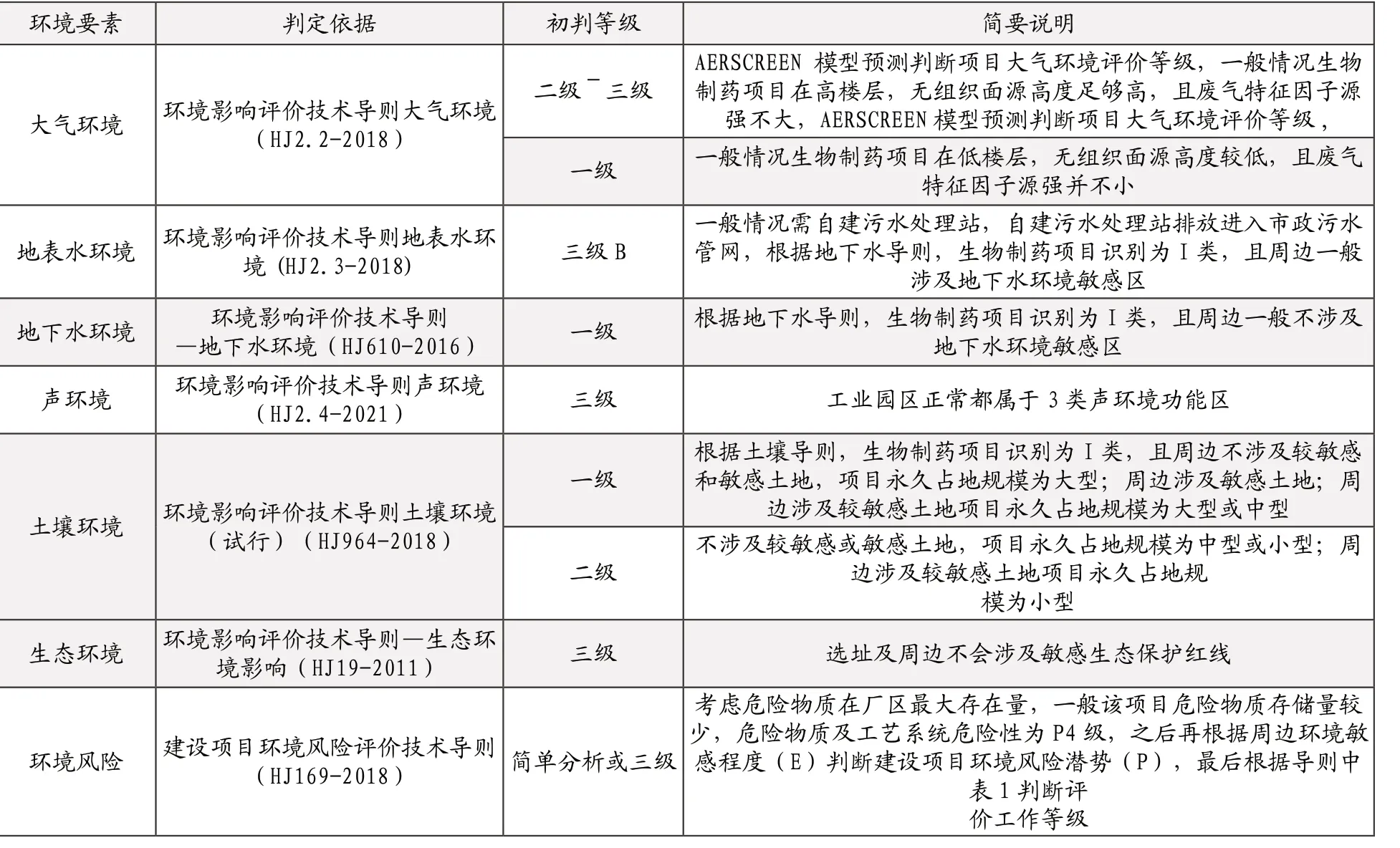
表1 生物制药项目进入专业规范工业园的环境影响评价等级初步判定
环境影响评价工作内容和深度是三级或者简单分析最低、一级最高,因此,根据上述初步判定,此类项目在大气环境、地下水、土壤环境方面可能面临较高等级判定,对于这三个环境要素环评报告可能需要进行较深入的环境影响分析,其他要素根据具体等级进行分析。
4.合适的碳水化合物:碳水化合物的每日平均需要量为150g/d,提供的能量应占总能量的55%~65%,同时应避免摄入过多的精制糖,并且要注意粗细搭配。
五、建设项目工程分析
工程分析工作目前已成为生物制药行业开展环境影响评价的主要方式。主要建设项目概况、产污分析、污染源源强核算等三个内容。据此,本文需要分别从建设项目概况、产污分析以及污染源源强核算三方面进行阐述。
(一)建设项目概况
生物制药项目概况主要介绍项目具体位置,项目工程组成及规模,产品方案,生产、质检、研发过程的公辅设备、主要原辅料等,公用工程概况,总平面图及内部布局图,物料平衡,水平衡等。
建设项目概况中,产品方案计算是重要的难点之一。生物制药项目基本是批次生产,一般需要识别工艺段耗时最长的作为制约工艺,将制约工艺耗时作为批次生产耗时,再根据年生产时间核算年批次数,结合批次生产量计算得到年生产产能。产品方案需交代各产品的生产批次、单批次产量、产品规格等信息。
建设项目概况中,注意不要漏掉质检和研发过程的工程介绍。在项目概况分析章节需详细说明项目相关的质检和研发实验室的设备、原材料和使用能源等情况。设备需交代种类、型号、数量和能源类型及用量,原材料需交代种类、年用量、最大在线量等。
建设项目概况中,注意不要漏掉公用工程中车间消毒灭活工程内容。车间消毒灭活工程是后续生物风险评价的基础考虑内容,需交代各个区域涉及灭活废水、固废等灭活方式,并在平面布局图中体现。
(二)产污分析
生物制药项目废气产污环节包括生产过程包括挥发性试剂配制,粉末料投料,生物发酵或呼吸,提取纯化,溶剂回收,动物排泄,质检和研发实验室,污水处理,储罐等。生物制药项目废水产污环节包括生产过程包括生产过程、实验室、洗衣房、制水过程、废气处理产生等。生物制药废水具有水量大且废水类型多,可能具有生物活性因此需要对各类粉水进行分类收集,确保处理结果的准确性,针对可能有生物活性的废水需要进行灭活处理。
生物制药项目固体废物类别较多,主要包括废产品、废一次性器皿、废树脂、废过滤器、实验室废液、废生物组织、废试剂、废酸废碱、污水站产生的固废等。
生物制药项目生产设备噪声产生节点不多,主要为公辅设备运行噪声,例如锅炉、冷却塔、风机、空压机及各类泵等。
(三)污染源强核算
生物制药废水量原则上可以根据实际工艺参数计算得来。在不清楚工艺参数前提下可参考相关污染源排放统计调查要求与测算标准进行分析,可以得出其中的生物药品制造行业系数表数据。以生产酵母素过程中发酵工艺为例,可根据此工艺年清洗次数、单次清洗量及用排水系数计算的年清洗废水量;也可根据276生物药品制造行业系数表,根据项目规模查询产污系数,可计算得到年废水量。生物制药废水中污染物浓度一般采用类比分析,发酵工艺化学需氧量、氨氮、总磷和总氮可参考《排放源统计调查产排污核算方法和系数手册》中数据。
生物制药废气产生环节较多,不同废气类型源强核算方法不同。粉末料投料过程产生的粉尘可查询《逸散性工业粉尘控制技术》[3]排放因子计算;挥发性试剂配制过程产生的TVOC可根据挥发量公式计算;生物发酵废气和提取纯化工艺废气可查询276生物药品制造行业系数表数据;溶剂回收过程产生有机废气根据有机试剂挥发量公式计算;动物排泄和污水处理站产生的恶臭物质可进行定性分析;目前在实验过程中所产生的酸雾与有机废气的存量均需要在计算后才可获取结果,而根据其要求来进行挥发量计算已成为必然要求之一,储罐计算的大小便是其主要内容之一。
六、污染防治措施
(一)废水污染防治措施
在废水防治措施方面,建设项目环评重点是根据“分质分流,分类收集”的原则,将项目过程产生生产废水进行合理分类。具有生物活性的废水应先灭活预处理;高浓度废水应该单独收集后至调节池进行混凝沉淀、气浮、氧化等预处理后与低浓度废水混合进入后续的生化处理工艺。
(二)废气污染防治措施
生物制药的废气污染对空气的污染性极强,因此为确保我国生态环境的可持续发展,本文采用以下方式进行处理研究。
①挥发性试剂配制过程可能会产生TVOC,一般试剂配制过程在通风橱内进行,经通风橱的管道排放至室外。
②动物细胞培养和微生物发酵过程会产生发酵废气或者呼吸废气,主要成分为CO2、H2O。通过发酵罐上的过滤阀过滤后,经过空调系统或者管道进入到处理系统或者排至室外。
③需特别关注涉及阳性对照试验的操作均在生物安全柜中操作,产生的生物气溶胶经过高效过滤器处理后柜内循环,部分经过管道或通排风系统排放至室外。
④提取纯化废气、溶剂回收废气主要包括酸碱废气和TVOC等,通过负压集气罩、通风橱或管道直连等方式收集进入到处理系统或者排至室外。
⑤粉末料投料过程会产生粉尘,通过负压集气罩收集,经过高效过滤设备处理后排至室外。
⑥动物排泄、污水处理站废气主要是NH3、H2S、臭气浓度等,经收集后通过废气处理设施侯排放。
⑦质检和研发实验废气主要为低浓度有机废气和酸性废气,废气可通过收集后至活性炭或喷淋装置处理后排放。
⑧储罐会产生大、小呼吸废气,主要在储罐区动静密封点处和物料装卸时,废气成分主要为酸性废气或TVOC,废气类型与存储物质相关。储罐小呼吸废气经收集至处理装置处理后高空排放。
(三)固废污染防治措施
特别需要注意的是具有生物活性的固废应通过灭活后暂存固废间;废生物组织应放置冰箱中冷冻暂存。定期针对各危废的分类委托有危废处置资质或者医疗固废处置资质的单位处置。
在这一过程中制药企业需要明确工业固废物管理要求,借助科学的固废物存储记录来构建相应的管理记录表,明确各类废弃物包括危险物品的存储方式与安放状态,危废在外运处置过程中需落实危险废物转移联单制度。
(四)土壤和地下水污染防治措施
生物制药项目需要明确各方面在生产生产过程中所需避免的污染效果,明确污染防渗区中间那几个重点区域普通区的划分情况。存放液态化学品的甲类库或试剂柜、防爆柜,原料、废液储罐区,(埋地)污水处理区,液态危废暂存区,污水管线等等区域均应作为重点污染防渗区,建立纯较为完善的房屋要求,考科一确保等效黏土的使用厚度满足渗透系数要求,从而确保获得优于渗透系数小于10-7cm/s的同等效果。其余生产车间区域则作为一般污染防渗区,提出合理的防腐防渗相关设计要求,进而使其满足防渗层达到15mm且渗透系数在10-7cm/s的同等效果。厂区一般道路和办公生活区等作为简单防渗区,仅做到地面混凝土硬化即可。
七、生物安全类型及防控措施
生物安全的基本要求便是现代生物技术应用安全而目前各类生物医药开发与生物医药生产过程中,并未建立起较为完善的病毒与微生物防护管理标准,导致可能出现感染的情况,因此为避免生产于是欧元人员感染情况出现,并维护部生态华景稳定,需要构建出较为完善的安全生产标准,确保安全防护与安全管理工作的顺利进行。
生物安全是指利用现代生物技术,在生物医药开发、应用及产业化过程中,对致病微生物的生产及实验安全防护与管理,其主要目的是防止生产和实验工作人员感染,或意外泄漏导致环境污染和社区人群感染。
生物安全等级应根据操作的微生物病原级别和类别确定,需按《制药工业污染物防治技术政策》、《生物安全实验室建筑技术规范》(GB50346-2011)、《微生物和生物医学实验室生物安全通用准则》等条款的要求对车间或实验室进行建设。生物安全柜自身拥有三类等级,从而在不同阶段确保符合生物要求要求与生物防疫要求,生物安全柜的设计等均由专业人员进行,确保设计标准与风险防护能力满足安全生产的基本要求,而生物安全柜的使用与防治可以避免出现功能降低的情况,保证其满足微生物存储的安全标准要求
八、结语
生物制药项目严格遵守国家和地方相应的法律、规范和标准,并满足园区规划环境影响报告要求、结论和审查意见。在具体环评工作时,需要明确评估对周边环境影响程度,并提出切实可行的防治措施。总之,在进行环境影响评价工作时要尽量结合项目实际情况,让项目在落地投产时不会对周边环境产生明显的影响。

