上海部分社区老年人群肌少症与营养状况的相关性研究
许又端,蔡文玮,陈谊,李晓丽,张超,李晨奕,徐苏
上海交通大学医学院附属第九人民医院,a 全科医学科,b 老年科,上海 201900
肌少症的发生与进展是由各种因素造成的,营养不良是其中一个危险因素[1]。由于受机体生理功能逐渐衰退及社会心理因素等影响,在老年人群中营养不良有较高的发生率[2]。目前,大部分肌少症和营养状况的相关性研究都来源于国外,缺乏对国内社区老年人群的研究。因此,本研究通过对上海社区老年人群进行肌少症与营养状况的筛查,明确老年人群肌少症患病率及影响因素,评估营养状况,并探讨两者的相关性,为社区老年人肌少症的防治和营养干预提供依据。
1 对象与方法
1.1 研究对象 选取2021年2月1日至2022年1月31日自愿参加上海市老西门、豫园以及友谊社区医院体检者为研究对象。纳入标准:(1)年龄≥60岁;(2)能独立完成问卷调查;(3)自愿参加本次研究。排除标准:(1)具有严重精神疾病、交流障碍、认知障碍等无法清晰表达及配合筛查者等;(2)患有急性疾病、癌症或目前感染者;(3)行动不便者;(4)置入人工关节或安装心脏起搏器而不能进行生物阻抗测定者。本研究已获中国注册临床试验伦理审查委员会审批。
1.2 调查方法 采取随机抽样方法对符合条件老年人进行相关流行病学调查。调查者和操作者都是经相关培训的医务人员。出现以下情况视为无效问卷:问卷答题数不完整;乱答题;内容不完整;信息不真实;一人重复填2份以上问卷,则第2份之后为无效问卷。
记录调查对象的年龄、性别、文化程度、慢性病患病情况,测量受试者的身高、体重、体重指数(BMI)。收集血白蛋白(Alb)、血红蛋白(Hb)、前白蛋白(PA)、总胆固醇(TC)、三酰甘油(TG)等实验室检测指标。
1.3 肌少症的诊断 ①肌肉量评估:采用人体成分分析仪(InBody 270)测量受试者的骨骼肌肌量和体脂量。骨骼肌质量指数(SMI)=骨骼肌肌量/身高2。诊断阈值为男性<7.0 kg/m2,女性<5.7 kg/m2。②肌肉力量评估:通过电子握力计(香山 EH101)测量受试者双侧手握力3次,记录最大值。诊断阈值为男性握力<28 kg、女性握力<18 kg。③肌肉功能评估:测量受试者以平常速度步行6 m所需时间,行走过程中不减速,共测量3次,记录最快值。诊断阈值为6 m步速<1.0 m/s。
根据2019年AWGS针对亚洲人群提出的肌少症诊断标准[3]:满足第①条,同时满足②或③可诊断为肌肉减少症。并由此将研究对象分为肌少症组和非肌少症组。
1.4 营养状况评估 采用微型营养评估量表(MNA)包括4个部分共18条问题组成[4]。(1)人体测量指标:体重、身高、中臂围、腓肠肌围、近3个月体重丢失情况;(2)整体评估:包括生活、心理、用药情况和医疗疾病状况;(3)膳食评估:包括食欲、每日摄食情况、摄食行为模式;(4)主观评定:对自身健康及营养状况的评价。MNA≥24分为营养情况良好,17分≤MNA<24分为有营养不良危险,MNA<17分为营养不良。
1.5 日常生活能力 采用日常生活能力量表(ADL)进行Barthel指数计分[5],包括10个项目(进餐、洗澡、修饰、穿衣、控制大便、控制小便、如厕、床椅转移、行走、上下楼梯)。总100分(日常生活完全独立),总分75~95分(轻度依赖),总分50~70分(中度依赖),总分25~45分(重度依赖),总分0~20分(完全依赖)。
1.6 认知功能评估 采用简易精神状态量表(MMSE)[6],包括定向力、记忆力、注意力和计算力、回忆能力、语言能力5部分。认知功能障碍判断标准按照教育程度加以纠正:文盲≤17分;教育程度1~6年≤20分;教育程度7年及以上≤24分可诊断为轻度认知功能障碍。
1.7 焦虑状况评估 采用汉密顿焦虑量表(HAMA)[7],HAMA所有项目采用0~4分的5级评分法,其总分分界值:总分超过29分,为严重焦虑;超过21分,肯定有明显焦虑;超过14分,肯定有焦虑;超过7分,可能有焦虑;小于7分,没有焦虑症状。
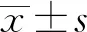
2 结果
2.1 一般资料 本研究纳入733例社区老年人,年龄(69.6±6.8)岁,其中男性273例、女性460例,肌少症发生率为19.37%(142/733)。肌少症组与非肌少症组的年龄、体重、BMI、体脂量、文化程度、慢性病患病数目、日常生活能力、焦虑状态、白蛋白、血红蛋白、MMSE和MNA 得分差异均有统计学意义(P<0.05)。见表1。

表1 肌少症组和非肌少症组一般临床资料比较
2.2 肌少症的影响因素 logistic多因素回归分析显示,年龄、体脂量、慢性病患病数目是肌少症的危险因素(OR>1);BMI、白蛋白、MMSE得分是肌少症的保护因素(OR<1)。见表2。

表2 肌少症的多因素分析
2.3 不同营养状态下肌少症的构成比 经MNA评分后,将受试者根据营养状况分为营养良好、有营养风险、营养不良3组,所有受试者中营养不良风险和营养不良比例分别为17.33%和1.64%。营养不良组肌少症的发生率(66.67%)高于营养不良风险(25.98%)和营养正常组(17.00%),差异有统计学意义(P<0.05)。见表3。

表3 不同营养状况老年人肌少症的患病情况[例(%)]
2.4 MNA分组营养指标比较 对3组采用单因素方差分析,结果显示随着营养状况从正常向不良发展,血红蛋白、血清白蛋白、血清前白蛋白、总胆固醇、三酰甘油以及BMI、SMI、握力、步速等指标逐步降低,差异有统计学意义(P<0.05)。见表4。
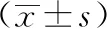
表4 不同营养状况的老年人各营养指标的差异
2.5 营养状况与各临床参数的相关性分析 通过营养状况与各临床参数的相关性分析发现,体重、BMI、SMI、步速、握力、血红蛋白、血清白蛋白、血清前白蛋白、总胆固醇、三酰甘油与MNA得分存在正相关。见表5。

表5 营养状况与各指标的相关性
3 讨论
本研究采用亚洲肌少症工作组2019年的诊断标准,发现上海社区60岁以上人群肌少症发生率为19.37%,不同性别间患病率无明显差异,这与张艳等[8]调查结果一致。本研究显示,年龄是肌少症的危险因素,其中≥80岁老年人发生率最高为39.71%,较60~69岁老年人约高3倍;随着年龄增加,肌少症患病率逐渐增加,与以往我们的研究一致[9]。本研究中慢性疾病主要包括高血压、糖尿病、冠心病、脑梗死个人史、慢性阻塞性肺疾病、慢性胃病、慢性肾脏病、骨质疏松、骨关节炎等,结果显示患病数目为肌少症的危险因素,可能与疾病产生的一系列病理反应引起肌少症有关。有研究表明老年人运动量下降,自噬活性过度升高,长期营养不良导致的蛋白质摄入与合成减少,慢性炎症反应以及激素水平变化例如胰岛素抵抗与维生素D减少可能与肌少症发生发展相关[10]。本研究显示BMI为肌少症的保护因素,体脂量为肌少症的危险因素。近来有研究提出了一种特殊的情况,即少肌性肥胖,这是一种肌少症与肥胖共存的状态,脂肪浸润到骨骼肌中,脂肪细胞可引起炎症,氧化应激期间产生的氧自由基可以直接介导肌肉损伤[11]。因此老年人在不肥胖的情况下保持较高的BMI可能会有利于预防肌少症的发生。
本研究显示,上海市部分社区老年人群中营养不良风险和营养不良比例分别为17.33%和1.64%,与既往的数据相似[12-14]。另外,本研究也发现非肌少症组MNA得分高于肌少症组,且营养不良组肌少症发生率明显高于营养不良风险组和营养正常组,差异有统计学意义,说明营养不良与较高的肌少症发生率密切相关,可能与老年人肌肉蛋白质的合成减少有关。
本研究显示营养不良老年人的SMI、握力、步速均低于营养不良风险组与营养状况正常组,且相关性分析显示握力、步速、SMI与MNA呈正相关,说明较好的营养状况可能降低肌少症发生的风险。原因可能是因为营养不良老年人由于营养物质摄入量不足及消化、吸收、或利用摄入的营养物质的能力降低,导致骨骼肌丢失、表现下降及力量丧失,也可能增加跌倒和受伤甚至残疾的风险。
有研究表明一些血液指标如Hb、Alb、PA、TC、TG等在营养评定中可能发挥一定的作用[15]。其中Alb和PA可以反映患者机体蛋白质状况。Alb水平能很好反映营养的储备状态,PA的半衰期在1~2 d,能够及时反映当下的营养状态[16]。本研究显示营养不良的老年患者组Hb、Alb、PA、TC、TG均低于营养不良风险和营养正常的老年患者,且相关性分析显示Hb、Alb、PA、TC、TG与MNA呈正相关,可能提示这些指标可作为预测营养不良或营养不良风险的指标。因此,临床上若出现上述指标明显降低的情况,则需要警惕患者是否已经存在营养不良或者有营养不良的风险。但因为血清Alb和PA的浓度在急性炎症应激下显著降低,起到“负急性期蛋白”的作用,所以对于感染、急性炎症或近期外伤患者,必须谨慎解释这2种血清蛋白的测量结果[15]。
综上所述,肌少症与营养状况有一定的相关性。营养不良老年人的SMI、骨骼肌力量及功能较营养状况正常的老年人降低,同时营养相关指标水平降低。对于社区老年人群有必要积极开展营养状况筛查及评估,尽早发现营养不良和肌少症老年人群,及时进行营养干预,降低营养风险,从而减少肌少症发生的风险,改善预后结局,提高老年人的生活质量。

