基于UPLC-MS/MS分析不同生态型香蕉品种青果皮的主要酚酸成分
张 晶,刘立娜,杨宝明,王永芬,3,何 平,徐胜涛,尹可锁,李 舒,白亭亭,李永平,李迅东,郑泗军,4
(1云南省农业跨境有害生物绿色防控重点实验室/云南省农业科学院农业环境资源研究所,昆明 650205;2江南大学环境与土木工程学院,江苏无锡 214122;3云南省农业科学院热带亚热带经济作物研究所,云南保山 678000;4国际生物多样性中心,昆明 650205)
0 引言
香蕉是一种重要的热带和亚热带水果及粮食作物[1],是世界上产量和消费量最大的水果之一[2-3]。根据2020年联合国粮食及农业组织(FAO)数据,印度是全球最大的香蕉生产国,其次是中国,年产量分别达到3046万、1200万t[4]。香蕉皮约占果实质量的40%[5],香蕉皮废料通常会被随意倾倒在河流、湖泊或低洼的垃圾填埋场中[6],缓慢降解直到腐烂并形成甲烷和二氧化碳以及其他有毒气体,如硫化氢和氨,影响附近的生态系统[7],造成严重的环境破坏。因此,香蕉皮废料需要回收或再利用,而不是丢弃或焚烧[6]。
作为农业废弃物的香蕉皮是吸附剂的理想材料,并且它对各类污染物有较好的吸附作用[8-9]。而最近香蕉皮被越来越多地报道为酚酸的重要来源[10],尤其是青香蕉皮,酚酸被认为是强大的天然抗氧化剂,具有抗诱变、抗病毒、抗血栓、食品添加剂和信号分子的生物学和药理学特性[11]。对于香蕉皮酚酸的研究已经开展很多[12-13],有研究表示没食子酸、奎尼酸、原儿茶酸、儿茶素、绿原酸、阿魏酸和芦丁是其主要的酚酸[14-15],它们与香蕉皮的抗氧化性质紧密相关。然而,对于不同品种青香蕉皮中主要酚酸天然含量的测定研究较少。因此,迫切需要开发一种分析方法来测定来自不同香蕉品种青果皮中酚酸的含量。
许多分析方法已用于测定水果中的酚酸含量,包括毛细管电泳(CE)[16]、薄层色谱(TLC)[17]、高效液相色谱(HPLC)[18]和气相色谱-质谱联用(GC-MS)[19]。但是,使用 CE[20]、TLC[21]和 HPLC[22]等方法存在耗时长、灵敏度低的问题,GC-MS只能分析600 D以下的小分子酚酸。而UPLC-MS/MS具有比上述分析方法更高的灵敏度、选择性以及更短的分析时间,并且能同时测定多种酚酸[23-24]。因此,本研究提出使用UPLC-MS/MS法测定不同品种青香蕉果皮中的酚酸含量,以期为不同生态型香蕉品种青果皮中酚酸的合理利用以及香蕉副产物的充分利用提供数据支撑。
1 材料与方法
1.1 材料
1.1.1 试验样品 供试的10份香蕉种质资源是从国际生物多样性研究中心引进,云南省农业科学院农业环境资源研究所农业生物多样性与香蕉研究团队经过组织培养快速繁殖,然后种植在云南实验基地。这10份香蕉种质资源分别为来自马来西亚的‘Pahang’,来自非洲的‘Inkira’和‘Kazirakwe’,以及国内通过选育和栽培的品种‘巴西蕉’、‘热科2号’、‘热科4号’、‘南天黄’、‘宝岛蕉’、‘中蕉8号’和‘云蕉1号’。
1.1.2 试剂 芦丁购自上海安谱化学试剂有限公司(含量≥99.5%,批号280018),绿原酸、儿茶素和原儿茶酸购自美国Sigma公司(含量≥99.9%,批号00500590、43412、46933),奎尼酸、阿魏酸和没食子酸均购自中国药品生物制品检定所(含量≥99.9%,批号WJ-110885、WTS-13455、WTS-7029)。甲醇、乙腈为色谱级(美国Fisher公司),实验室用水由Millipore纯水仪制备。
1.1.3 仪器 AB SCIEX超高效液相色谱串联三重四极杆质谱,液相配有二元高压泵、自动脱气机、自动进样器、柱温箱及MultiQuantTM定量软件;三重四极杆串联质谱仪AB SCIEX Exion AD Q-Trap 6500+System(美国AB SCIEX公司),配备电喷雾离子源(ESI);PURELAB Option Q5超纯水制备仪(英国ELGA公司);KH-500B型超声仪(昆山禾创超声仪器有限公司);AllegraX-22高速冷冻离心机(美国Beckman公司)。
1.2 方法
1.2.1 色谱和质谱条件 Agilent ZORBAX Extend-C18色谱柱(2.1 mm×100 mm,3.5 μm)。流动相A相为甲醇、B相为0.2%甲酸水溶液,梯度洗脱(0%~2%A 1 min,2%~15%A 1.5 min,15%~55%A 1.5 min,55%~70%A 1.5 min,70%~90%A 1 min,90%~2%A 1 min,2%A 1.5 min)。流速0.3 mL/min,进样量5 μL,柱温35℃。
质谱采用电喷雾离子(ESI)源,检测模式为负离子模式,多反应监测,去溶剂温度为500℃,离子化电压为-5500 V,气帘气0.26 MPa,喷撞气压0.07 MPa。
1.2.2 标准品配制 称取上述标准品,用超纯水溶解为200 mg/L的单标溶液。使用时用超纯水进行稀释,配制成不同浓度的混合标准溶液。
1.2.3 样品的前处理 参照香蕉成熟度色卡采收7成熟的青香蕉,用小刀将果皮与果肉分离开,称取100.0 g新鲜香蕉果皮,清洗切片后,然后将其放入50℃烘箱中干燥7~8 h,称重,粉碎机粉碎,经60目筛筛分制成粉末使用。
使用单因素考察和正交4因素3水平L9(34)对香蕉果皮酚酸的提取条件进行优化。精密称取香蕉果皮粉末1.0 g,置于50 mL离心管中,加入30%的乙腈50 mL,涡旋振荡10 s,然后70℃超声提取40 min,5000 r/min离心10 min,取15 mL上清液于新的离心管中,以上操作重复3次,最终得到45 mL的上清液,涡旋混匀,过0.22 μm微孔滤膜,即得供试品溶液。
1.3 数据分析方法
所有试验数据均为平行3次或6次后取平均值,采用IBM SPSS Statistics 22软件和Origin 2017版进行试验数据统计分析。所有的统计检验均采用双侧检验,P≤0.05将被认为所检验的差异有统计学意义。计量资料服从正态分布者采用平均数±标准差表示,多组间比较采用One-wayANOVA分析
2 结果与分析
2.1 色谱条件优化
为了获得目标分析物的最佳分离效果,采用不同浓度的流动相(0.05%、0.1%、0.2%甲酸水溶液),考察了不同混合溶剂(如甲醇-水和乙腈-水)在不同流动相比例和柱温下分离的可行性,以优化C18色谱柱的分离条件。结果表明,乙腈和甲醇均能洗脱这7种化合物,乙腈的洗脱能力高于甲醇,7种化合物在乙腈中很难分离,因此选择甲醇作为有机相以更好地分离这些化合物。在水相中加入酸,使分离时分辨性准确和峰形良好,但在负离子模式下,高浓度的甲酸会抑制这些化合物的丰度,降低灵敏度。温度对色谱峰的形状和面积影响不明显。因此,经过试验,甲醇-0.2%甲酸水溶液是分离这7种化合物的适宜流动相。7种目标物在最优条件下的谱图见图1。

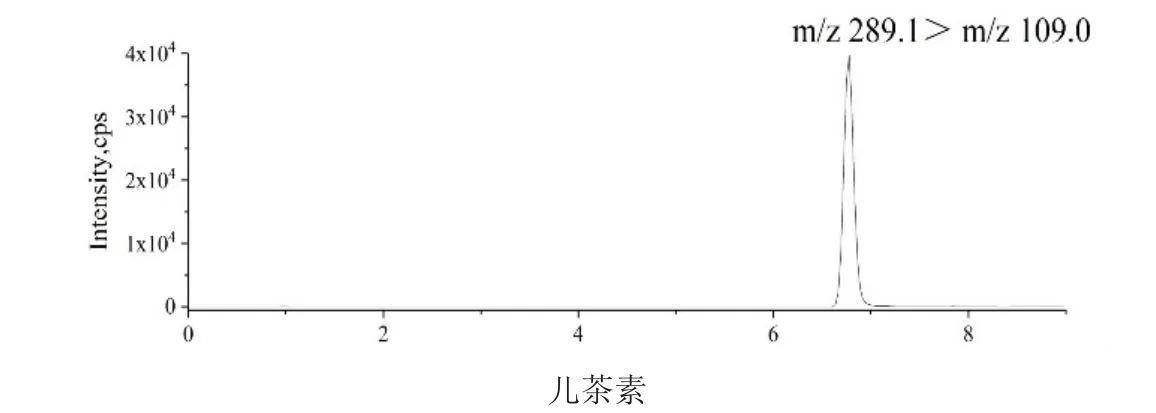
图1 香蕉青果皮中7种酚酸化合物的MRM色谱图
2.2 质谱条件优化
分析方法的发展过程始于质量参数的优化。在质谱系统中,首次在全扫描模式(m/z100~300)下用Q1四极杆质谱探索离子模式和母离子,用以发展MRM方法。将浓度为200 ng/mL的待测目标物标准工作液通过蠕动泵,以3 μL/min流速直接注入质谱进行全扫描分析,分别在正离子和负离子模式下进行电喷雾离子扫描(ESI)。7种化合物均在负离子模式下响应更高,进行负离子模式监测,且丰度最高的准分子离子峰[M-H]-作为母离子,通过子离子扫描模式,找到目标物的碎片离子,并以2个丰度较高的离子作为子离子,并对碰撞能(collision energy,CE)和去簇电压(declustering potential,DP)进行优化。所有优化的MRM参数详见表1。

表1 香蕉青果皮中7种化合物的保留时间及质谱分析参数
2.3 方法学验证
2.3.1 线性范围、检出限和定量限 将质量浓度为10、20、50、100、200、500、1000 ng/mL的7个混合标准品溶液在最优条件下进行测定,以目标化合物的相对峰面积为纵坐标、与其对应的各化合物的质量浓度为横坐标制成标准曲线。结果发现,7种化合物的相关系数r2为0.9992~0.9999,各目标化合物在各自的线性范围内呈现较好的线性关系。分别以3倍信噪比(S/N=3)和10倍信噪比(S/N=10)来确定分析方法的检出限(LOD)和定量限(LOQ)。香蕉青果皮7种化合物的回归方程、相关系数、线性范围以及检出限和定量限的结果参数如表2所示。
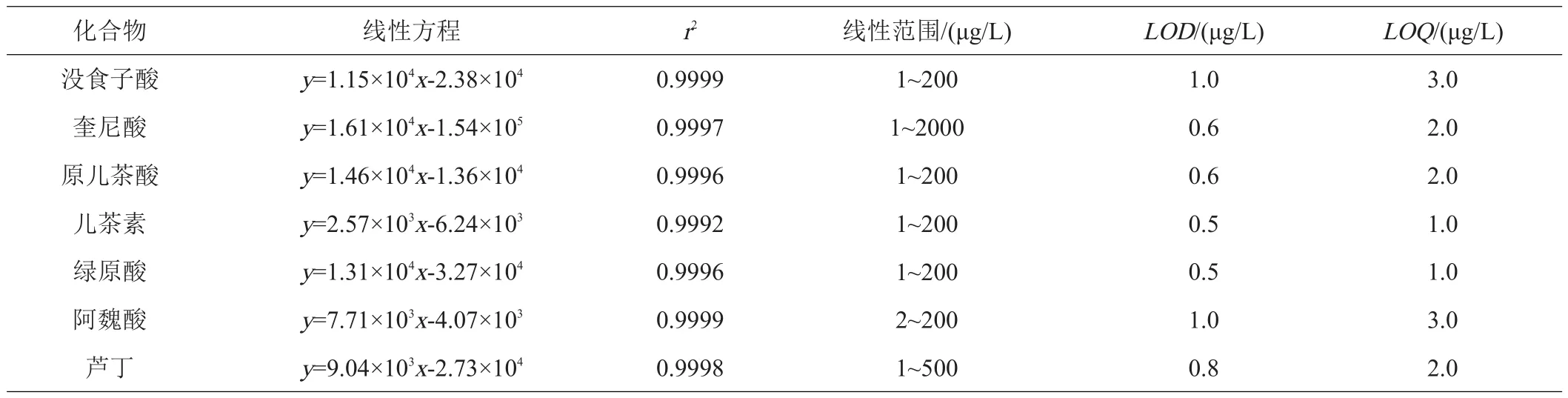
表2 香蕉青果皮7种化合物的回归方程、相关系数、线性范围、检出限和定量限
2.3.2 方法的回收率和精密度 精密称取香蕉果皮样品6份,每份1.0 g,以低、中、高3个浓度向样品中添加各标准品[25],混合后,按照1.2.3中的试验方法制备供试品溶液,按上述分析方法进行测定,每个浓度水平需平行测定6份,记录这7个目标成分的峰面积,对加标回收率和精密度进行考察。结果表明,7个化合物在线性范围内的平均加标回收率为84.37%~92.17%,相对标准偏差为2.21%~10.96%(表3),证明该分析方法具有良好的准确性。其日内精密度在3.75%以下,日间精密度在10.10%以下,满足定量分析要求(表4)。
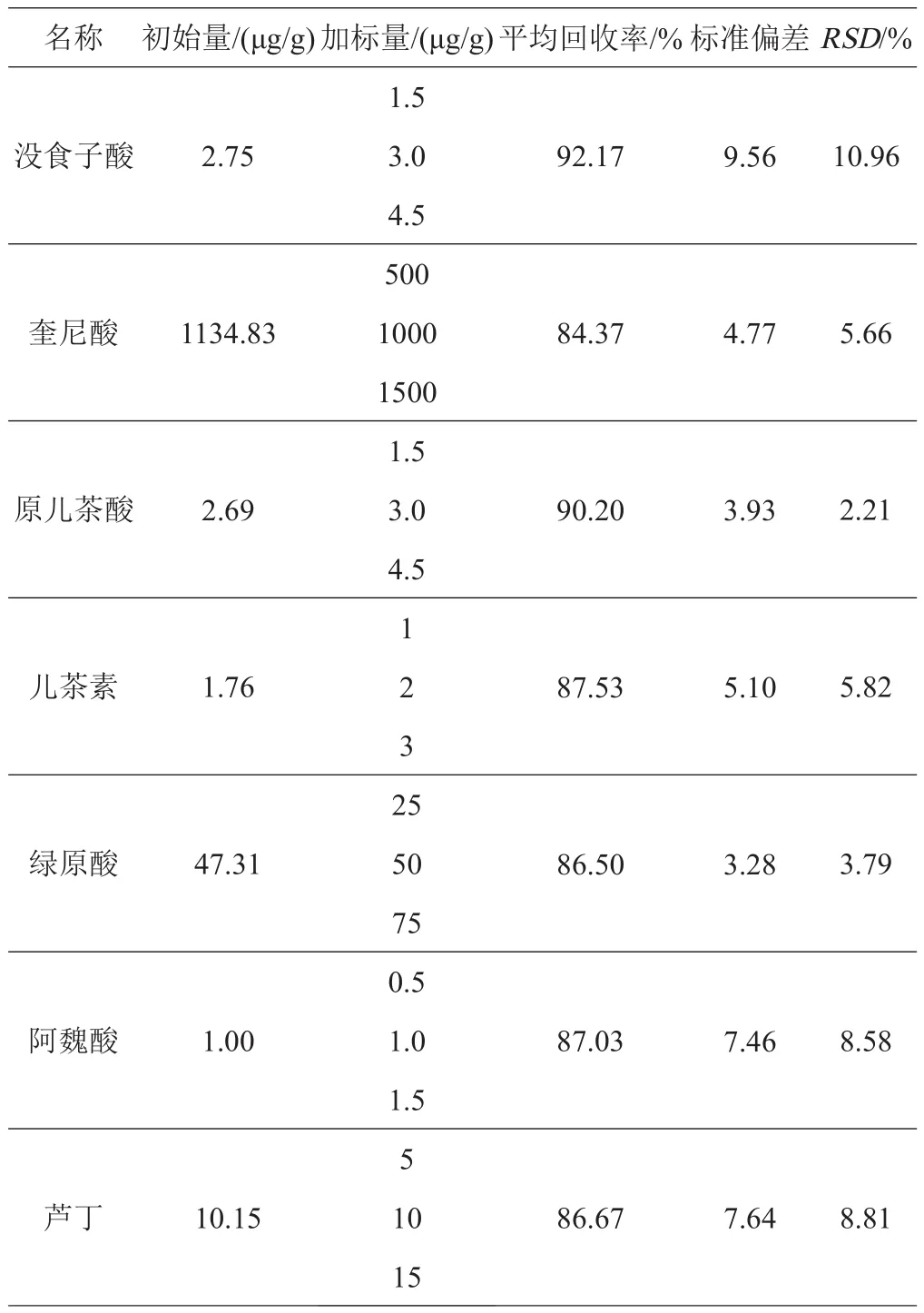
表3 7种酚酸化合物在香蕉青果皮中的加标回收率
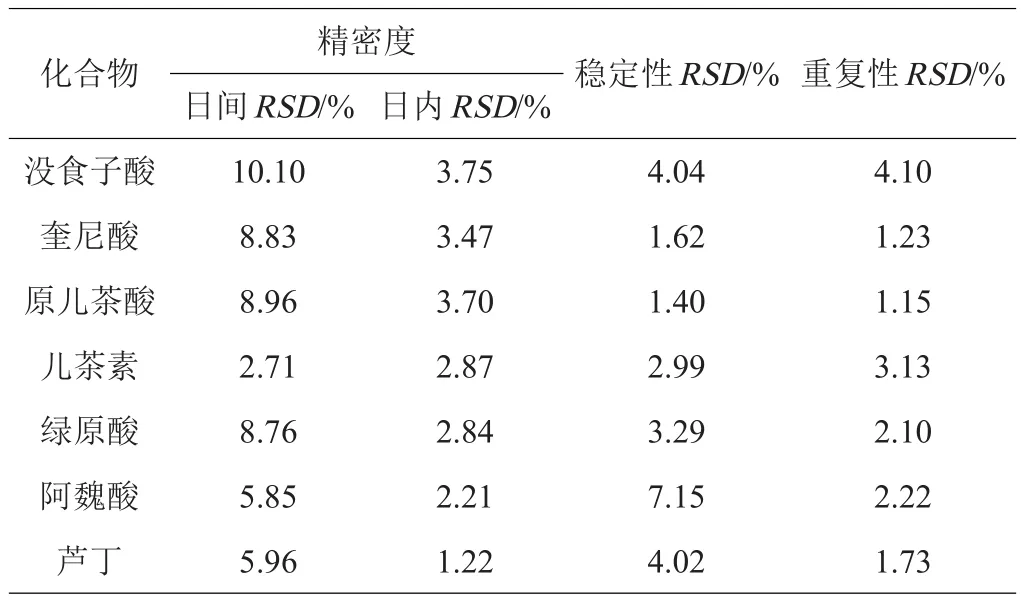
表4 7种酚酸化合物在10个香蕉品种青果皮中的精密度、稳定性和重复性
2.3.3 稳定性和重复性试验 精密称取香蕉果皮粉末7份,按照1.2.3的试验方法制备供试品溶液,室温下存放,分别于0、2、4、8、12、24、36 h取样,按1.2.1项下色谱条件进样分析,结果(表4)表明,7个目标化合物的色谱峰相对峰面积的RSD均小于7.15%,供试品溶液在给定的条件下稳定性良好。
精密称取同一批次香蕉果皮粉末样品6份,按1.2.3项下方法制备供试品溶液,按1.2.1项下色谱条件分析,记录峰面积。结果(表4)表明,7个目标化合物的色谱峰相对峰面积的RSD均小于4.10%,方法的重复性良好。
2.4 实际样品测定
香蕉青果皮样品经过前处理,在优化的试验条件下,测定7种主要酚酸的含量。表5结果表明,这7种酚酸在不同香蕉品种青果皮间含量差异显著。在10个香蕉生态型品种的青果皮提取物中,奎尼酸在7种主要酚酸中占据主导地位,绿原酸和芦丁次之,原儿茶酸和没食子酸含量最低(表5~6)。‘Pahang’青果皮中奎尼酸的含量最高,为172.25 mg/(100 g干重)。‘Pahang’和‘Kazirakwe’的绿原酸含量最高,显著高于其他品种(P<0.001)。‘Pahang’青果皮中芦丁的含量是其他品种的4~200倍。‘Pahang’中所含儿茶素、阿魏酸和原儿茶酸的含量显著高于其他9个品种,‘Pahang’和‘热科4号’的没食子酸含量最高,显著高于其他8个品种(P<0.001)。将这10个香蕉生态型品种按照可食用情况分为鲜食蕉和非鲜食蕉,‘Pahang’、‘Inkira’和‘Kazirakwe’属于非鲜食蕉,其他7个品种属于鲜食蕉。非鲜食蕉青果皮中绿原酸、芦丁和总酚酸的含量显著高于鲜食蕉(P<0.001)。

表5 不同香蕉品种青果皮主要酚酸含量 μg/g
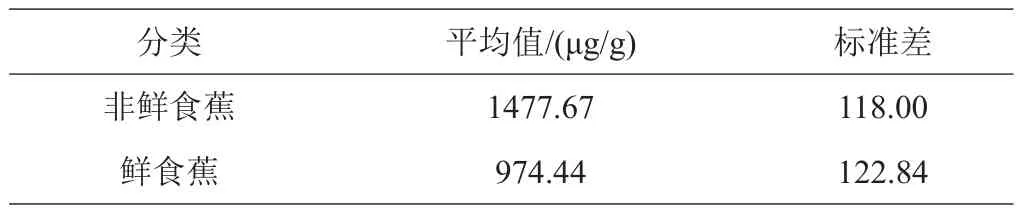
表6 鲜食蕉与非鲜食蕉青果皮总酚酸含量的比较
3 结论
本研究建立了一种同时测定不同生态型香蕉品种青果皮7种主要酚酸类化合物的UPLC-MS/MS分析方法,在9 min内这7种酚酸化合物被有效分离,分析物的检测限和定量限分别为0.5~1.0、1.0~3.0 μg/L,回收率为84.37%~92.17%,重复性为1.15%~4.10%。本试验提出的方法综合超高效液相色谱高效分离和质谱高质量准确度的特点,实现了香蕉青果皮中7种主要酚酸化合物的同时测定,该方法分析时间短、简单快速、灵敏度高、选择性好、准确性高,可为有效提取、快速测定香蕉青果皮中主要酚酸化合物并实现其高效利用提供技术支持。结果表明,7种酚酸在不同香蕉品种青果皮间含量差异显著。在10个香蕉生态型品种的青果皮提取物中,奎尼酸在7种主要酚酸中占据主导地位,绿原酸和芦丁次之,原儿茶酸和没食子酸含量最低。非鲜食蕉青果皮中绿原酸、芦丁和总酚酸的含量显著高于鲜食蕉(P<0.001),尤其以非鲜食蕉中的‘Pahang’青果皮酚酸含量最高,达到2.12 mg/g。
4 讨论
酚酸类化合物是高等植物体内普遍存在的次生代谢产物。在酚酸类化合物的分离中,由于酚羟基和羧基在水溶液中易发生电离,极性增强,在固定相表面会形成双重保留,色谱峰拖尾严重,若加入酸性调节剂可使酚酸的电离受到抑制,有利于增强在固定相上的保留。试验中笔者通过对不同配比的流动相系统乙腈-水、甲醇-水进行分离效果的考察,流动相的pH通过不同的酸来调节,最终发现甲醇-甲酸水溶液的分离效果较好,进而优选确定甲醇-0.2%甲酸水溶液作为流动相。由于等度洗脱分析时间较长,且极性相近的成分较多,对成分测定有很大的干扰,故使用梯度洗脱,按照优化好的色谱条件,7种酚酸在9 min内被有效分离。这与周亚萍等[26]在20 min内将玉米幼苗叶片中的4种酚酸类化合物有效分离,杨春霞[27]在46 min内将枸杞中的9种酚酸化合物完全分离相比,本试验优化的色谱条件大大缩短了酚酸的分离时间。
测定结果证实了香蕉青果皮中酚酸化合物的组成和含量随品种的不同而存在显著差异[28-29],这与Passo Tsamo等[30]的研究相似。此外,芦丁在所有芭蕉品种和鲜食蕉‘Gros Michel’青果皮中占据主导地位,但它在‘hybrids(F568)’品种果皮中含量很低,甚至在鲜食蕉‘Grand Nain’品种果皮中没有发现芦丁。同样,Suleria等[10]报道绿原酸在所测香蕉品种的青果皮中含量最高,但在所测品种果皮中均没有发现原儿茶酸。
本研究结果显示,非鲜食蕉的青果皮酚酸含量显著高于鲜食蕉,尤其以非鲜食蕉中的‘Pahang’青果皮酚酸含量最高,并且非鲜食蕉的果皮占整个香蕉鲜重的比例很高[30],因此非鲜食蕉的7成熟青果皮是获取酚酸的优质来源。Borges等[31]也指出在非鲜食蕉的7成熟青果皮中酚酸含量高于鲜食蕉,并且发现鲜食蕉‘Ney Poovan’和非鲜食蕉‘Tiparot’在第5阶段黄绿色香蕉果皮中酚酸含量最高,所以香蕉果皮酚酸化合物的组成和含量不仅受品种的影响,成熟度也是对其含量影响比较大的因素[32]。所以下一步将选取不同成熟度的香蕉果皮进行试验,探索成熟度对香蕉果皮酚酸含量的影响。
本试验为选择酚酸含量高的青香蕉果皮材料,将其作为膳食补充剂、食品添加剂和药物制剂等在食品和制药工业中进行更好地利用提供了方法和数据方面的支持。从香蕉果皮中提取酚酸可以开发香蕉果皮的利用价值,并且香蕉皮残渣可用作堆肥作为磷钾来源,从而实现香蕉副产物的充分利用。下一步仍需增加香蕉品种尤其是非鲜食蕉的品种,同时对不同成熟度的果皮和果肉进行酚酸类化合物含量的测定,以此更加全面地了解不同成熟度、不同品种香蕉中果皮和果肉酚酸化合物含量的差异,为今后高效利用香蕉果皮和果肉提供方法和科学参考。

