汉江上游干支流沉积物细菌群落多样性和影响因素
朱庆威,潘保柱,孙 贺,何浩然,赵耿楠
(西安理工大学西北旱区生态水利国家重点实验室,陕西 西安 710048)
河流沉积物是自然环境的基本组成部分和元素迁移转化的载体,在水生生态系统营养循环中既是源又是汇[1-2],是水体和陆地的重要污染物储存库[3]。在河流生态系统中,沉积物对人为干扰和自然灾害引起的环境条件变化非常敏感[4],沉积物中的细菌多样性是水质评价的重要指标,能反映河流的污染程度和河流沉积物中污染物的迁移和转化规律[5-6],细菌群落结构的形成是长期环境变化作用的结果;且细菌群落在物质循环和能量输运中起着关键作用,反映了不同的生态功能[7],因而沉积物细菌群落结构可以很好地反映细菌环境变化的贡献以及对环境干扰的反馈[8-9]。
阐明细菌群落组成和确定多样性分布的原因是细菌生态学的核心目标[10-11],其中生态位理论和中性理论最为重要[12-13]。生态位理论认为生物群落由环境选择和生物相互作用调控,属于确定性过程[14-16];中性理论认为群落中所有的物种具有相同的竞争和扩散能力,因此群落的组成受随机漂移的影响,随机过程塑造生物群落[17-18]。近年来,在海洋[19]、土壤[20]、湖泊[16]和河流水体[21]中已经证实中性过程在塑造生物群落中发挥重要作用,而针对沉积物细菌群落构建机制的研究[22]较少。
本文选取丹江口水库以上的汉江上游以及源于秦岭南麓的5条典型支流为研究对象,由于人为干扰和自然环境的影响,这些河流呈现强烈的环境梯度和相当大的生境异质性,为探索不同驱动因素在河流生物群落中的作用提供了一个理想的试验场[23]。该地区是北亚热带和暖温带的过渡地带,地貌景观独特,是我国重要的生物多样性热点地区之一[24]。针对该流域沉积物细菌群落构建的影响机制的研究尚未见报道,对沉积物细菌群落结构的调控机制尚不清楚。本文采用高通量测序技术对汉江上游干流以及5条支流开展了系统的水化学和沉积物细菌群落研究,分析沉积物细菌群落形成过程中所受的生态机制影响,旨在了解汉江上游及其支流沉积物细菌群落的影响机制,确定影响细菌群落形成的主导过程。
1 材料与方法
1.1 研究区域与采样方法
汉江是长江最大的支流,发源于秦巴山地的宁强县,其中丹江口以上为汉江上游,它的支流发源于秦岭山脉。南水北调中线工程的水源地为丹江口水库,因此汉江上游及其支流是南水北调中线工程的来水区。汉江上游长约400 km,流域面积约5.47万km2。汉江流域年平均气温14℃,年平均降水量895 mm,5—10月为汛期,降水量约占全年的80%。
在2017年11月和2018年4月对32个断面进行了取样。其中汉江上游选取7个断面,每条支流(湑水河、金水河、月河、旬河、金钱河)各选取5个断面(图1)。以采样断面为中心,上下游各50 m的范围为采样区域,每个断面设置3个采样点,每个采样点之间距离20 m。采用抓斗式采泥器采集沉积物表层样品,样品采集后,将每份样品一分为二,一份约1 kg,立即放入无菌的聚乙烯自封袋中,用于理化指标的测定,采集后迅速运回实验室进行后续处理;另一份装入无菌离心管中保存于-80℃的环境中,用于细菌群落结构分析。每个断面3个采样点的沉积物样品混合均匀。沉积物样品总磷(TP)、总氮(TN)、总有机碳(TOC)的理化特性检测按照《土壤农业化学分析方法》[25]进行,土壤粒径使用马尔文Mastersizer 2000激光粒度仪测量。
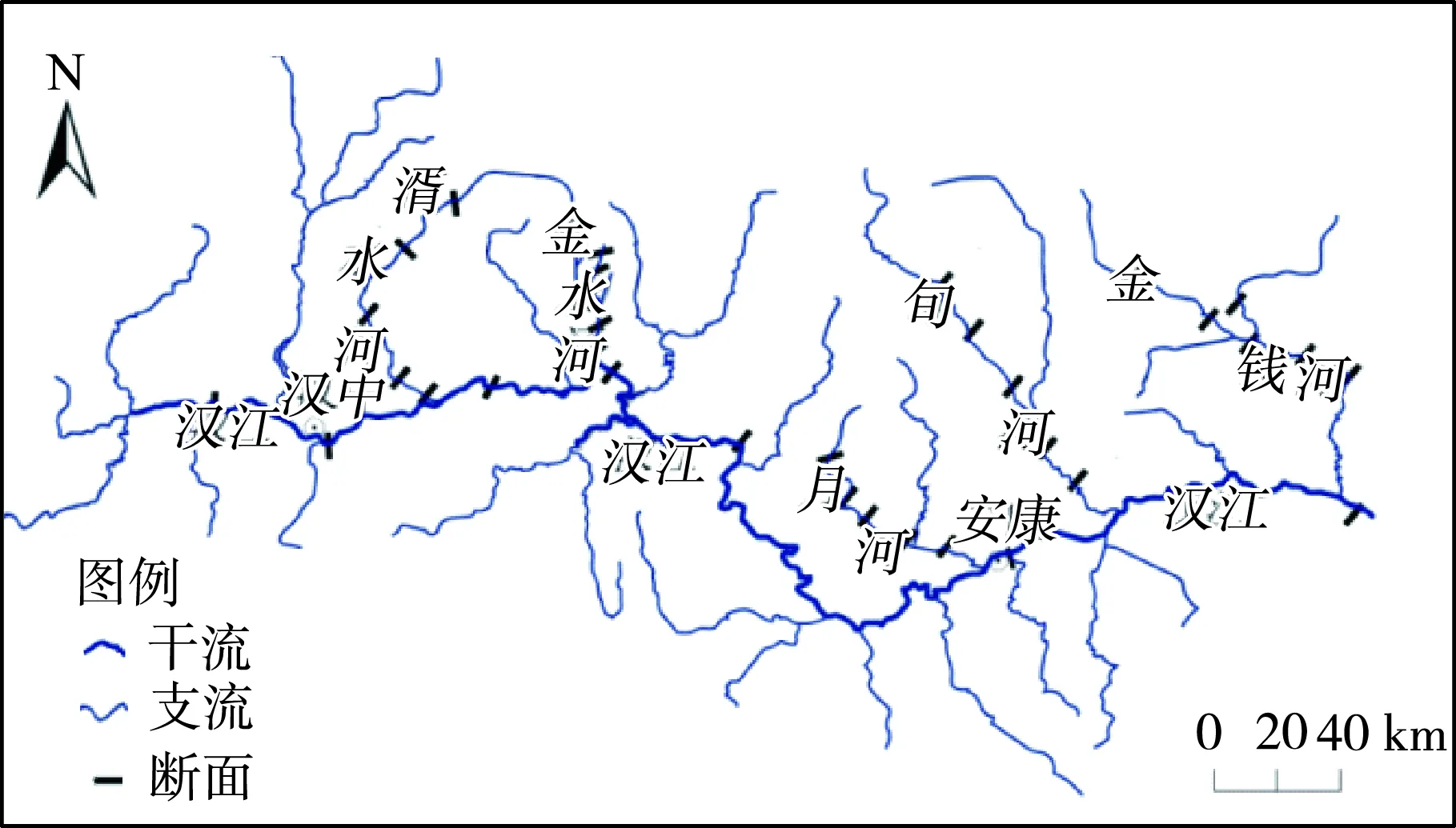
图1 汉江上游干支流采样断面分布Fig.1 Location of sampling sections in upper reaches of the Hanjiang River and tributaries
1.2 DNA提取、扩增和测序
称取约0.5 g经冷冻干燥后的底泥样品,使用MOBIO PowerSoil®试剂盒提取DNA,利用Thermo NanoDrop One分光光度计检测DNA的完整性、纯度和浓度。以基因组DNA为模板,使用带barcode的特异引物及TaKaRa Premix Taq®Version 2.0(宝日医生物技术(北京)有限公司)进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。对细菌16S rRNA的V4、V5区域进行PCR扩增,引物为515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和907R(5′-CCGTCAATTCMTTTRAGTTT-3′)[26]。PCR反应体系包括20 ng/μL的DNA 3 μL,0.01 mol/L前、后引物各1 μL,2x反应缓冲液25 μL。PCR反应条件:94℃预变性5 min;接着30个循环为:94℃变性30 s,50℃退火30 s,72℃延伸30 s;最后72℃延伸10 min,在4℃下存储。每个样本进行3次重复,并将同一样本的PCR产物进行混合。用1%琼脂糖凝胶电泳检测PCR产物的片段长度和浓度,主带长度在正常范围内(300 bp左右)的样品可用于进一步的试验。利用GeneTools软件(Version 4.03.05.0,SynGene)对PCR产物进行浓度对比,按照等质量原则计算各样品所需体积,将各PCR产物进行混合。使用E.Z.N.A.®Gel Extraction Kit凝胶回收试剂盒回收PCR混合产物,Tris-EDTA缓冲液洗脱回收目标DNA片段。按照NEBNext®UltraTMII DNA Library Prep Kit for Illumina®(New England Biolabs,美国)标准流程进行建库操作。使用Illumina MiSeq2500平台进行测序。
1.3 数据预处理
原始FASTQ文件使用QIIME 2(版本2019.01)进行质量控制、标注和统计计算[23,27-28]。处理和分析已去除引物和低质量的序列,然后使用DADA2对序列进行降噪,以获得精确序列变体(Amplicon sequence variants,ASVs)[29-30]。ASVs相当于100%的操作分类单元(OTUs)。对比Silva 16S rRNA数据库的基因序列进行分类。在进行后续分析之前,叶绿体、线粒体、古菌和真核生物被清除。最后,为了最大限度地减少测序深度不同造成的影响,以最低序列数(24 929)为标准,将得到的ASVs表中的所有样品的序列重新抽样至每个样品的序列数相等。
1.4 数据分析
Shannon指数、Simpson指数、Chao1指数和Pielou指数用R语言vegan包计算[31],沉积物细菌物种分类韦恩图用R语言VennDiagram包计算。采用Mann-Whitney U检验法评估多样性指数的组间差异。Beta多样性采用基于Bray-Curtis距离的非度量多维尺度(non-metric multidimensional scaling,NMDS)排序来分析季节和河流之间沉积物细菌群落的差异。NMDS是距离值的秩次(数据排名)信息的评估,图形上样本信息仅反映样本间数据秩次信息的远近,不反映真实的数值差异,横纵坐标并无权重意义。采用相似度分析(analysis of similarities,ANOSIM)来评估组间的分离程度,分离度R值越大,组间分离度越高(R=1表示完全分离,R=0表示完全未分离),这些分析是使用R语言中的vegan包进行的。
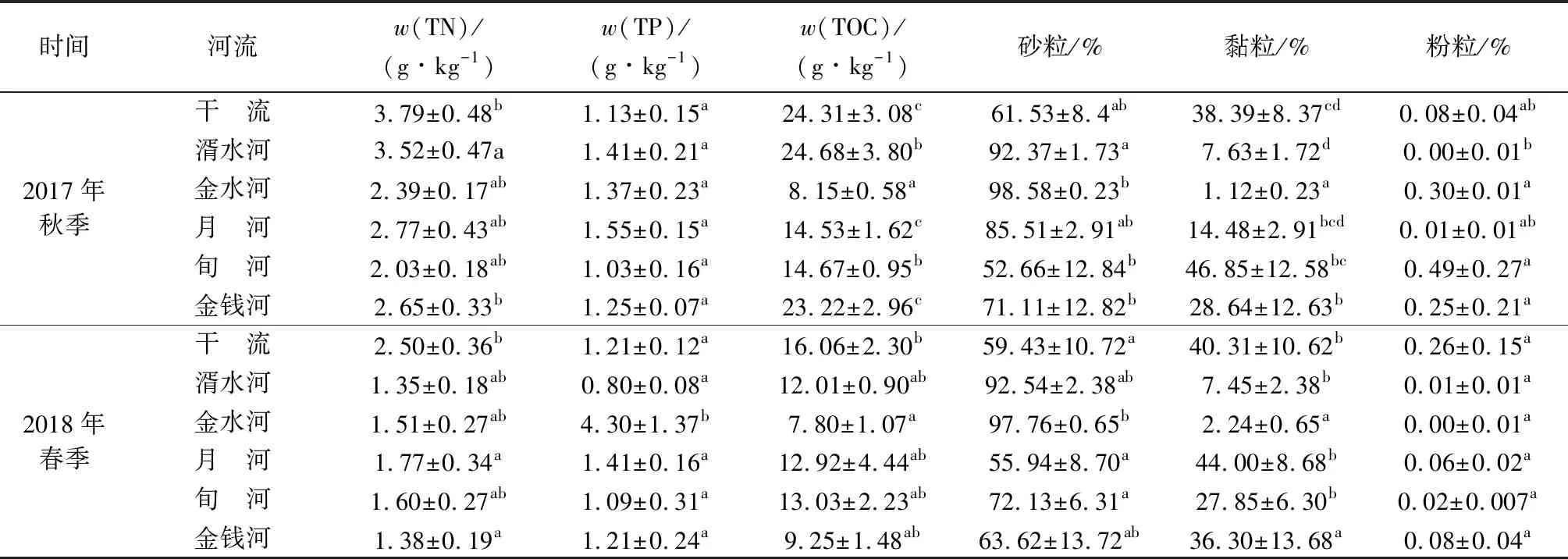
表1 汉江上游干支流沉积物理化性质Table 1 Physicochemical properties of sediment in upper reaches of the Hanjiang River and its tributaries
将除pH值以外的理化参数数值n进行对数转换为lg(n+1)正态值进行多元统计分析,使用SPSS软件对理化因子进行差异分析,采用单因素方差分析中的多重比较法进行差异显著性检验,采用Mantel检验分析计算细菌群落Bray-Curtis矩阵与环境因子的欧氏距离之间的Spearman等级相关性,以及细菌群落Bray-Curtis矩阵与地理距离之间的Spearman等级相关性。结合中性群落模型(neutral community model,NCM)研究确定性过程和随机性过程对细菌群落的贡献,使用NCM将观测到的ASVs发生频率与元群落的平均相对丰度联系起来[13]。NCM可以反映Hubbell中性理论对大微生物种群的适应性[12],其计算过程可参考文献[32]。采用参数R2表示NCM的整体拟合度,R2越高表明越接近中性模型,即群落的构建受随机性过程的影响越大,受确定性过程的影响越小。标准化随机率(NST)也被证实可以预测细菌群落组装[33],也是用来评估群落确定性(<50%)和随机性(>50%)组装的指标,以模拟群落为样本,综合考虑非生物过滤、竞争、环境噪声和空间尺度,定量分析不同生态过程的相对贡献[34],NST使用R语言中的NST包计算,当使用模拟社区进行测试时,基于Jaccard指标的NST(NSTjac)显示出比使用其他指标计算的NST更高的精度,并利用基于Bray-Curtis矩阵的NST(NSTbray)进一步验证了NSTjac[34]。
2 结果与分析
2.1 河流沉积物理化性质特征
汉江上游干支流的沉积物理化性质如表1所示。秋季TN、TOC以及沉积物砂粒、黏粒、粉粒在不同河流之间具有显著差异,但是TP的含量在不同河流之间并无显著差异;春季TN、TP、TOC以及沉积物砂粒、黏粒含量在不同河流之间具有显著差异,但是沉积物中的粉粒含量并无显著差异。无论秋季还是春季,汉江上游干流的TN含量总是高于其他支流,TOC含量也高于大部分支流。
2.2 沉积物细菌群落多样性与结构特征
对64个样本(每个样本24 929个ASVs)进行分析,由稀疏曲线(图2)可知,随着序列数量的增长,物种数趋于稳定,说明物种稀疏曲线趋向饱和,表明测序深度较为合理。由图3可以看出,48 111个不同的ASVs,支流(37 845)的ASVs数量明显多于干流(17 514),2018年春季(30 601)的ASVs数量明显多于2017年秋季(21 652)。
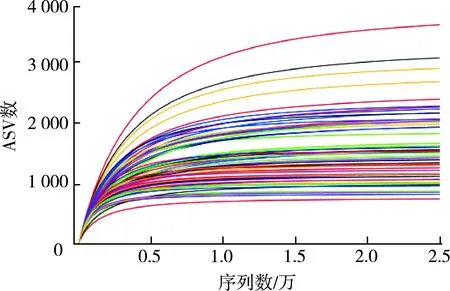
图2 细菌丰度稀疏曲线Fig.2 Rarefaction curves of abundance of bacterial species

图3 汉江上游干支流不同季节沉积物细菌分布韦恩图Fig.3 Venn diagram of bacteria distribution in sediments of upper reaches of the Hanjiang River and its tributaries in different seasons
图4为沉积物细菌门级类群相对丰度及其群落树状图(平均丰度小于0.5%归为其他)。秋季干流中丰度最高的是变形菌门(Proteobacteria)(45.50%),其次是拟杆菌门(Bacteroidetes)(12.66%)、蓝藻门(Cyanobacteria)(6.76%)、浮霉菌门(Planctomycetes)(5.34%)、酸杆菌门(Acidobacteria)(3.35%)等;支流中丰度最高的为变形菌门(42.50%),其次是蓝藻门(16.66%)、拟杆菌门(13.15%)、浮霉菌门(7.16%)、酸杆菌门(2.53%)等,蓝藻门在支流中的丰度高于干流。春季变形菌门仍然是丰度最高的菌门,且在干流中丰度最高的为变形菌门(33.31%),其次为拟杆菌门(21.69%)、蓝藻门(13.44%)、浮霉菌门(5.67%)、酸杆菌门(2.50%)等;支流中丰度变化与干流相差不大,依次为变形菌门(38.43%)、拟杆菌门(20.25%)、蓝藻门(10.07%)、浮霉菌门(8.40%)、酸杆菌门(2.04%)等。
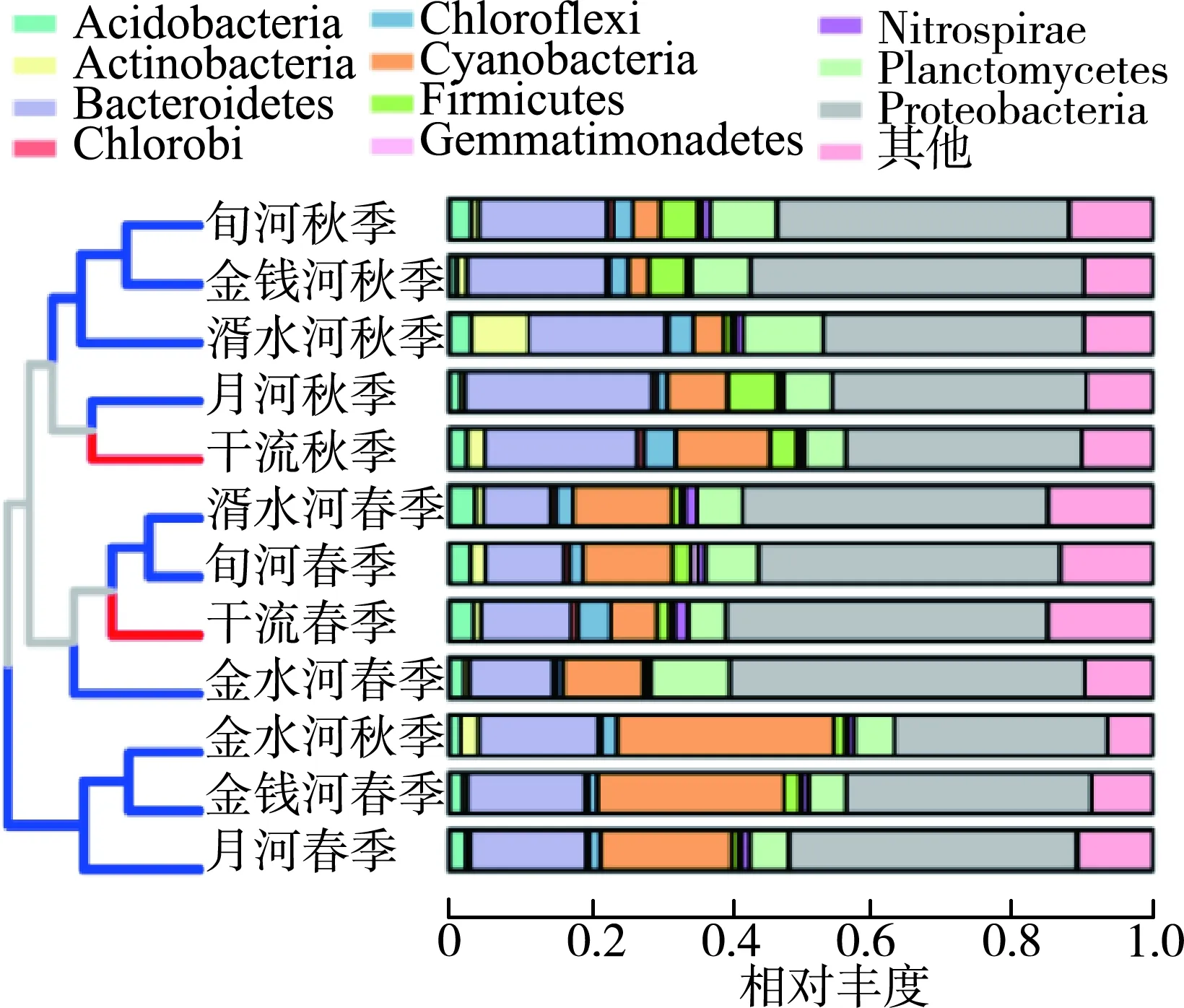
图4 汉江上游干支流沉积物细菌门级类群相对丰度及其群落树状图Fig.4 Relative abundance of Bacteriophylum taxa and their community trees in sediments of upper reaches of the Hanjiang River and its tributaries
图5显示了不同季节不同河段的Alpha指数差异,Chao1指数范围为758~3 781,Shannon指数范围为7.63~11.43。根据Mann-Whitney U检验显示,秋季和春季的Shannon指数(P=0.053)和Simpson指数(P=0.217)差异不显著,但Chao1指数(P<0.001)以及Pielou指数(P=0.005)具有显著差异。秋季Shannon指数在金钱河与金水河之间具有显著差异(P=0.022),金水河与旬河(P=0.007)以及月河(P=0.030)之间具有显著差异,其他河流之间并无显著差异;Chao1指数在旬河与金水河(P=0.027)以及湑水河(P=0.016)之间具有显著差异,其他河流之间并无显著差异;Simpson指数(P=0.125)和Pielou指数(P=0.051)在干支流之间并无显著差异。春季干支流之间的Shannon指数(P=0.226)、Simpson指数(P=0.277)、Pielou指数(P=0.206)和Chao1指数(P=0.185)并无显著差异。
NMDS分析结果表明不同季节的细菌群落出现显著分离(图6),秋季和春季的沉积物细菌群落结构在整体水平上不一致,ANOSIM统计检验结果证明了秋季和春季的细菌群落结构之间具有较高的分离度(R=0.676,P=0.001),但是在干支流之间,无论是秋季(R=0.2102,P=0.001)还是春季(R=0.234 6,P=0.001),细菌群落结构的分离度都不高。
2.3 理化因子对沉积物细菌群落的影响
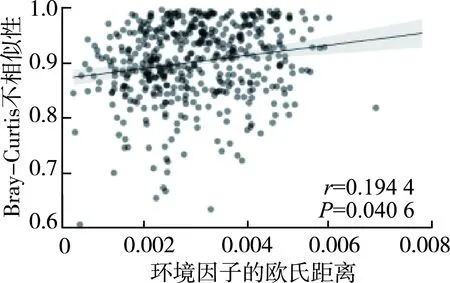
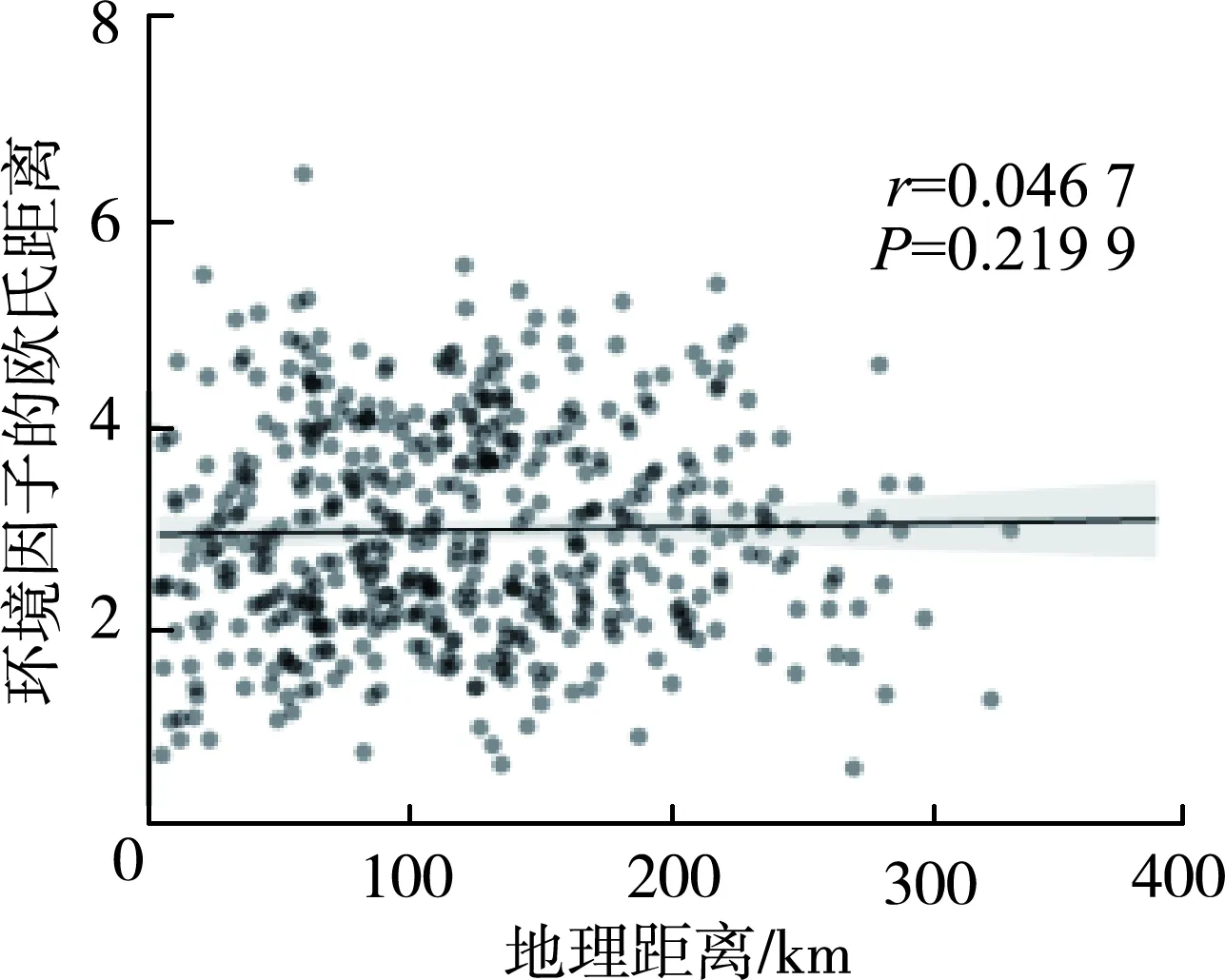
细菌群落Bray-Curtis不相似性与地理距离之间的Spearman秩相关性表明(图7):秋季地理距离与细菌群落之间有显著相关性,但春季并不具有显著相关性;环境因子的欧氏距离与沉积物细菌群落的Bray-Curtis不相似性在秋季显著相关,但是春季不相关(图8);地理距离与环境因子的欧氏距离之间的关系在季节之间并无明显差异,秋季以及春季并未显著相关(图9)。基于Spearman秩相关的细菌群落Alpha多样性与环境因子相关性分析显示,无论在秋季还是春季,没有环境因子与Shannon指数和Chao1指数有相关性(P>0.05)(图10,图中*、**、***分别表示在0.05、0.01和0.001水平(双侧)上显著相关)。

(a) Shannon指数

图6 基于Bray-Curtis相似性的不同季节细菌群落的NMDS分析Fig.6 NMDS analysis of bacterial communities in different seasons based on Bray-Curtis similarity

(a) 2017年秋季
2.4 基于NCM推断中性过程对群落构建的影响
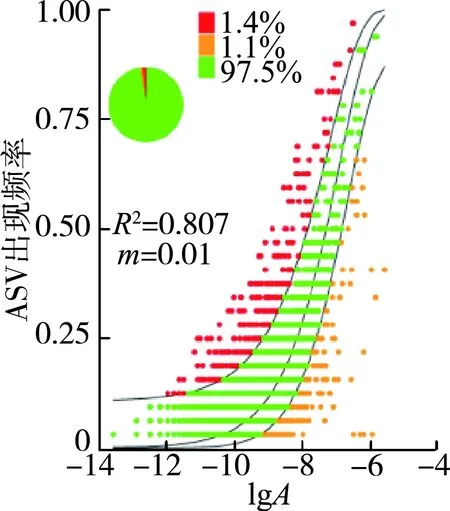
秋季和春季被NCM预测到的ASVs分别占97.5%和97.6%。另外,NCM表明随机过程在很大程度上解释了秋季(R2=0.807)和春季(R2=0.79)细菌群落的变异(图11,图中A为相对丰度,m为迁移率)。NSTjac和NSTbray也显示了秋季(NSTjac为0.74,NSTbray为0.63)和春季(NSTjac为0.58,NSTbray为0.52)细菌群落主要受随机过程(> 50%)的控制。总的来说,随机过程对沉积物细菌群落的空间分布具有显著影响。
(a) 2017年秋季
(a) 2017年秋季

(a) 2017年秋季
(a) 2017年秋季
3 讨 论
沉积物细菌门级类群相对丰度及其群落树状图(图4)表明,无论是在支流还是干流中,变形菌门是相对丰度最高的优势菌门,这与以往对河流细菌群落的研究相符[35-37]。秋季支流中蓝藻门的丰度略高于拟杆菌门,主要是因为支流河床容易收集到更多的植物由于季节更替产生的营养物质,给沉积物中的蓝藻门提供了良好的生存环境。Mann-Whitney U检验分析表明,不同季节之间Chao1指数和Pielou指数有差异显著(图5)。这与Sun等[38]先前对汉江浮游细菌的研究不同,汉江上游干流和支流的浮游细菌的Alpha多样性指数只在干支流之间有显著差异,季节之间没有显著差异。这是因为浮游细菌在水体中随水流迁移,使支流中的细菌都在干流中汇集,导致干流和支流之间Alpha多样性指数差异显著,而沉积物并不会随水流发生大范围迁移。从图4可以看出,同一季节的河流有着相似的群落结构,说明季节变化与群落结构变化有关。
NMDS分析结果表明,不同季节的沉积物细菌群落有清晰的分离模式,ANOSIM检验结果也清晰地反映出季节之间的差异性,说明不同季节群落结构有较大差异。由表1可知,不同采样时期的环境因子有明显差别,这是细菌群落季节性差异的一个因素,与Liu等[22]对长江的研究结果一致。由于内部和外部相互作用的存在,河流中细菌的季节性演替是一个每年重复的过程[21]。图6显示,干流的细菌群落与支流的细菌群落相差不大,这是沉积物的稳定性导致的,不同采样点的沉积物环境有差异,而干流的采样点相距较远,与支流采样点相比,更易受不确定性因素(如人为干扰)影响,如王佳等[39]对浑河沉积物研究发现,沉积物细菌群落结构从上游到下游具有明显的区域分布特征,呈现由单一向复杂演替的趋势。
Mantel检验分析显示,秋季地理距离与沉积物细菌群落结构差异显著,但春季时差异不显著(图7),这可能是因为进入春季后气温逐步升高,不同河流的细菌开始大量繁殖,细菌群落未受到较大的影响,各个河流的细菌群落并未出现明显的距离衰减模式,Mantel检验分析发现环境因子组合的欧氏距离与细菌群落之间只在秋季有显著相关性,说明环境因子并不能完全解释细菌群落结构的组成机制,这与以往的研究[12]有所区别,一方面可能是由于现有的环境因子不足,另一方面是因为河流沉积环境易受沿岸农业生产活动、植被、土地利用类型、水文、泥沙等多重因素的影响,部分河流干流及支流的生态状况季节性差异大[40]。而且在秋季断面调查中,支流调查断面部分受到采石挖沙等人类活动的严重干扰,对溪流生物的群落结构和功能影响严重。由图10可知,单个环境因子与细菌群落多样性之间并无显著相关性(P>0.05),因此环境选择代表的确定性过程并未对群落结构的形成产生显著影响。而图11表明,NCM对沉积物细菌群落有很大的解释度(秋季R2=0.807,春季R2=0.790),说明中性过程在群落组装的构建过程中起到了关键性作用。中性理论认为群落中所有的物种具有相同的竞争和扩散能力,因此群落的组成受随机漂移的影响,即随机过程塑造了微生物群落结构[41]。NST结果表明,随机过程在季节内沉积物细菌群落构建中发挥了重要作用,其可能易受随机过程的影响而不是受环境选择代表的确定性过程的影响,这一结果验证了NCM的结论。沉积物细菌群落的形成受随机过程主导是因为沉积物样点本身具有一定的区域异质性,沉积物环境的改变主要靠营养盐的沉降扩散过程以及重金属的吸附、富集等过程,采样点之间环境因子的变化不具有规律性,沉积物的理化性质在干支流间差异较大,因此环境因子对群落的影响较小;干流和支流生态状况较差,较强的人为干扰破坏了河流连续体细菌群落结构的生态演替,可能会削弱环境选择的影响,所以群落结构的形成更易受到漂移等不由环境决定的随机过程的影响。但与其他河流的类似研究结果[23,42-43]不一致。
对汉江上游流域的保护,不仅要考虑常规的环境因子对该流域微生态的影响,还要考虑人为干扰对环境的影响,加强河道保护,对采石挖沙等工程严格管控,维护河流连续体正常的生态演替。
4 结 论
a.汉江上游干支流沉积物细菌群落存在明显的季节变化,Alpha多样性指数表明春季细菌群落丰富度和多样性较高,不过在春秋两个季节中,变形菌门都是丰度最高的优势菌门;干流和支流之间的细菌群落结构具有显著差异。
b.根据中性理论,群落中所有的物种具有相同的竞争和扩散能力,因此群落的组成受随机漂移的影响。中性群落模型对群落构建有较高的解释度,因此在群落构建过程中,以随机漂移为主的随机过程主导了细菌群落的形成。
c.标准化随机率显示无论是基于Jaccard指标还是基于Bray-Curtis矩阵的算法,随机过程(NST大于50%)都对细菌群落的构建起着重要作用。

