针刀调节Ca2+抑制膝骨关节炎大鼠软骨细胞凋亡的实验研究❋
陈 倩,黄小双,杨永晖,耿 凯,刘存斌,李 韬,吴亮亮,林秀华,施婧婧
(1.安徽中医药大学,合肥 230038;2.安徽中医药大学第三附属医院,合肥 230061)
膝骨关节炎(knee osteoarthritis,KOA)是一种中老年人常见的慢性退行性疾病,我国KOA的发病率为5.4%~30.5%[1,2]。目前西药治疗KOA存在长期疗效较差、胃肠道损害以及肾损伤等弊端[3,4],针刀治疗KOA临床疗效良好,可以明显改善KOA疼痛和功能障碍等症状,具有安全性高、起效快、创伤小等优点[5,6]。
针刀治疗KOA的作用机制研究,目前大多围绕肌肉力学、细胞免疫反应、炎症因子、基质金属蛋白酶等方面开展[7-13]。膝关节软骨细胞的凋亡是KOA的主要发病因素之一,而细胞凋亡与Ca2+的浓度密切相关[14,15]。大量的Ca2+可以促进凋亡加速[16],加快膝关节软骨退变与损伤。在Ca2+释放过程中,钙调蛋白(Calmodulin)、钙蛋白酶(Calpain)数量会变多,而钙网蛋白(Calreticulin)数量会减少。鉴于针刀调控膝软骨细胞内Ca2+的浓度以抑制凋亡的机制研究尚不多见,本研究建立KOA大鼠模型,观察大鼠膝软骨细胞Ca2+含量、Calmodulin、Calpain、Calreticulin及Caspase家族的表达水平,旨在探讨针刀疗法是否能够通过调节膝软骨细胞内Ca2+的浓度,进而抑制膝软骨细胞凋亡,为针刀治疗KOA提供新的实验依据。本研究通过安徽中医药大学动物伦理委员会批准,批准号AHUCM-rats-2020011。
1 材料与方法
1.1 动物
选用SD清洁型雄性大鼠72只,体质量(250±20)g,购自江苏省邳州市东方养殖有限公司,实验动物许可证号SCXK(苏)2014-0005。饲养于室温(22±2)℃、湿度(55±15)%、光照与黑暗12 h、普通标准饲料、自由活动、自由饮食与摄水的环境中。
1.2 主要试剂与仪器
Trizol(Life technogie公司,货号15596026);荧光染料试剂盒(novoprotein公司,货号E096-01B);预染蛋白Marker与ECL超敏发光试剂盒(Thermo公司,货号26616、34095);β-Actin、山羊抗小鼠IgG与山羊抗兔IgG(Zsbio公司,货号TA-09、ZB-2305、ZB-2301);Caspase-3、Caspase-9(abcam公司,货号ab184787、ab202068);Caspase-12(Bioss公司,货号bs-1105R);DMEM培养基(Sigma公司,货号D5796);钙离子检测试剂盒(碧云天公司,货号S1052);胎牛血清(Gibco公司,货号04-001-1ACS);DAPI染色液、抗荧光淬灭封片液(Beyotime公司,货号C1005、P012);FITC(abcam公司,货号ab6785);荧光一抗Calmodulin、Calreticulin(abcam公司,货号ab61001、ab92516),Calpain(Bioss公司,货号bs-1099R);针刀(江西老宗医,0.35 mm×30 mm)。
Olympus CX4光学显微镜、JEM1400 透射电镜(日本电子公司);A001-1-1102流式仪(美国贝克曼库尔特有限公司);PIKOREAL 96荧光定量PCR仪(赛默飞世尔科技有限公司);OD-1000超微量分光光度计(南京五义科技有限公司)。
1.3 动物选模分组与制备
适应性饲养1周后,将动物按随机数字表法分为正常组、模型组、针刀组和药物组各18只,除正常组外,其余3组均进行KOA鼠造模。造模采用膝关节腔药物注射法[17],预先调配2%(w/v)木瓜蛋白酶和 0.03 mol/L的L-半胱氨酸混合液,充分混匀后静置30 min,4 ℃冷藏备用。每周第1、3、5天注射3%戊巴比妥钠(0.3 mg/kg)进行腹腔麻醉,按0.1 mL/kg 剂量在大鼠左膝关节腔内注射建立模型,建模时间共4周,造模成功后休息1周,待动物状态稳定后进行干预治疗。在实验过程中,对SD大鼠的精神、饮食及活动状态进行观察。4周后大鼠造模侧出现屈伸功能障碍、跳步、拖步、活动减少,lequesne MG评分≥6分则为造模成功。
1.4 干预方法
正常组常规饲养,不做任何干预;模型组造模成功后常规饲养,不做任何干预;药物组造模成功1周后患膝局部外抹双氯芬酸二已胺乳胶剂,每日2次,连续4周;针刀组造模成功1周后行针刀干预,每周治疗1次,连续4周。
针刀操作方法:在左膝关节周围股四头肌腱和内、外侧副韧带附近寻找条索或结节状物作为针刀的进针点,以手术用无菌记号笔标记,常规备皮、消毒后依次行针刀治疗,即将刀口线平行于下肢纵轴垂直于皮肤快速刺入,到达骨面后稍微上提针刀并旋转90°,使针刀与下肢纵轴垂直,快速切割条索或结节状物3~5刀,出刀后以无菌纱布压迫止血。
1.5 检测指标
1.5.1 国际骨关节炎量表评分(lequesne MG) 各组大鼠分别在造模前、造模后、干预后进行改良lequesne MG评分:局部疼痛刺激反应(0~3分),步态改变(0~3分),关节活动度(0~3分),关节肿胀(0~2分),总分范围为0~11分。
1.5.2 膝关节软骨细胞HE染色 每组随机选取2只大鼠用0.3%戊巴比妥钠(30 mg/kg)腹腔注射麻醉,在鼠板上固定,用23号手术刀片打开膝关节,切除髌骨暴露大鼠左膝关节胫骨平台和股骨下髁的软骨,快速切取股骨内、外侧髁处2 mm×2 mm大小的新鲜软骨组织,将标本投入10%甲醛溶液中固定,HE染色,光学显微镜下观察关节软骨细胞数量改变。
1.5.3 膝关节软骨电镜检测 每组随机选取2只大鼠,同上方法快速切取股骨内、外侧髁处1 mm×1 mm×1 mm的新鲜软骨组织,并固定在电镜固定液中。按照常规透射电镜样本制备流程进行漂洗、锇酸固定、脱水、包埋、超薄切片,经柠檬酸铅、醋酸铀双重染色,在JEM1400型透射电镜下观察软骨细胞结构形态并摄片。
1.5.4 流式细胞术检测Ca2+浓度 大鼠膝软骨细胞提取与培养:每组随机选取4只大鼠,无菌操作下选取大鼠膝关节软骨。提前准备好胰酶、含0.02%胶原酶II和15%FBS的DMEM高糖培养液作为消化液(37 ℃预热)。将软骨依次放到装有PBS和无血清DMEM高糖培养液的培养皿中涮洗,洗去可能残留的血污和脂肪。把软骨切割成小块,放入1.5 mL离心管中加入少量的PBS剪碎,将剪碎的软骨倒入0.25%的胰酶中消化1~2 h,离心、弃掉胰酶消化液,向含有软骨块的沉淀中直接加入胶原酶消化液过夜,沉淀加入含15%FBS的DMEM高糖培养液清洗一次,重悬之后直接接种到培养皿中等待细胞爬出。细胞汇合度达到约90%以上时用胰酶将细胞消化、传代。
流式前处理:用PBS洗涤细胞2次,按照1∶1000稀释Ca2+母液,将稀释好的Ca2+溶液重悬细胞沉淀,避光孵育后离心收集沉淀Ca2+细胞。处理完毕后进行流式检测,用Ca2+-FITC(激发波长Ex=488 nm,发射波长Em=530 nm)的绿色荧光通过FITC通道(FL1)检测。
1.5.5 实时荧光定量PCR 每组选取3只大鼠,同上方法选取大鼠左膝关节股骨内、外髁以及胫骨平台处的软骨,置于-80 ℃保存待测。采用实时荧光定量PCR检测大鼠膝关节软骨Caspase-3、Caspase-9、Caspase-12基因表达水平,取50~100 mg组织剪碎后液氮磨匀,Trizol法提取组织中总RNA,分光光度计计算RNA的纯度及浓度;逆转录试剂盒进行反转录使RNA转换成cDNA,其中总RNA质量约为1 μg进行PCR反应,反应体系为10 μL,cDNA模板1 μL、上下游引物各1 μL、2×SYBR Green mixture 5 μL、RNase Free water 2 μL;反应结束后,以2-ΔΔCT表示目的基因相对表达量。引物由Sangon Biotech公司合成(见表1)。

表1 目的基因引物序列
1.5.6 Western blot检测 每组选取3只大鼠,同上方法选取大鼠左膝关节软骨,选取组织约100 mg,加入RIPA细胞裂解液进行裂解,收集蛋白样品变性、电泳、转膜、封闭。选择合适的一抗稀释液(Caspase-3 1∶2000,Caspase-9 1∶2000,Caspase-12 1∶1000)、二抗稀释液(1∶20000)孵育,ECL发光试剂盒检测蛋白,以β-actin为内参进行校准,采用各自的蛋白条带灰度值/内参蛋白条带灰度值作为该蛋白的相对表达量,运用Image J软件进行胶片条带的分析。
1.5.7 免疫荧光组化 每组随机选取4只大鼠,同上方法选取大鼠的膝关节软骨制作切片(厚度为3 μm),干燥烘烤,二甲苯透明,梯度脱水,抗原高压修复,山羊血清封闭,一抗(Calmodulin1∶200、Calpain1∶200、Calreticulin1∶300)孵育1 h,再加入二抗(1∶400)孵育、冲洗、甩干,用抗荧光淬灭封片剂(含DAPI)封片,最后数字切片扫描仪扫描荧光切片。
1.6 统计学方法
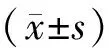
2 结果
2.1 各组大鼠lequesne MG比较
图1示,治疗前3组大鼠lequesne MG评分差异均未见统计学意义(P>0.05);与干预前比较,针刀组和药物组干预后lequesne MG评分明显降低(P<0.05);与模型组比较,针刀组和药物组干预后lequesne MG评分显著降低,差异有统计学意义(P<0.05)。
注:1)与模型组治疗后比较:P<0.05;与本组治疗前比较:2)P<0.05
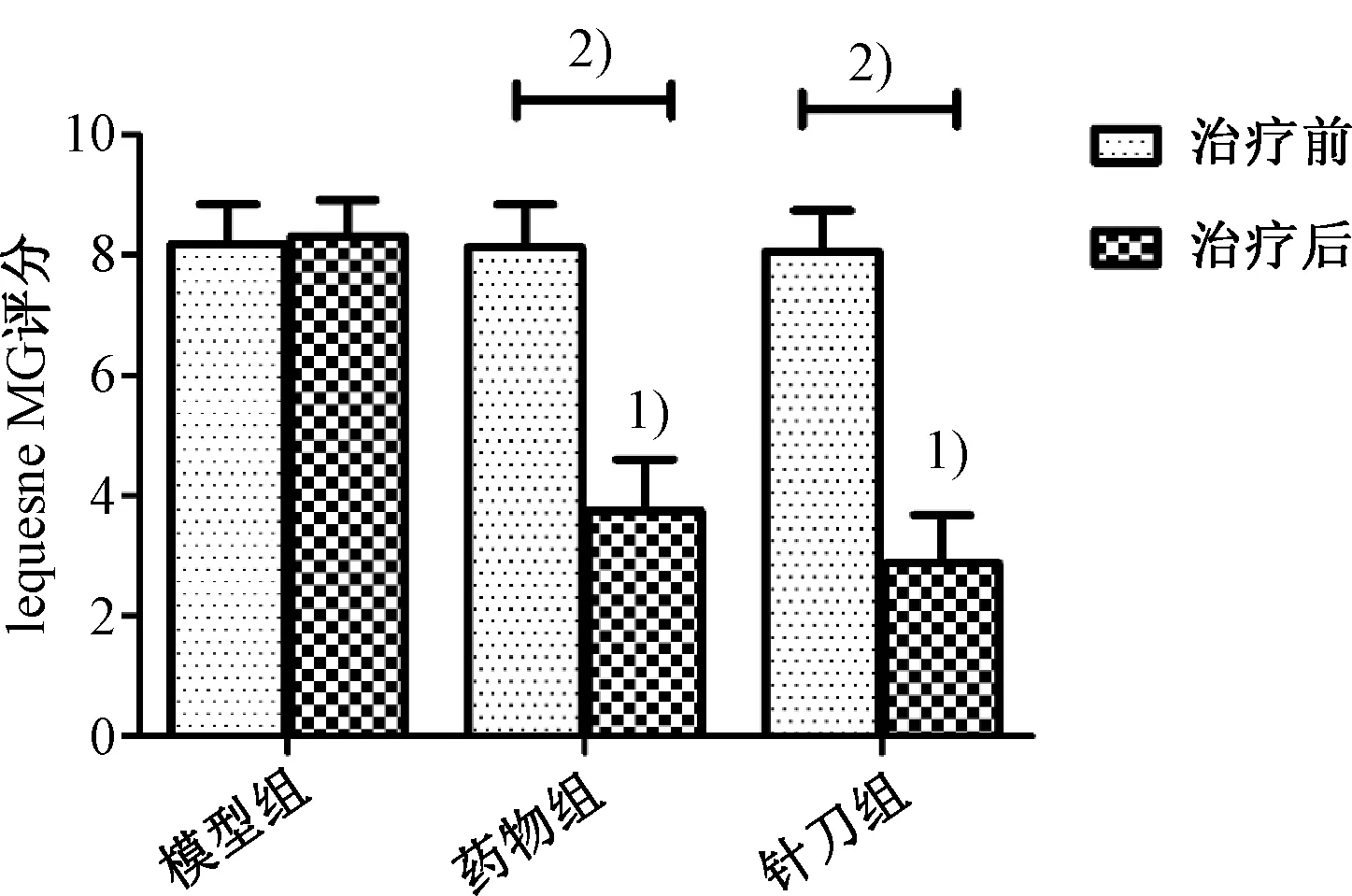
2.2 HE染色结果
图2示,正常组大鼠膝关节软骨面结构完整,软骨细胞数量较多且排列整齐。模型组与正常组比较,大鼠膝关节软骨面粗糙不平滑,软骨细胞数量明显减少且排列混乱。针刀组和药物组与模型组比较,大鼠膝关节软骨面较为完整且平滑,软骨细胞数量显著增多,排列顺序也较整齐规律。
注:A.正常组;B.模型组;C.药物组;D.针刀组;图2-B为图2-A中蓝框部分的放大图
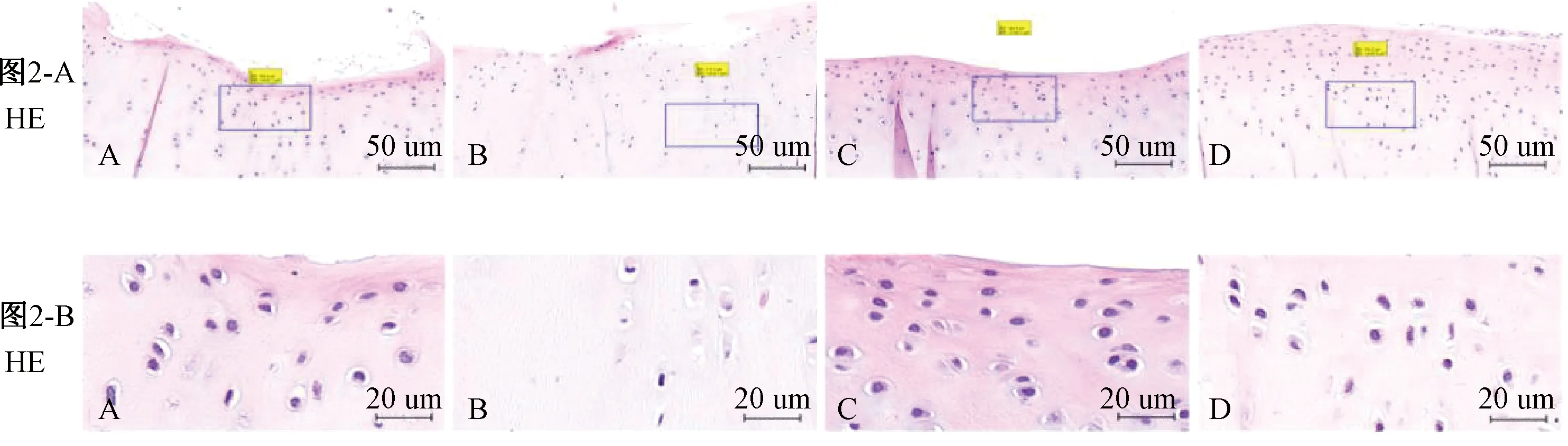
2.3 关节软骨电镜结果
图3示,正常组细胞核内染色质分布匀称,细胞核膜完整,内质网、线粒体结构正常;模型组细胞染色质分布不均匀,细胞核膜皱缩严重,出现核膜染色质边集形态,粗面内质网扩张,有空泡的形成;针刀组和药物组与模型组比较,细胞膜染色质较均匀,核膜形态较正常,无边集形态,可见少量的空泡和粗面内质网扩张形态。
注:A正常组;B模型组;C药物组;D针刀组;红色箭头指向细胞核
2.4 Ca2+检测结果
图4示,横坐标为前向角代表细胞大小。纵坐标为侧向角,代表细胞内部复杂程度。图框中红色部分为细胞离散后可作为Ca2+流式检测的部分细胞。图5示,横坐标代表Ca2+平均荧光强度,纵坐标代表细胞数量。与正常组比较,模型组流式图整体向横坐标右侧平移;与模型组比较,药物组和针刀组流式图整体向横坐标左侧平移;与药物组比较,针刀组流式图整体向横坐标左侧平移。

图4 各组大鼠膝关节软骨Ca2+流式散点图(n=4)
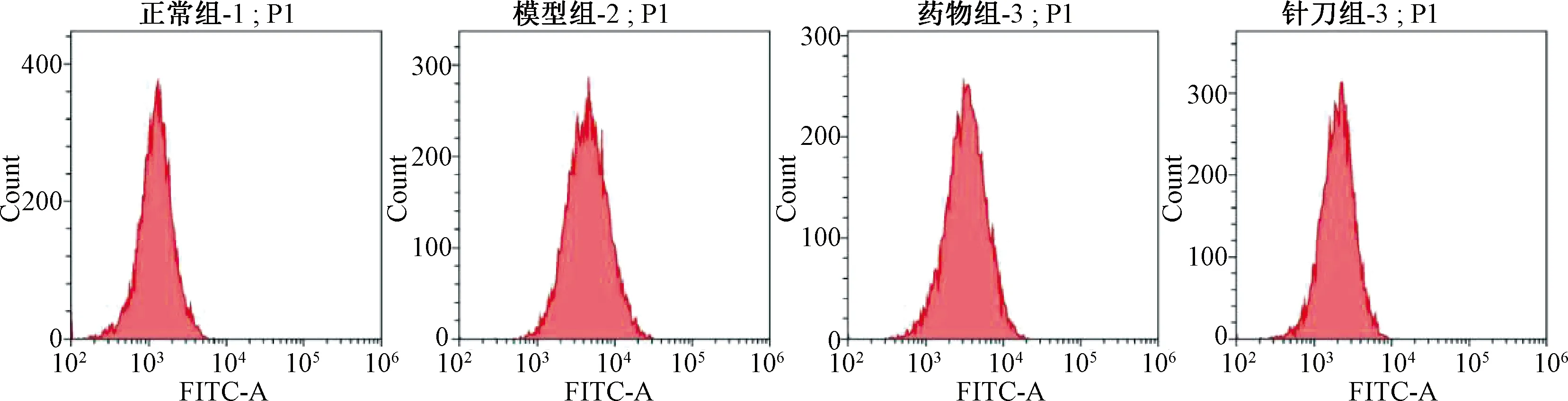
图5 各组大鼠膝关节软骨Ca2+荧光强度流式图(n=4)
图6示,Ca2+的荧光强度可反映Ca2+浓度,Ca2+的荧光强度越强则Ca2+浓度越高。与正常组比较,模型组的Ca2+平均荧光密度显著增高(P<0.05);与模型组比较,针刀组和药物组的Ca2+平均光密度明显低于模型组(P<0.05);与药物组比较,针刀组的Ca2+平均光密度低于药物组(P<0.05)。
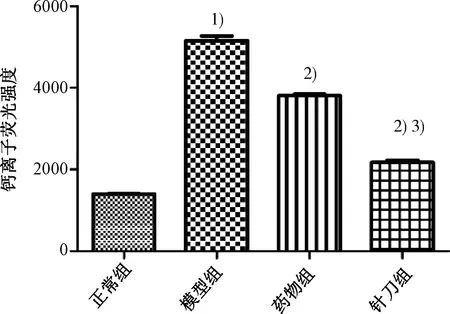
注:与正常组比较:1)P<0.05;与模型组比较:2)P<0.05;与药物组比较:3)P<0.05
2.5 各组大鼠膝关节软骨免疫荧光检测结果
DAPI是一种荧光染色剂,细胞核呈蓝色荧光。Calmodulin、Calpain、Calreticulin在细胞核内表达,呈绿色荧光,Merge为蓝色、绿色荧光表达的组合比较(见图 7~9)。
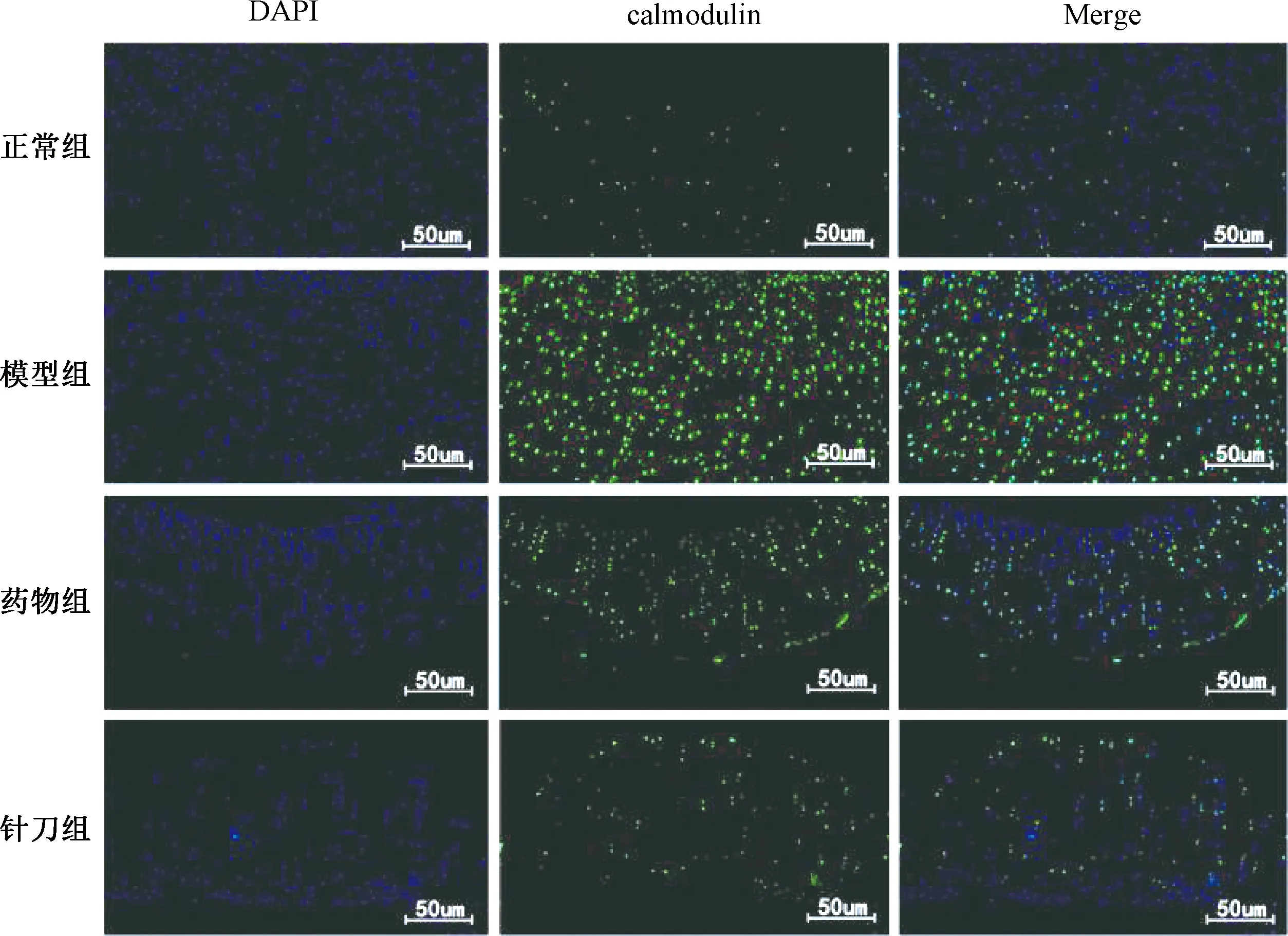
图7 各组大鼠膝关节软骨Calmodulin表达比较(n=4)
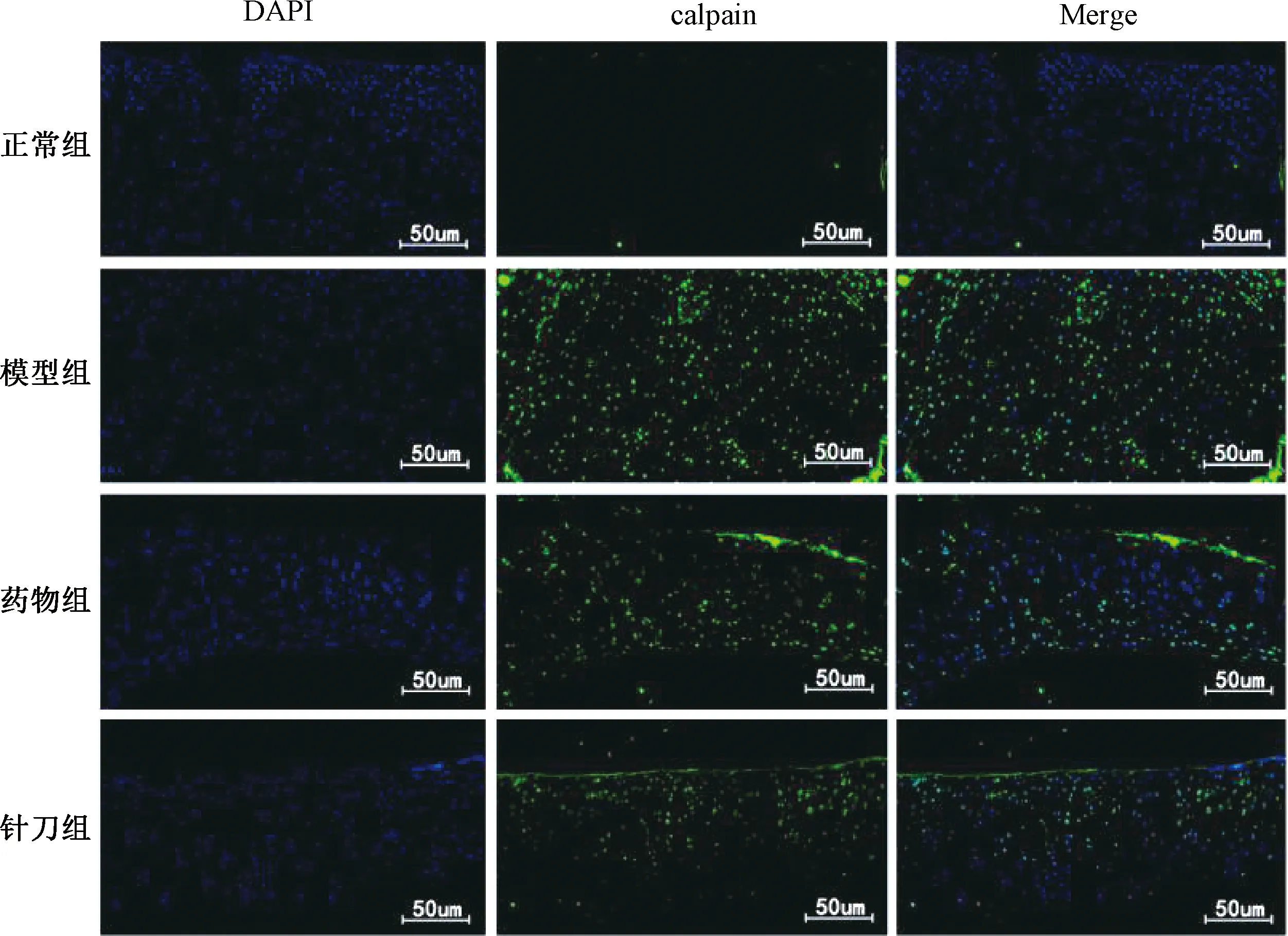
图8 各组大鼠膝关节软骨Calpain表达比较(n=4)
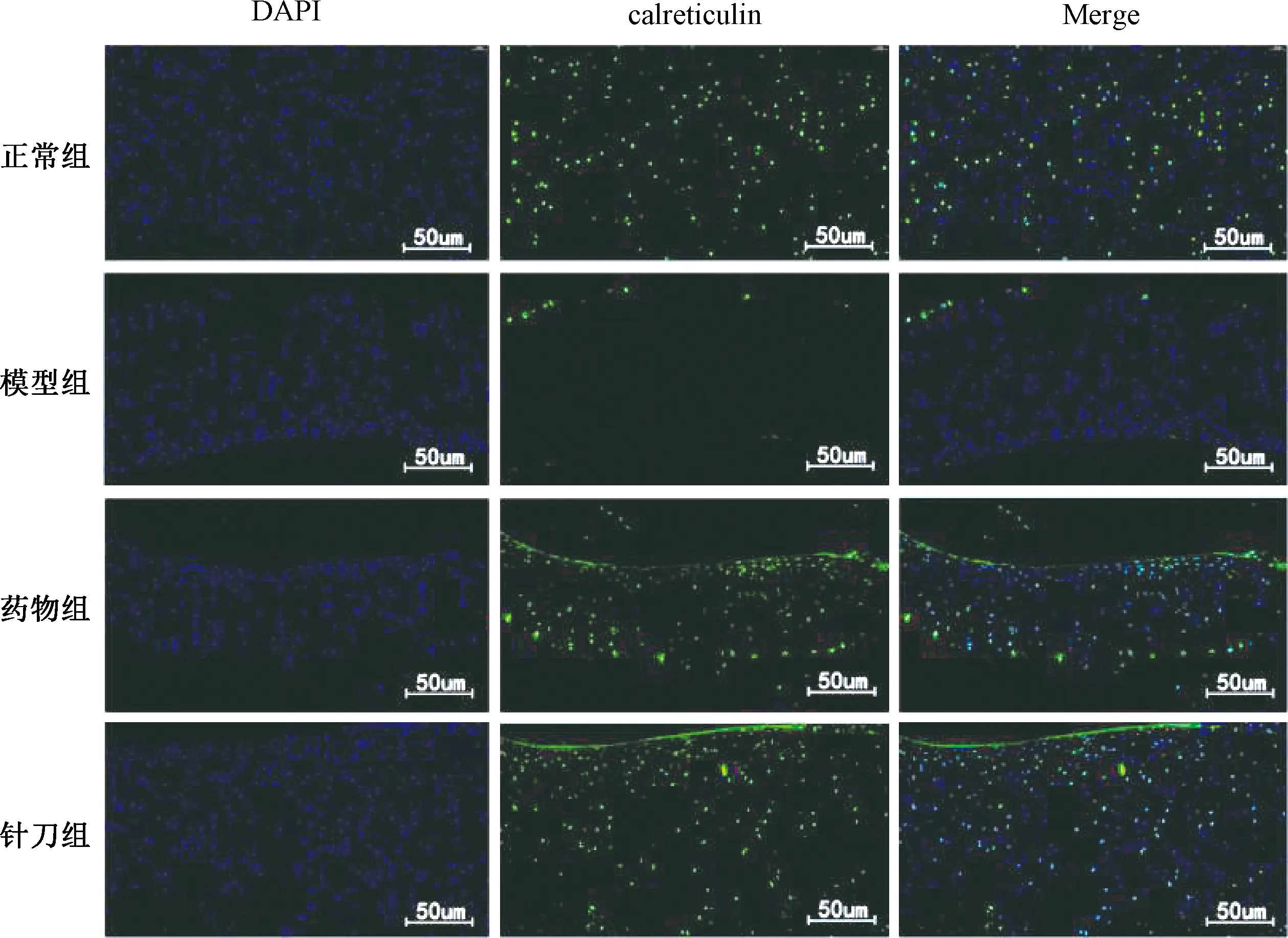
图9 各组大鼠膝关节软骨Calreticulin表达比较(n=4)
图7、8示,正常组绿色荧光分布较少,模型组绿色荧光数量明显增多;与模型组比较,针刀组和药物组绿色荧光显著减少。图9示,正常组可见较多的绿色荧光,模型组绿色荧光分布明显减少;针刀组、药物组与模型组比较,绿色荧光数量增多。
图10示,与正常组比较,模型组Calmodulin、Calpain蛋白表达明显升高(P<0.05),Calreticulin蛋白表达明显降低(P<0.05);与模型组比较,针刀组和药物组Calmodulin、Calpain蛋白表达明显降低(P<0.05),Calreticulin蛋白表达明显升高。其中,针刀组的Calmodulin、Calpain蛋白表达低于药物组(P<0.05),Calreticulin蛋白表达高于药物组(P<0.05)。
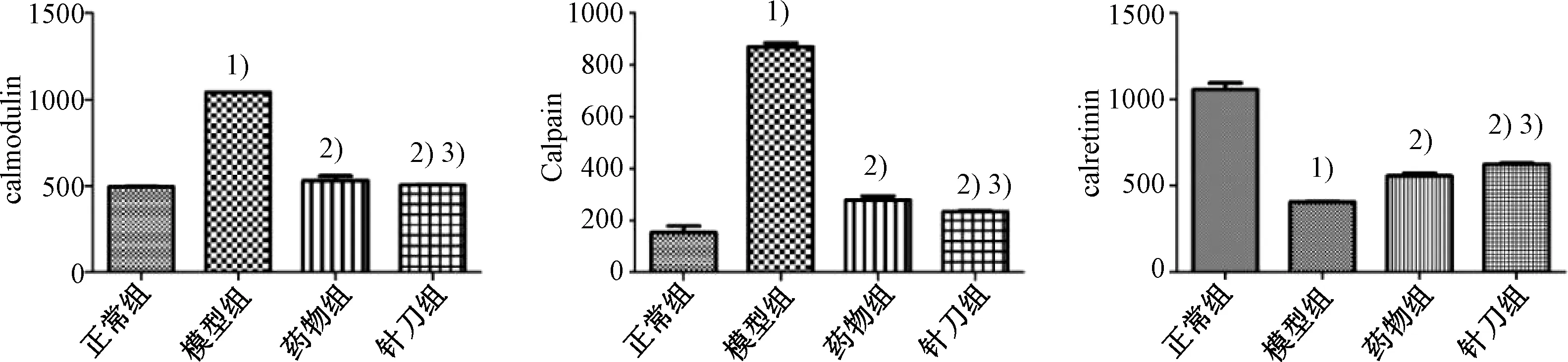
注:与正常组比较:1)P<0.05;与模型组比较:2)P<0.05;与药物组比较:3)P<0.05
2.6 实时荧光定量PCR实验结果
图11示,模型组大鼠膝关节软骨Caspase-3、Caspase-9、Caspase-12的mRNA表达水平均明显高于正常组(P<0.05);针刀组、药物组Caspase-3、Caspase-9、Caspase-12的mRNA表达水平均明显低于模型组(P<0.05),其中针刀组Caspase-3、Caspase-9、Caspase-12的mRNA表达水平明显低于药物组(P<0.05)。
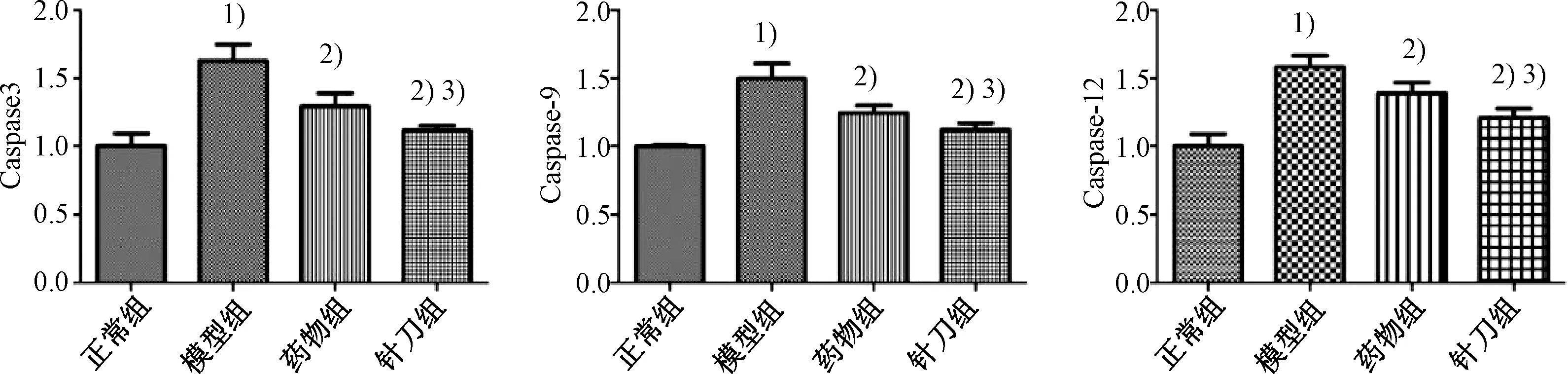
注:与正常组比较:1)P<0.05;与模型组比较:2)P<0.05;与药物组比较:3)P<0.05
2.7 Western blot检测结果
图12示,模型组大鼠膝关节软骨Caspase-3、Caspase-9、Caspase-12蛋白表达水平均明显高于正常组(P<0.05);与模型组比较,针刀组和药物组Caspase-3、Caspase-9、Caspase-12蛋白表达水平明显降低(P<0.05);与药物组比较,针刀组Caspase-3、Caspase-9、Caspase-12蛋白表达水平降低,差异有统计学意义(P<0.05)。
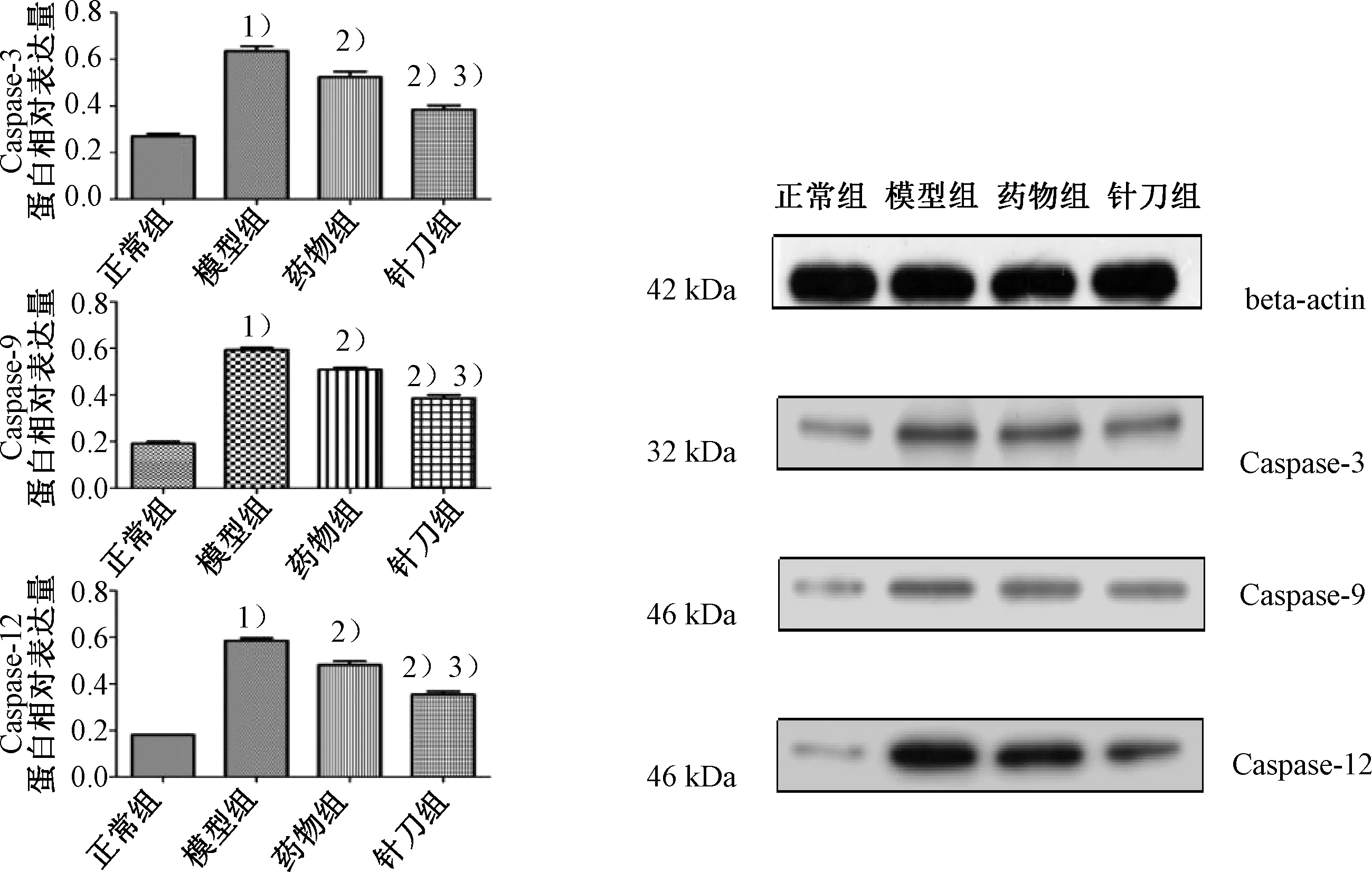
注:与正常组比较:1)P<0.05;与模型组比较:2)P<0.05;与药物组比较:3)P<0.05
3 讨论
膝骨关节炎为常见的慢性疾病,属于中医学“痹证”范畴[18]。针刀疗法是中医学治疗KOA的一大特色,通过松解肌肉的疤痕、挛缩组织,调节肌肉力学平衡,缓解疼痛并改善膝关节的活动度,可以达到治疗KOA的目的。膝软骨细胞的凋亡是KOA的重要发病机制之一[19],抑制膝关节软骨细胞凋亡可以改善软骨的退变程度治疗KOA。
膝软骨细胞的凋亡会促进软骨细胞大量减少,从而加重膝软骨的破坏,加快KOA的发生发展。本研究发现,KOA大鼠软骨面粗糙破损,软骨细胞大量减少,排列紊乱无规律,膝软骨细胞核染色分布不均匀,且细胞核膜固缩现象严重,针刀、药物干预后可见大鼠软骨面平整清晰,软骨细胞增多且排列整齐,软骨细胞核膜形态较为正常,提示针刀疗法可以抑制膝软骨细胞的凋亡,具有促进膝软骨修复、抑制膝关节退行性改变的作用。
研究表明,Ca2+是第二信使,是参与细胞凋亡的重要物质,且Ca2+的浓度越高持续的时间越长,越容易促进细胞凋亡的发生[20-22]。Calmodulin是Ca2+的传感器,在Ca2+释放过程中被激活,促使凋亡发生[23,24];Calpain是细胞内钙浓度依赖型中性半胱氨酸内肽酶,可以随Ca2+的浓度升高而升高,裂解细胞结构,加快凋亡进程[25,26];Calreticulin是一种内质网驻留蛋白,与Ca2+的稳定性密切相关[27,28],通过结合Ca2+使其浓度降低[29],减缓凋亡发生。
本实验发现,KOA大鼠膝关节软骨Ca2+浓度明显高于正常大鼠,Calmodulin、Calpain表达数量较多,Calreticulin数量较少,提示膝软骨细胞凋亡发生,KOA进展加快。经过针刀干预治疗后,Ca2+浓度显著减少,Calmodulin、Calpain表达减少,Calreticulin明显增多,表明针刀治疗调控膝软骨细胞中的Ca2+浓度,使Calmodulin、Calpain 和Calreticulin表达趋于正常水平,进而抑制膝软骨细胞凋亡。
Caspase-3、Caspase-9、Caspase-12是促进凋亡发生的重要因子。目前研究表明,Caspase-9为凋亡始动子,位于级联反应上游;Caspase-3为凋亡效应子,位于级联反应下游,被上游始动子激活后会作用于特异性底物,使得细胞发生生化及形态学的改变,从而导致细胞凋亡;Caspase-12位大鼠体内特有,在外源性细胞凋亡传导通路中起辅助作用[30,31]。本研究发现,KOA大鼠膝关节软骨组织中Caspase-3、Caspase-9、Caspase-12表达量较高,针刀干预后显著减少,结合相关分析认为针刀可以抑制Caspase-3、Caspase-9、Caspase-12的激活,从而减缓凋亡的发生,对大鼠膝关节软骨具有保护作用。
双氯芬酸二乙胺乳胶剂是一种前列腺素合成的抑制剂,具有消炎、镇痛的作用[32]。使用双氯芬酸二乙胺乳胶剂干预后,KOA大鼠膝软骨Ca2+的浓度降低,Calmodulin、Calpain表达减少,Calreticulin表达增多,表明膝关节软骨细胞的凋亡减少,但针刀疗法抑制凋亡的作用优于双氯芬酸二乙胺乳胶剂。针刀疗法以经筋理论为总纲,以网眼理论为基础[33],结合九针技术与人体解剖学,是传统针灸学的继承与发展。《素问·痿论篇》中提到经筋的生理功能“主束骨而利机关”,经筋病主要表现为经筋分布之处的筋肉挛急、掣引、痹痛、转筋、强直、弛缓等。如《灵枢·经筋》所言:“经筋之病,寒则反折筋急,热则筋弛纵不收,阴痿不用。阳急则反折,阴急则俯不伸”。KOA正属于经筋病的范畴,膝部气血不通,不通则痛,表现为膝关节局部软组织疼痛、活动受限。针刀疗法通过松解周围软组织挛缩,从而调节膝关节周边肌肉力学的平衡,疏通膝部气血,达到疏通经络、活血化瘀之功[5,34,35]。
以上研究发现,针刀可以通过调节Ca2+释放,使Calmodulin、Calpain表达减少,Calreticulin表达增多,并抑制Caspase家族的激活,减缓膝软骨细胞凋亡的发生,改善膝关节软骨退变的情况,达到治疗KOA的目的。然而,细胞的凋亡途径复杂,且多因素相互影响相互作用。本研究对于针刀调节Ca2+释放的机制进行了初步观察但仍比较浅显,还需要今后进行更深层次的探讨。

