雷公藤多苷片抑制CIA大鼠的作用
李佳怡,胡重文,许昕玥,藏佳烨,俞雨霞,朱文静,孟丹,王吉锡
(嘉兴学院 医学院,浙江嘉兴314001)
类风湿关节炎(rheumatoid arthritis,RA)是由自身免疫功能异常引起的慢性疾病,临床表现为关节慢性炎症和破坏,其高致残率严重影响了患者的生活质量.[1]近些年,有大量的研究揭示了RA潜在的致病机理,但RA炎症反应与软骨细胞中NLRP3/caspase-1的关联程度以及RA确切的病因机制尚不明确,[2-4]因此,进一步验证和揭示RA的发病机制仍为研究重点.雷公藤作为中国传统医学的常用药材,《滇南本草》中最早记载其具有“治筋骨疼痛,风寒湿痹,麻木不仁,瘫痪痿软,湿气流痰”等功效,常用于治疗关节炎,同时具有活血化瘀、清热解毒、消肿散结、杀虫止血等功效.[5]《本草纲目》曰其“功能祛风除湿,活血通络,消肿止痛,清热解毒”.因此, TGT是治疗关节炎的“中国首创植物新药”,至今尚未发现有其他中药能取代它在治疗RA方面的核心地位.[6-8]但目前TGT治疗RA的具体药效机制尚不清楚,也未见有TGT对RA细胞焦亡通路进行干预、调控及作用机制的报道.因此,本研究结合临床用药TGT,通过建立CIA大鼠模型,对CIA大鼠软骨及滑膜细胞内NLRP3、ASC、caspase-1表达变化情况进行分析,为TGT调控NLRP3/caspase-1信号通路抑制炎症治疗RA提供借鉴.
1 试验材料
1.1 药物与试剂
雷公藤多苷片(浙江得恩德制药股份有限公司,国药准字Z33020422,10 mg);牛II型胶原蛋白(上海联硕生物科技有限公司,AS31372);弗氏完全佐剂FCA(美国Sigma-Aldrich公司,F5881-10ML);兔来源一抗NLRP3,ASC,caspase-1抗体(沈阳万类生物科技有限公司);兔二步法试剂盒(北京中杉金桥生物技术有限公司,PV-6001);DAB显色液(北京中杉金桥生物技术有限公司,ZLI-9018);蛋白质免疫印迹(WB)常规试剂(上海碧云天生物科技有限公司).
1.2 仪器
Leica CM1950 冷冻切片机(德国Leica公司);IVIS Lumina XRMS III小动物活体光学及X光成像仪(美国PerkinElmer公司);正置荧光显微镜(日本Olympus公司);电泳仪及转膜仪(美国Bio-Rad公司).
1.3 动物样品
本实验采用SPF级雄性Wistar大鼠40只,周龄6~7周,体质量(200±20)g,饲养于嘉兴学院医学院实验动物中心标准化动物房(相对湿度50%~70%,温度23~25℃,昼夜各半),正常喂养,自由饮水,待适应性喂养1周后进行实验.
2 试验方法
2.1 筛选及分组
将40只Wistar大鼠适应性饲养1周后,进行等体积皮内注射和足底皮内注射混合液(牛II型胶原蛋白和FCA混合),14 d后经X线影像学检查筛选出30只大鼠,随机分为正常对照组、CIA模型组、TGT治疗组,每组10只.TGT治疗组按2倍临床剂量给药(40 mg/(kg·d),每日给药一次),对照组、CIA模型组按体重灌等量生理盐水,连续灌胃25 d.
2.2 关节炎症评分标准
分别在第5、10、15、20、25 d对灌胃的大鼠进行关节炎指数评分,并使用游标卡尺测量每只大鼠两条后肢足趾的厚度变化.采用0~4级关节评分法:0分——脚爪正常无炎症;1分——趾关节轻微发红或肿胀;2分——趾关节和足跖关节发红并肿胀;3分——踝关节以下整个脚爪全部发红并肿胀;4分——踝关节严重发红肿胀并有变形迹象.以两个脚爪评分之和作为每个大鼠的关节评分,并在小动物成像仪下拍摄大鼠的右足膝关节图像.最后,纵向解剖大鼠膝关节,观察膝关节内炎症的破坏情况.
2.3 膝关节HE染色观察
取双侧大鼠膝关节,将右侧膝关节用4%的多聚甲醛固定2 h,10% EDTA-2Na脱钙30 d,随后脱水,OCT包埋,液氮速冻,8μm切片,在HE染色显微镜下观察膝关节滑膜增生、炎性细胞浸润及关节软骨的损坏情况.
2.4 膝关节软骨及滑膜细胞NLRP3、ASC及caspase-1免疫组化检测
取冰冻膝关节切片,分别用NLRP3、ASC、caspase-1一抗体4 ℃孵育过夜,再由山羊抗兔lgG-HRP多聚体37 ℃下孵育1 h.待DAB溶液显色,在显微镜下观察软骨及滑膜细胞NLRP3、ASC、caspase-1的阳性表达情况,并用Image Pro Plus 6.0统计阳性表达的灰度值.
2.5 膝关节软骨细胞NLRP3、 ASC及caspase-1蛋白表达水平检测
采用Western blot法检测各组大鼠膝关节软骨组织中NLRP3、 ASC及caspase-1的蛋白表达水平.制备软骨组织蛋白样品,Bradford法测定蛋白浓度,制备 SDS-PAGE凝胶,上样、电泳、转膜、封闭1 h,PBST洗膜10 min×3次,加入一抗(NLRP3、caspase-1、ASC、GAPDH抗体)4 ℃孵育过夜;次日回收一抗,PBST洗膜10 min×3次,再加入HRP标记的二抗(1∶5000)室温孵育1.5 h,充分洗膜后,加入显色液显色,曝光,保存图片,以GAPDH抗体为内参,运用Image J软件进行定量分析.
2.6 数据处理
运用SPSS 16.0软件进行分析,实验数据均用均数±标准差(Mean±SD)表示,使用单因素方差分析(ANOVA)比较3组间的差异,事后检验选用LSD法,P<0.05时认为组间差异具有统计学意义.
3 结果
3.1 各组大鼠关节炎指数评分比较
3.1.1 大鼠足趾形态变化情况
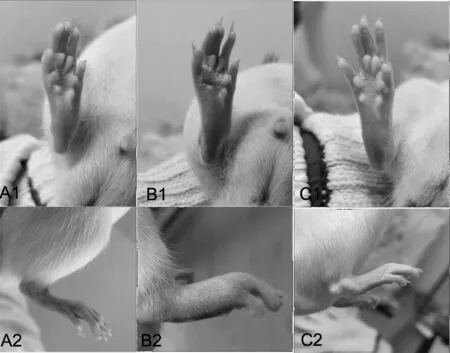
A.对照组;B.模型组;C.治疗组图1 大鼠右足底部形态变化情况
与对照组比较,模型组大鼠足部软组织肿胀程度明显,治疗组稍缓解,见图1.从足趾的厚度变化来看,第5 d开始,模型组相比对照组足趾明显增厚(**P<0.01);第10 d开始,治疗组比模型组足趾厚度明显降低(##P<0.01),见表1.

表1 大鼠足趾厚度测量值变化
3.1.2 各组大鼠关节炎指数变化情况

模型组与对照组比较, **P<0.01;治疗组与模型组比较,##P<0.01图2 各组大鼠关节炎指数变化情况
由图2可知,从第5 d开始,模型组相比对照组大鼠的关节炎指数逐渐升高,差异有统计学意义(**P<0.01),而治疗组相比模型组则逐渐降低,第20 d差异具有统计学意义(##P<0.01).
3.1.3 膝关节剖面观察
由图3可知,对照组大鼠膝关节剖面正常,关节面光滑,未见软骨破坏及滑膜增生;模型组大鼠膝关节剖面见明显滑膜增生、软骨有破坏,可见周围软组织肿胀;治疗组可见周围软组织轻度肿胀,而滑膜及软骨损伤不显著.

A.对照组;B.模型组; C.治疗组图3 大鼠膝关节剖片病理改变情况
3.2 各组间大鼠右足X-ray形态和膝关节HE染色对比
3.2.1 大鼠右足趾关节X-ray形态
由图4可知,对照组大鼠关节周围软组织正常,关节间隙正常,关节软骨完整光滑;模型组大鼠关节周围软组织梭形肿胀,关节间隙变窄,关节软骨端边缘可见轻度侵蚀破坏,邻近骨骼骨密度降低;治疗组大鼠关节周围软组织肿胀程度较轻,关节骨端边缘可见轻度侵蚀破坏.

A.对照组;B.模型组; C.治疗组图 4 大鼠右足X-ray照片
3.2.2 大鼠膝关节软骨HE染色结果
由图5可知,对照组大鼠膝关节软骨无破坏,软骨组织正常,细胞排列整齐,无增生,无充血水肿;模型组大鼠显示软骨膜变薄,软骨厚度减小,软骨细胞增生,层次增多,排列紊乱;治疗组大鼠软骨增生明显减轻,排列相对规则.

A.对照组;B.模型组; C.治疗组图 5 大鼠膝关节软骨细胞HE染色切片
3.2.3 大鼠膝关节滑膜HE染色结果
由图6可知,对照组大鼠膝关节滑膜组织正常,无纤维增生及充血水肿,淋巴细胞、单核细胞等未见明显增多、浸润;模型组大鼠显示滑膜纤维细胞增生、层次增多、排列紊乱,可见炎性细胞浸润;治疗组大鼠滑膜增生明显减轻,仅有轻度水肿,排列相对规则.

A.对照组;B.模型组; C.治疗组图 6 大鼠膝关节滑膜细胞HE染色切片
3.3 免疫组化测定结果
3.3.1 大鼠膝关节及滑膜组织NLRP3蛋白含量变化
免疫组化测定结果显示,对照组软骨组织内存在少量NLRP3阳性染色,模型组大鼠软骨组织内可见较多NLRP3强阳性染色,且灰度值升高明显(**P<0.01);而在滑膜组织中NLRP3表达差异更加显著,模型组大鼠相比对照组灰度值显著升高(**P<0.01),治疗组大鼠相比模型组灰度值显著降低(##P<0.01),见图7.

A.对照组软骨;B.模型组软骨; C.治疗组软骨; D.对照组滑膜; E.模型组滑膜; F.治疗组滑膜图 7 雷公藤多苷片对CIA大鼠膝关节软骨及滑膜NLRP3蛋白的影响
3.3.2 大鼠膝关节及滑膜组织caspase-1蛋白含量变化
免疫组化测定结果显示,对照组大鼠软骨及滑膜组织内存在少量caspase-1阳性染色(棕褐色);模型组大鼠相比对照组,其软骨组织内可见较多caspase-1强阳性染色,且灰度值升高明显(*P<0.05);治疗组大鼠相比模型组,其软骨组织caspase-1阳性表达明显减少、灰度值降低更显著(##P<0.01),而在滑膜组织中,三者的表达差异不显著,见图8.

A.对照组软骨;B.模型组软骨; C.治疗组软骨; D.对照组滑膜; E.模型组滑膜; F.治疗组滑膜图 8 雷公藤多苷片对CIA大鼠膝关节软骨及滑膜caspase-1蛋白的影响
3.3.3 大鼠膝关节及滑膜组织ASC蛋白含量变化
免疫组化测定结果显示,对照组软骨及滑膜组织内存在少量ASC阳性染色(棕褐色);模型组大鼠软骨组织内可见较多ASC强阳性染色,其灰度值相比对照组有所升高(*P<0.05),同时滑膜组织内阳性表达增加,灰度值显著升高(**P<0.01);与模型组相比,治疗组软骨细胞ASC阳性表达明显减少、灰度值降低显著(##P<0.01),滑膜细胞ASC阳性表达明显减少、灰度值降低显著(##P<0.01),见图9.
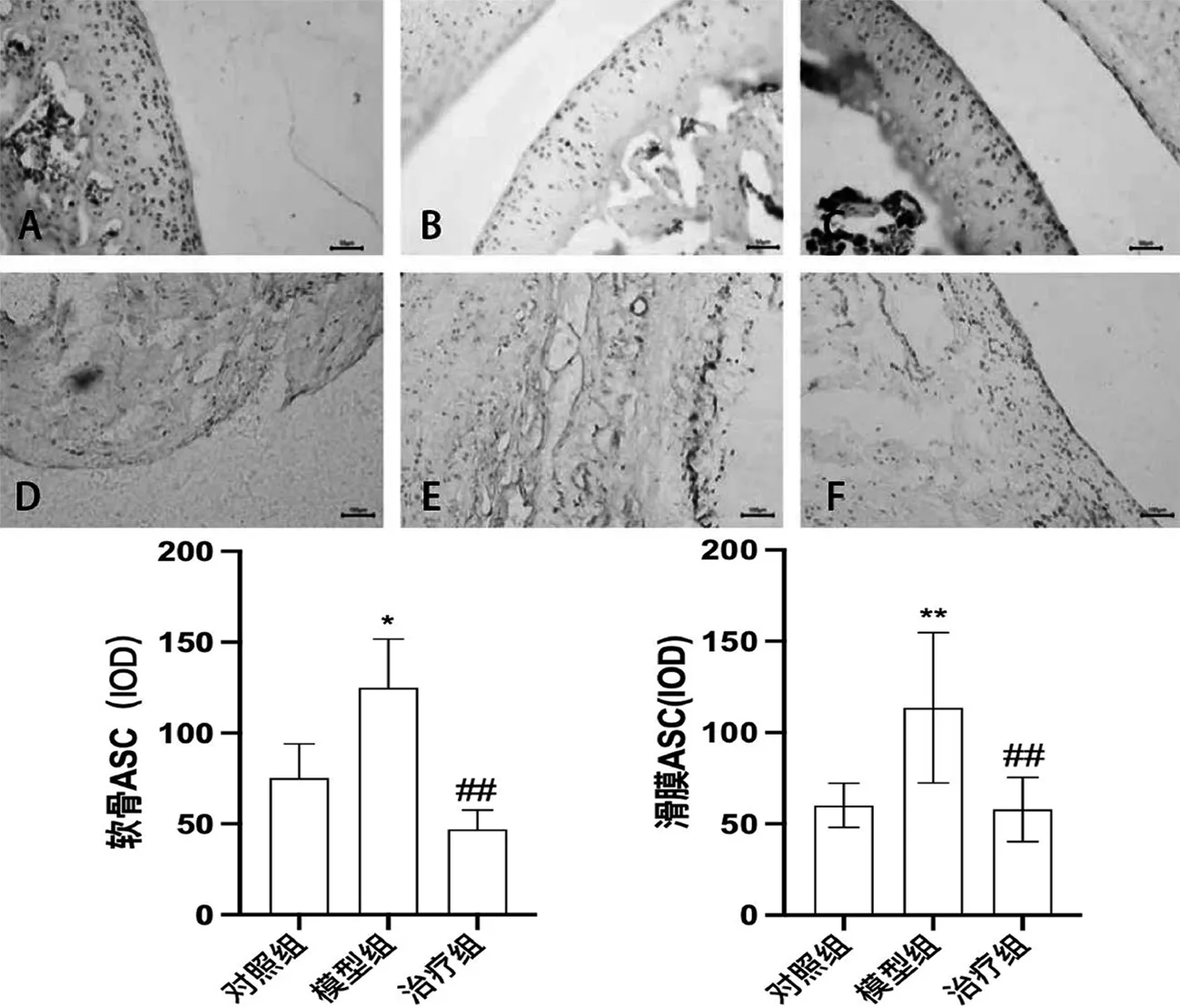
A.对照组软骨;B.模型组软骨; C.治疗组软骨; D.对照组滑膜; E.模型组滑膜; F.治疗组滑膜图9 雷公藤多苷片对CIA大鼠膝关节软骨及滑膜ASC蛋白的影响
3.4 Western blot测定结果
通过Western blot法对细胞中的NLRP3进行检测,与对照组相比,模型组NLRP3表达升高;与模型组相比,治疗组表达降低;其差异均不具有统计学意义(P>0.05),但蛋白含量表达差异符合分组变化趋势.测定结果显示,各实验组caspase-1表达无明显变化.与对照组相比,模型组ASC蛋白呈减少趋势,与模型组相比,治疗组ASC呈下降趋势,但二者均无统计学意义(P>0.05),见图10.
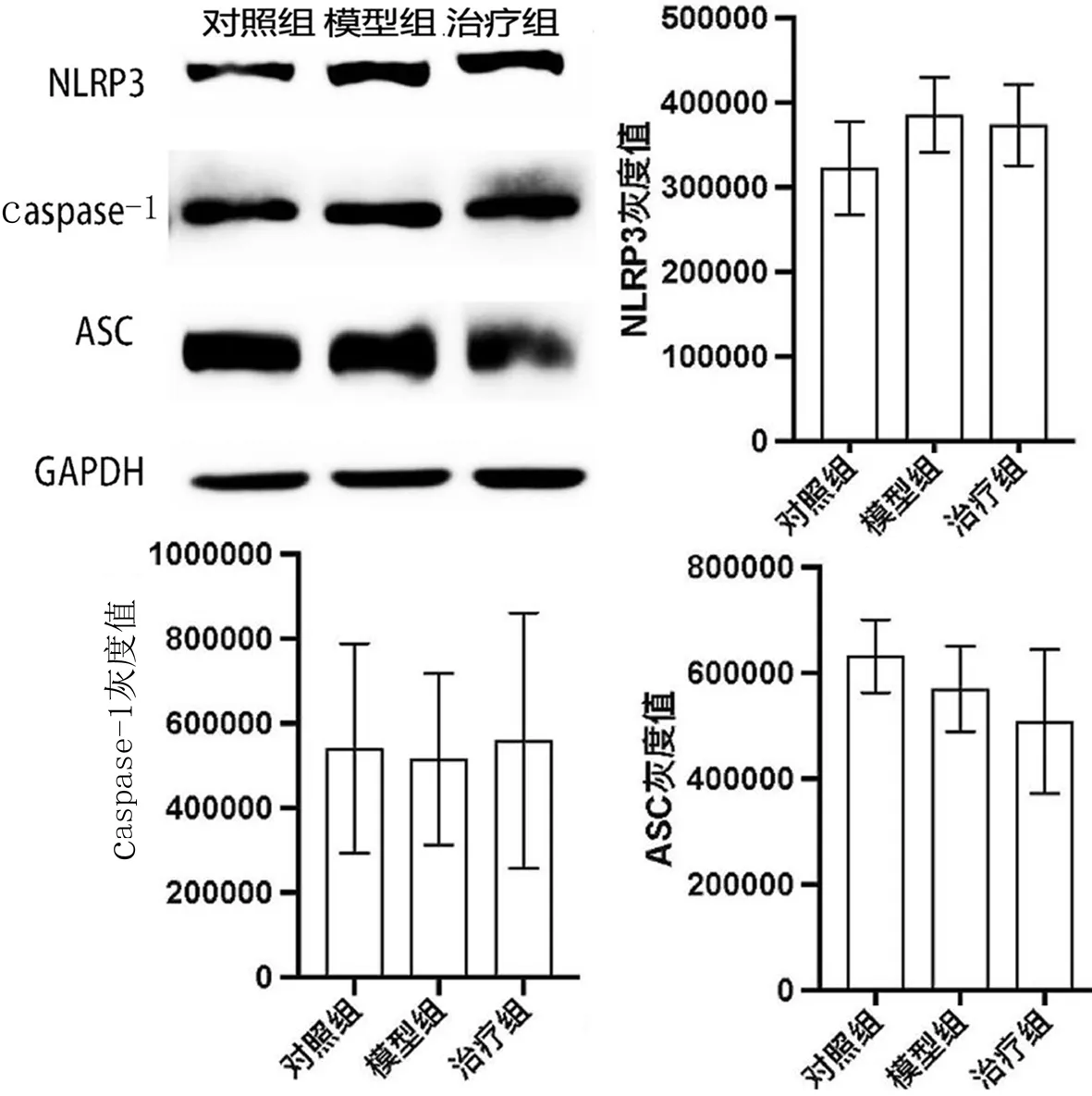
图10 雷公藤多苷片对CIA大鼠膝关节软骨及滑膜NLRP3、caspase-1、ASC蛋白含量的影响
4 结语
研究发现,RA的发病机制与细胞的焦亡存在很强的相关性,[9-10]而NLRP3/caspase-1近来被证实与细胞焦亡的发生、发展有较大的联系,该过程发生的最主要变化就是NLRP3通路中caspase-1蛋白的激活以及炎性因子的成熟释放,[11-12]本研究也证实了上述结论.另外,本文利用雷公藤清热利湿解毒的功效对大鼠足趾关节进行了观察发现,治疗组CIA大鼠足趾关节状态明显改善,膝关节软骨破坏显著减轻,这与相关临床观察一致,[13-17]也印证TGT能明显改善RA的临床症状,是临床治疗RA的有效药物.结合研究发现,通过抑制NLRP3的调控,对RA可起到保护作用.[18]因此, TGT对NLRP3炎性体轴路径相关蛋白的异常表达均有明显的调控作用,可明显下调NLRP3、ASC、caspase-1等蛋白的表达.故可以推测TGT治疗RA的机制与调控NLRP3炎性体轴及相关蛋白的表达密切相关,即TGT可以通过下调炎症因子的表达来缓解RA的进程,Western blot实验结果也进一步验证了TGT是通过调控NLRP3/caspase-1信号通路来改善RA症状.
综上所述,细胞焦亡中NLRP3/caspase-1信号通路与RA的发生具有很强的相关性,TGT可以通过调控NLRP3/caspase-1信号通路,尤其是NLRP3蛋白的表达,可抑制软骨及滑膜细胞的焦亡,从而缓解RA的发展进程.但其他通路及其下游蛋白GSDMD的反馈以及TGT剂量变化对NLRP3/caspase-1信号通路的具体影响,仍值得我们继续探索.

