微塑料-镉复合污染对绿豆种子发芽及幼苗生长的影响
郑阳,查旭琼,周凯泰,王娟,张跃进
(嘉兴学院 生物与化学工程学院,浙江嘉兴 314033)
近年来,微塑料作为新型污染物引起了全球的广泛关注.[1-11]聚乙烯(Polyethylene)简称 PE,是结构最简单的高分子有机化合物,试验表明,PE对绿豆种子的发芽率没有显著影响,甚至在某些浓度情况下还有助于芽和根的生长,但当其粒径达到0.023~0.038 mm时,对幼苗生长表现出明显的毒性效应,尤其是在高浓度时,会显著降低绿豆种子的干重、鲜重、根长和芽长.[12]重金属是典型的累积型污染物,具有不可降解性、显著生物毒性和持久性特征,其中,镉(Cd)是毒性最强的重金属污染元素之一.[13-16]
在自然环境中,不同种类的污染物之间存在着复杂的交互作用,当它们处于不同的环境条件下时,其对土壤及植物产生的生物效应不尽相同.如微塑料的存在会降低土壤对Cd2+的吸附能力,增加土壤中Cd2+的解吸量,进而导致Cd2+的生物有效性增加,对环境造成潜在的威胁.另外,微塑料与镉的复合污染对于小麦种子的芽的影响大于对根的影响,其复合效应对小麦种子发芽、根长和芽长的影响总体上表现为促进作用,在一定程度上缓解了单一污染物的毒害作用.[17-18]
本文在前期研究的基础上,重点研究不同浓度的微塑料与镉溶液复合污染对绿豆种子发芽及幼苗生长的影响,为减少微塑料和重金属的复合效应对农作物种子生长特性的影响提供参考.
1 材料与方法
1.1 供试材料与仪器
供试土壤购于春念园艺旗舰店.供试绿豆(早绿珍珠二号)购于河北庆沣种业,微塑料材质为过30、50、100、300目筛的聚乙烯(PE)颗粒,购于中联塑化科技有限公司.
分光光度计(型号:UV-5100B,购于上海元析仪器有限公司);移液枪(型号:100-1000 μL,购于力晨科技有限公司);生化培养箱(型号:SPX-50B,购于迎工仪器设备有限公司).
另有浓度分别为0.02 mg/L、0.5 mg/L的磷酸缓冲液,乙二胺四乙酸二钠、愈创木酚、氯化镉、甲硫氨酸、核黄素、氮蓝四唑均为分析纯.
1.2 实验方法
将消毒后的绿豆种子置于培养皿中,用去离子水冲洗3~5遍,直至无过氧化氢残留,再用去离子水将滤纸充分浸润,将绿豆种子表面水分吸干,整齐摆放在铺有两层润湿滤纸的培养皿中,在生化培养箱中25 ℃温度下暗催芽12 h.
选取健康饱满的绿豆种子进行土培,取每份土壤200 g于花盆中,土壤中加入配制好的微塑料-镉混合悬浮液,以每千克土壤中微塑料或镉的质量为浓度单位,悬浮液的配制方案为:低浓度微塑料悬浮液(100 mg/kg)+不同浓度镉溶液(2、5、10和50 mg/kg),组号记为A1、A2、A3、A4;中等浓度微塑料悬浮液(300、500和1000 mg/kg)+低浓度镉溶液(2 mg/kg),组号记为B1、C1、D1;中等浓度微塑料悬浮液+高浓度镉溶液(50 mg/kg),组号记为B2、C2、D2;高浓度微塑料悬浮液(1500 mg/kg)+不同浓度镉溶液(2、5、10和50 mg/kg),组号记为E1、E2、E3、E4;空白对照记为CK.所有处理设置成三个平行组进行.
将等份的绿豆播种于配制好的土壤中,置于生化培养箱,在温度25 ℃条件下培养7天,每天定时记录绿豆种子发芽数.
1.3 测量方法
以幼芽达到种子长度的一半、根长与种子等长作为发芽标准,以绿豆播种时记为第1天,第7天将绿豆幼苗置于103 ℃烘箱中烘干24 h至恒重,分别对其称重和测量株高,并参照文献[19-21] 计算绿豆的发芽率、发芽势、发芽指数和抑制率:
发芽率(GR)=(第7天全部正常发芽数/供试种子数)×100%
(1)
发芽势(GV)=(第3天正常发芽数/供试种子数)×100%
(2)
发芽指数(GI)=∑Gt/Dt
(3)
式(3)中:Gt为t天内的发芽数;Dt为对应的发芽天数.
抑制率=(对照值-处理值)/对照值×100%
(4)
再采用文献[22-24]的方法,分别测定绿豆的超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性及过氧化氢酶(CAT)的活性.
最后,利用Excel2016进行数据处理,用Origin8.5作图分析.
2 结果与讨论
2.1 微塑料-镉复合污染对绿豆种子发芽的影响
从表1可知,在微塑料与镉的交互作用下,“低中浓度微塑料-低浓度镉”复合处理对绿豆种子发芽没有明显影响,而“低浓度微塑料-高浓度镉”与“高浓度微塑料-低浓度镉”复合处理对绿豆种子发芽有明显的抑制作用,抑制率最高分别达到40.00%、26.7%,在整个微塑料与镉的复合污染处理中,绿豆的发芽率为60%~100%.而随着微塑料浓度的增加,绿豆发芽的抑制率有所下降.在高浓度(1500 mg/kg)的微塑料处理中,绿豆的发芽率为73%~93%.经过分析发现,微塑料不仅在水环境中可以富集金属离子,在土壤环境中也有类似的作用,而且会增强污染物对生物体的毒性效应.[25]具体表现为微塑料与污染物联合作用于生物体时,会通过增加摄入浓度、加剧组织损伤和降低机体抗性等方式,增强污染物对生物体的毒性效应,从而抑制了绿豆种子的发芽率.[25]

表1 微塑料-镉复合污染对绿豆种子发芽的影响
而文献[18]中的实验表明,高浓度微塑料(>500 mg/kg)与镉复合污染处理中,二者表现为拮抗作用,证明高浓度的微塑料在一定程度上可以减轻镉对小麦的毒性.同时,微塑料对土壤镉生物有效性的影响在镉污染的情况下具有部分减轻作用,即微塑料也可通过降低污染物接触浓度、污染物或共污染物的生物可利用性,减缓污染物对生物体的毒性效应.[25-26]结合以上研究与本文结果,可推断出高浓度微塑料在一定情况下可减少植物对于土壤中镉的吸收,并在一定程度上缓解镉对于绿豆种子的毒性效应.
2.2 微塑料-镉复合污染对绿豆幼苗株高的影响
图1是绿豆幼苗株高随微塑料-镉复合浓度变化的情况.
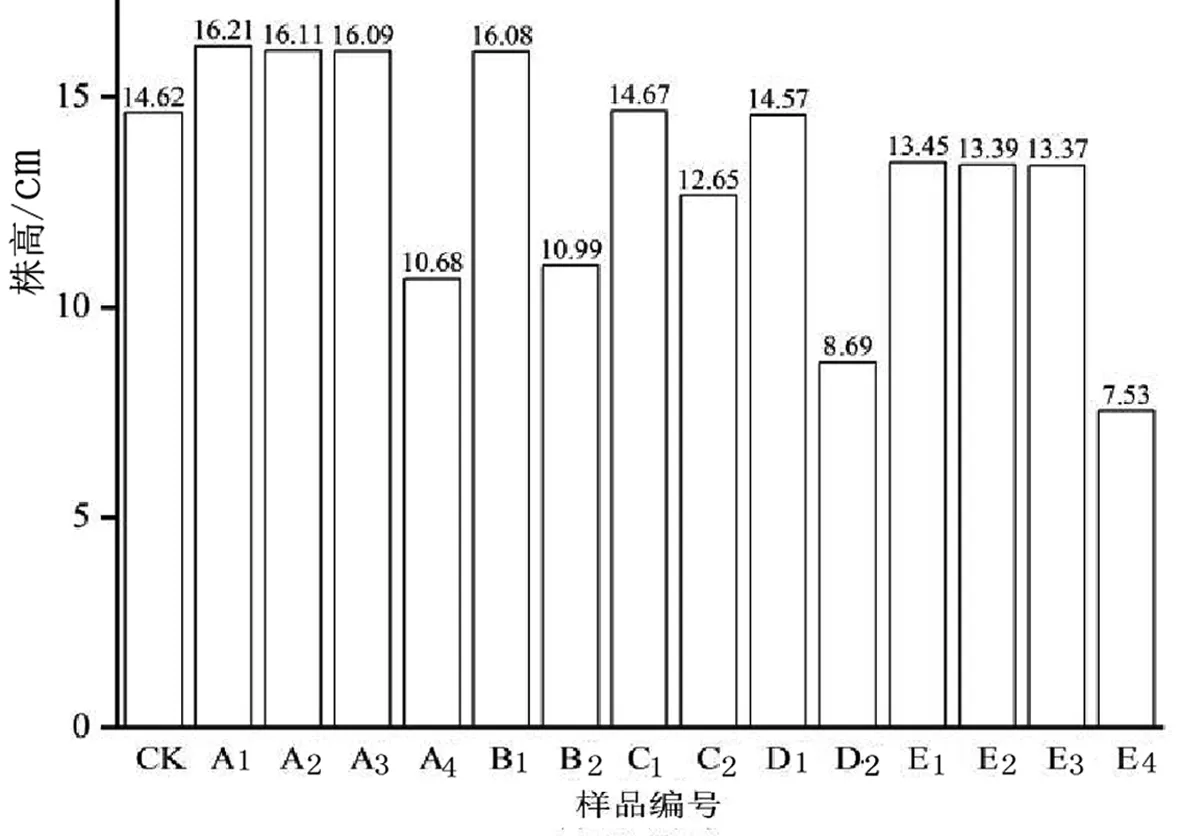
图1 绿豆幼苗株高测定
由图1可知,“低浓度微塑料-低中浓度镉”复合处理与“高浓度微塑料-高浓度镉”复合处理均呈现出明显的协同作用,且前者为协同促进作用,后者为协同抑制作用.A1、A2、A3处理的株高增长率分别达到了10.89%、10.20%和10.08%,E4处理的株高抑制率高达48.46%.原因是“低浓度微塑料-低中浓度镉”之间的吸附作用导致毒性减小,而“高浓度微塑料-高浓度镉”之间的吸附作用导致毒性更强的微塑料团聚并包裹在植物根系周围.[27-28]
2.3 微塑料-镉复合污染对绿豆幼苗酶活性的影响
由图2可知,在对SOD活性的联合作用中,“低中浓度微塑料-镉”复合处理表现为中和效应.

图2 绿豆幼苗各项酶活性指标测定
研究表明,这与微塑料在土壤中的形貌变化有关.[26]进入土壤的微塑料经紫外线照射后,与土壤组分的相互作用,使其存在结构形貌发生改变,即可以与土壤有机质结合,形成更大的聚合态,增大对镉的吸附或固定能力,导致镉的生物有效性降低,从而出现中和效应.[25]其中,与高浓度镉的复合处理表现为显著抑制作用,抑制率分别为33.20%、20.56%与11.53%,表明低中浓度微塑料对镉的吸附作用不足以阻止镉毒害SOD的效应.而“高浓度微塑料-镉”复合处理则表现为协同与拮抗作用交替出现,显然,对于高浓度镉的复合处理均为协同抑制作用,抑制率分别为47.64%和62.09%,表明高浓度镉与高浓度微塑料复合表现为更强的毒性,说明两者的毒害机制都起作用.
微塑料-镉复合处理对绿豆幼苗POD活性的联合作用均为拮抗作用.值得注意的是,它们的拮抗作用均能减小微塑料的毒性效应,并且绝大部分都对绿豆发芽有促进作用,促进效率最高可达75.07%.
微塑料-镉复合处理对绿豆幼苗的CAT活性联合作用随浓度增加,表现为协同与拮抗作用交替出现.对于“低浓度微塑料-低高浓度镉”复合处理均为协同促进作用,而“微塑料-高浓度镉”“中高浓度微塑料-镉”复合处理均为拮抗抑制作用,即减弱一方的抑制效应.而“高浓度微塑料-低中浓度镉”存在协同抑制作用.协同抑制作用率最高可达97.83%,协同促进效率最高可达23.90%.表明,微塑料-镉复合效应对于绿豆幼苗的CAT活性影响复杂,但最高浓度的微塑料-镉复合胁迫抑制作用仍十分显著,毒性效应强.
3 结语
在农作物的生长过程中,土壤环境中的微塑料与重金属的复合效应对其生长特性具有一定的影响.
3.1 微塑料与镉复合污染对绿豆种子发芽基本呈现抑制作用
低浓度微塑料(100 mg/kg)与高浓度镉(50 mg/kg)的抑制效应最强,抑制率达40%.而高浓度的微塑料(1500 mg/kg)由于表现出极强的富集金属离子的能力,与高浓度的镉复合呈现出拮抗作用,减弱了镉的生物毒性,使绿豆种子的发芽势、发芽指数以及发芽率分别增长46%、2.43%和33%.
3.2 微塑料与镉复合处理对绿豆幼苗的生长总体呈现“低促高抑”的规律
“低浓度微塑料-低中浓度镉”复合处理与“高浓度微塑料-高浓度镉”复合处理均呈现出明显的协同促进以及协同抑制作用.协同促进作用可使株高的增长率达到10.89%,抑制率可达48.46%.其中,微塑料阻碍植株水分的吸收可能是其中一个毒害机制,这与微塑料在土壤中的形态变化以及迁移行为有关.
3.3 微塑料-镉复合污染表现出的联合作用与两者的浓度关系以及吸附机制有关
随着两者之间浓度的变化,其不同的联合作用影响绿豆幼苗的氧化酶活性.而“高浓度微塑料-高浓度镉”复合处理常呈现协同抑制作用或拮抗抑制作用.对SOD酶和CAT酶的活性抑制率可达62.09%和97.83%,而对POD酶活性则为促进作用,促进效率可达75.07%.

