缺血性脑卒中患者细胞色素P450 2C19和腺苷三磷酸结合盒转运体B1基因多态性与发生氯吡格雷抵抗的相关性研究
李孟超,王大明
(常州市第一人民医院急诊医学科,江苏常州 213000)
氯吡格雷为缺血性脑卒中抗血栓形成的主要药物之一,临床应用广泛且疗效确切,但氯吡格雷为前体药物,需在体内代谢为活性药物后发挥抗血栓效果。因此,氯吡格雷治疗后的临床疗效存在明显的个体差异,部分患者服用后无抗血小板作用,会增加缺血性事件的发生率,目前其发生机制尚未完全明确。研究显示,遗传因素为发生氯吡格雷缺血性事件的重要影响因素,细胞色素P450(CYP)2C19为CYP450酶系统基因位点、腺苷三磷酸结合盒转运体B1(ABCB1)为参与氯吡格雷吸收的基因位点,两者均可能对氯吡格雷抗血小板效果产生影响[1-2]。基于此,本研究旨在分析缺血性脑卒中患者CYP2C19和ABCB1基因多态性与发生氯吡格雷抵抗的相关性,现报道如下。
1 资料与方法
1.1 一般资料 选取2020年1月至2021年12月常州市第一人民医院收治的50例氯吡格雷抵抗缺血性脑卒中患者作为观察组,另择同期50例非氯吡格雷抵抗缺血性脑卒中患者50例作为对照组。判定标准:分别抽取用药前、用药4 h后研究对象静脉血2 mL,以应用氯吡格雷后血小板抑制率<30%为氯吡格雷反应不全[3]。本研究经常州市第一人民医院医学伦理委员会批准。纳入标准:①符合《中国急性缺血性脑卒中诊治指南2018》[4]中缺血性脑卒中诊断标准者;②首次发生缺血性脑卒中者;③发病时间<24 h,年龄<60岁者;④经医疗救治后患者生命体征平稳者;⑤临床资料完整者。排除标准:①合并其他神经系统病变者;②合并凝血功能障碍者。
1.2 研究方法
1.2.1 一般资料 通过电子病历系统收集研究对象入院时一般资料,包括性别、年龄、体质量指数(BMI)、血清三酰甘油(TG)、胆固醇(TC)、收缩压(SPB)、舒张压(DBP)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平、吸烟史(一生中连续或累积吸烟6个月)、饮酒史(男性或女性饮酒>10 g/次,饮酒≥2次/周,时间≥1年)等情况。入院时采集患者静脉血3 mL对血液标本进行离心处理,离心半径为13.5 cm,离心转速为3 000 r/min,离心时间为10 min,分离得到血清后,通过全自动生化分析仪(长春瑞迪医疗科技股份有限公司,型号:CS-1200)检测血清TG、TC、HDL-C、LDL-C水平
1.2.2 CYP2C19和ABCB1基因多态性检测 抽取研究对象静脉血2 mL,抗凝后放置于-20 ℃冰箱待测,取200 μL血液标本,严格按照全血脱氧核糖核酸(DNA)提取试剂盒标注方法完成基因组DNA的提取;将提取出的DNA稀释为浓度50 ng/μL的DNA模板溶液,再次置于-20 ℃冰箱待测。采用聚合酶链式反应(PCR)的方法对ABCB1和CYP2C19基因片段进行扩增,总反应体积为20 μL。ABCB1突变位点为C3435T,上游引物(5’~3’)序列为TGTTTTCAGCTGCTTGATGG,下游引物(3’~5’)序列为AAGGCATGTATGTTGGCCTC;CYP2C19突变位点包括两个:*2处,上游引物(5’~3’)序列为CCAGAGCTTGGCATATTGTATCTA,下游引物(3’~5’)序列为CGCAAGCAGTCACATAACTAAGC;*3处,上游引物(5’~3’)序列为TCCCTGCAATGTGATCTGCT,下游引物(3’~5’)序列为TGGCTGTCTAGGCAAGACTGTAGT。反应条件为先94 ℃预变性5 min,再进行35个如下循环:94 ℃变性0.5 min,60 ℃复性0.5 min,72 ℃延伸1 min;在72 ℃条件下延伸10 min,扩增后在4 ℃条件下保存。采用实时定量焦磷酸序列分析仪(德国QIAGEN公司,型号:PyroMark Q96ID)进行焦磷酸测序,最终获得基因多态性分型结果。
1.3 观察指标 ①一般资料。比较两组患者研究对象入院时一般资料,包括性别、年龄、BMI、SPB、DBP,血清TG、TC、HDL-C、LDL-C水平,吸烟史、饮酒史。②CYP2C19和ABCB1基因型的分布。CYP2C19包括野生型(CYP2C19*1/*1)、突变型(CYP2C19*1/*2或*3突变型杂合子和CYP2C19*2/*2或*3突变型纯合子)。ABCB1基因存在CC型、CT型和TT型。③分析不同基因型患者氯吡格雷抵抗情况。④基因多态性与治疗后情况的相关性。分析不同基因型患者治疗后缺血事件、出血事件、治疗后3个月Rankin评分<2分(得分0~5分,得分越高患者预后越差)情况。
1.4 统计学分析 使用SPSS 21.0统计学软件进行数据分析。计量资料以(±s)表示,采用t检验;计数资料以[例(%)]表示,采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者一般资料比较 两组患者一般资料比较,差异均无统计学意义(均P>0.05),具有可比性,见表1。
表1 两组患者一般资料比较[例(%)/(±s )]
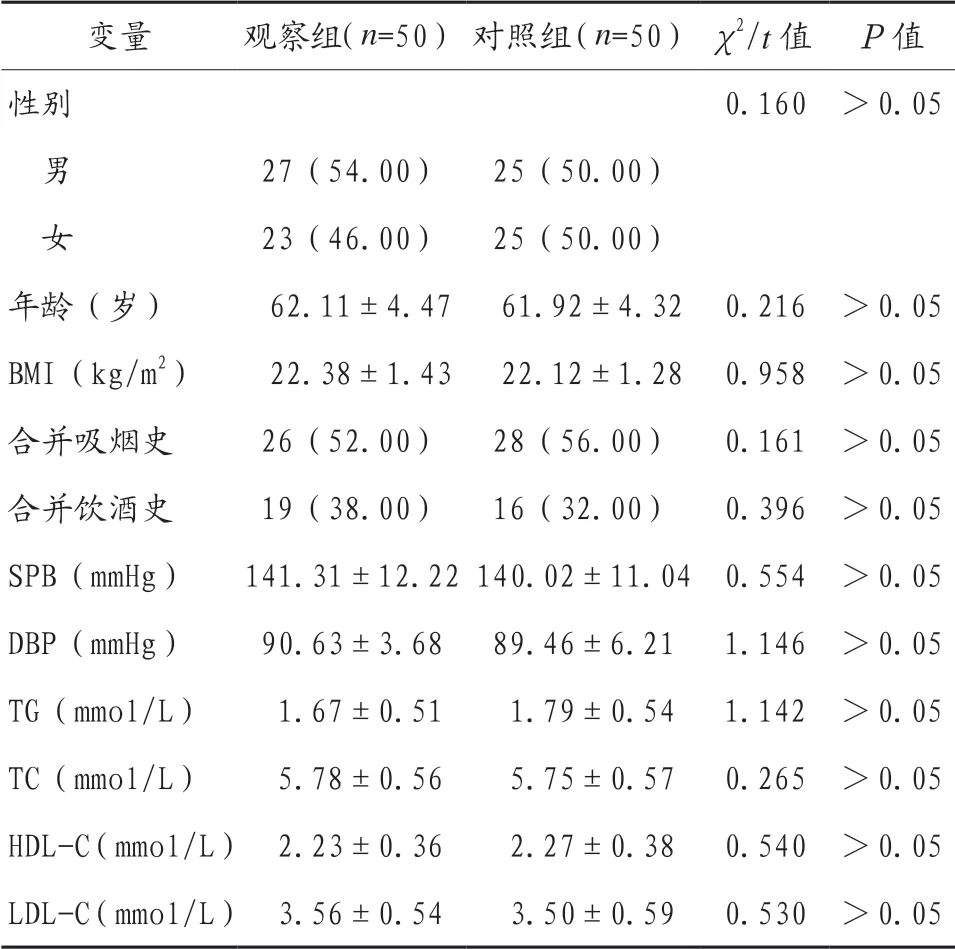
表1 两组患者一般资料比较[例(%)/(±s )]
BMI:体质量指数;SPB:收缩压;DBP:舒张压;TG:三酰甘油;TC:胆固醇;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇。
变量 观察组(n=50)对照组(n=50)χ2/t值 P值性别 0.160 >0.05男27(54.00) 25(50.00)女23(46.00) 25(50.00)年龄(岁) 62.11±4.47 61.92±4.32 0.216 >0.05 BMI(kg/m2) 22.38±1.43 22.12±1.28 0.958 >0.05合并吸烟史 26(52.00) 28(56.00) 0.161 >0.05合并饮酒史 19(38.00) 16(32.00) 0.396 >0.05 SPB(mmHg) 141.31±12.22140.02±11.04 0.554 >0.05 DBP(mmHg) 90.63±3.68 89.46±6.21 1.146 >0.05 TG(mmol/L) 1.67±0.51 1.79±0.54 1.142 >0.05 TC(mmol/L) 5.78±0.56 5.75±0.57 0.265 >0.05 HDL-C(mmol/L) 2.23±0.36 2.27±0.38 0.540 >0.05 LDL-C(mmol/L) 3.56±0.54 3.50±0.59 0.530 >0.05
2.2 CYP2C19和ABCB1基因型的分布 CYP2C19基因型野生型占比45%,突变型占比55%;ABCB1基因型CC型占比30.00%、CT型占比46.00%、TT型占比24.00%,见表2。
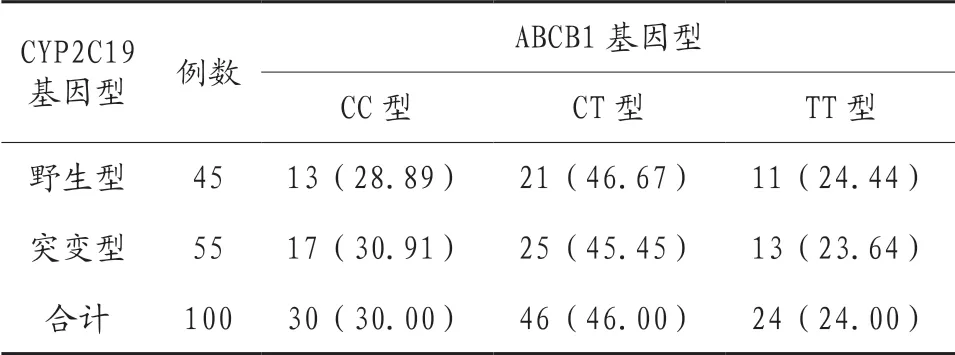
表2 CYP2C19和ABCB1基因型的分布[例(%)]
2.3 不同基因型患者氯吡格雷抵抗情况 两组患者ABCB1基因型分布比较,差异无统计学意义(P>0.05);观察组患者CYP2C19基因型野生型比例低于对照组,突变型比例高于对照组,差异有统计学意义(P<0.05),见表3。
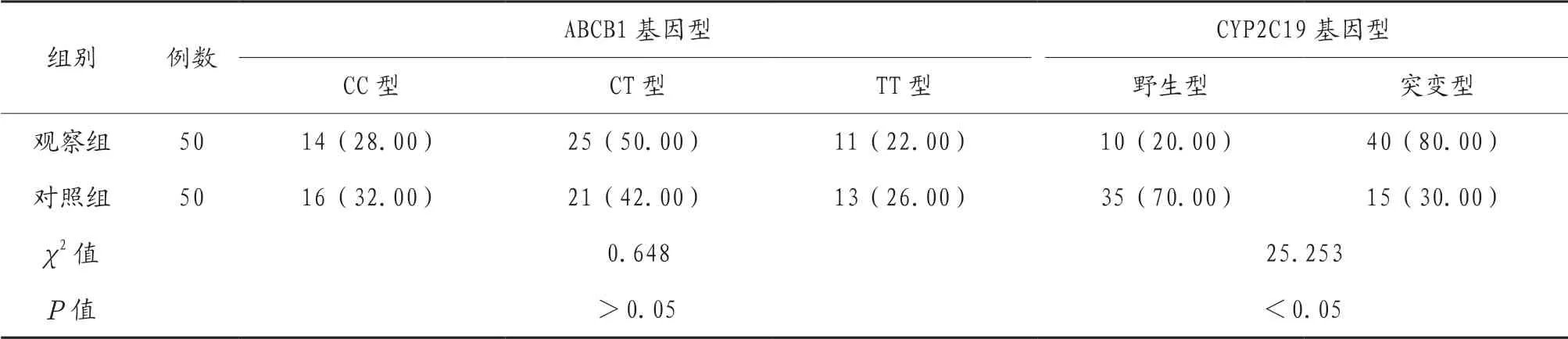
表3 不同基因型患者氯吡格雷抵抗情况[例(%)]
2.4 基因多态性与治疗后情况的相关性比较 ABCB1基因型(CC型、CT型、TT型),CYP2C19基因型(野生型、突变型)治疗后缺血事件、出血事件、治疗后3个月Rankin评分<2分比较,差异均无统计学意义(均P>0.05),见表4。
3 讨论
氯吡格雷可通过选择性地抑制二磷酸腺苷与血小板受体结合,从而抑制血小板活化及聚集。但氯吡格雷进入体内后,经胃肠道吸收效率不一,还需要通过CYP450酶系统转化为活性有效成分,可能对代谢不佳的患者疗效较差,使患者产生氯吡格雷抵抗[5]。本研究将CYP2C19、ABCB1基因多态性分析引入缺血性脑卒中患者发生氯吡格雷抵抗的判断及预后的分析中,旨在为缺血性脑卒中临床用药提供新的依据。
本研究中发生氯吡格雷抵抗、未发生氯吡格雷抵抗的患者一般资料比较,差异无统计学意义,提示常规指标检测难以预测氯吡格雷抵抗的发生。对缺血性脑卒中患者基因型多态性进行整体分析,发现CYP2C19基因型野生型占比45%,突变型占比55%,ABCB1基因型CC型占比30.00%、CT型占比46.00%、TT型占比24.00%,提示CYP2C19基因型多态性与ABCB1基因型分布没有明确关系。此外,ABCB1基因型(CC型、CT型、TT型),CYP2C19基因型(野生型、突变型)治疗后缺血事件、出血事件、治疗后3个月Rankin评分<2分比较,差异均无统计学差异,提示CYP2C19、ABCB1基因多态性对缺血性脑卒中患者预后功能并无显著影响。与既往研究[6]一致,也可能与本研究样本量较小有关,临床仍需进行进一步研究进行确认。
进一步分析观察组与对照组基因多态性,发现ABCB1基因型分布比较,差异无统计学意义,观察组CYP2C19基因型野生型比例低于对照组,突变型比例高于对照组,提示CYP2C19基因型野生型对氯吡格雷抵抗具有预测价值。分析其原因为氯吡格雷在肝脏经过CYP450酶系统转化为活性硫醇需要两步氧化代谢,CYP2C19在第一步与第二步中占比达到40%与20%,为参与氯吡格雷代谢的主要酶,CYP2C19在氯吡格雷转化为活性产物的过程中发挥重要作用,其基因多态性包括有功能性的*1,及无功能性的*2或*3,有功能性的基因型野生型更不容易产生氯吡格雷抵抗,而仅包含无功能性的*2或*3的突变型更容易产生氯吡格雷抵抗[7-9]。李娟[10]研究亦显示,CYP2C19基因型改变为氯吡格雷抵抗发生的影响因素。
综上所述,氯吡格雷治疗缺血性脑卒中过程中,CYP2C19基因多态性与发生氯吡格雷抵抗具有一定联系,而CYP2C19、ABCB1基因多态性对治疗后情况无影响,可根据患者基因型多态性,指导临床合理应用氯吡格雷。但本研究为样本量有限的单中心研究,CYP2C19、ABCB1基因多态性在氯吡格雷抵抗预测中的价值仍有待进一步研究。

