早期胃肠外营养治疗对早产儿低出生体质量儿电解质、生长调节因子及炎症细胞因子的影响
贾阳,苏芬玲,王昌燕,安婷婷
西安大兴医院新生儿科,陕西 西安 710016
低出生体质量早产儿(preterm low birth weight infant,PLBW)指胎龄超过28周不足37周,且出生体质量在2500 g以下的活产婴儿[1]。因在母体中的生长周期不足,器官功能发育不成熟,常是围产儿发病和死亡高危人群。有报道显示[2],早产占分娩总数的5%~15%,新生儿发病与死亡70%~75%和早产有关。影响PLBW发生的因素较多,包括产妇年龄过大或过小、不良嗜好、多胎、妊娠期高血压等[3]。随着医疗技术发展,PLBW存活率显著提高,但由于PLBW新生儿离开母体过早,胃肠道等器官尚未成熟完全,体内能量储存不足,完成追赶性生长的同时,还面临各类疾病威胁,存在生长滞后问题,单纯肠道喂养不能满足需求。胃肠外营养又称静脉营养,可帮助PLBW新生儿摄取必要营养成分,改善生长结局[4]。本研究对比分析早期胃肠外营养方案、延迟胃肠外营养方案治疗对PLBW新生儿生长发育的情况,现报道如下:
1 资料与方法
1.1 一般资料 选取2020年6月至2021年3月西安大兴医院新生儿科收治且符合以下纳入和排除标准的92例PLBW新生儿为研究对象,按照随机数表法分为观察组与对照组,每组46例。观察组中男性24例,女性22例;胎龄28~36周,平均(32.01±2.36)周;出生体质量1676~2341 g,平均(2049.23±193.51)g;自然分娩27例,剖宫产19例。对照组中男性23例,女性23例;胎龄28~36周,平均(32.18±1.97)周;出生体质量1662~2385 g,平均(2060.23±180.75)g;自然分娩26例,剖宫产20例。两组新生儿的一般资料比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准。
1.2 纳排标准 纳入标准:(1)胎龄<37周,出生体质量<2500 g活产新生儿;(2)无其他严重功能缺陷;(3)家属知情同意。排除标准:(1)严重先天畸形,包括复杂先心病、消化、呼吸、神经系统畸形等;(2)先天性遗传代谢性疾病;(3)合并严重心肺功能异常;(4)出现休克和(或)多器官衰竭;(5)染色体数目或结构异常;(6)宫内生长迟缓或生长过速。
1.3 治疗方法 观察组新生儿给予早期胃肠外营养,对照组新生儿给予延迟胃肠外营养。早期胃肠外营养方法:于出生后12 h内,通过静脉给予小儿氨基酸,初始量为2.4 g/(kg·d),每天增加0.5~3.4 g/(kg·d)为止;初始脂肪乳2.5 g/(kg·d),每天增加0.5~3.5 g/(kg·d)为止;初始葡萄糖12 g/(kg·d),每天增加2.0~16 g/(kg·d)为止。延迟胃肠外营养方法:出生72 h后通过静脉给予小儿氨基酸,初始量为2.4 g/(kg·d),每天增加0.5~3.4 g/(kg·d)为止;初始脂肪乳2.5 g/(kg·d),每天增加0.5~3.5 g/(kg·d)为止;初始葡萄糖12 g/(kg·d),每天增加2.0~16 g/(kg·d)为止。两组均持续治疗7 d。
1.4 观察指标与检测方法 (1)体格指标:分别于出生时和干预后第7天由专人测量体格指标,使用婴儿电子台称测量体质量;新生儿专用身长测量尺测量身长;新生儿专用头围测量尺测量头围,经枕骨粗隆和双侧眉弓最高点绕头1周。(2)血液指标:于出生后2 h内,以及出生后7 d取股静脉血3 mL,离心机3000 r/min离心15 min,留取血清。①营养指标:通过速率散射免疫比浊法检测总蛋白(Total protein,TP)、白蛋白(Albumin,ALB)、前白蛋白(Prealbumin,PA)水平。②电解质指标:通过深圳市凯特生物医疗XI-921D电解质分析仪检测血钾、血钠、血钙水平。③生长调节指标:生长激素(Growth hormone,GH)水平检测采用化学发光免疫分析法;胰岛素样生长因子-1(Insulin-like growth factor 1,IGF-1)、胰岛素样生长因子结合蛋白3(Insulin-like growth factor binding protein-3,IGFBP-3)采用放射免疫分析法测定,试剂盒来自天津市协和医药科技。④炎性指标:血清转化生长因子-β(Transforming growth factor-β,TGF-β)、肿瘤坏死因子-α(Tumor necorosis fator-α,TNF-α)、白细胞介素-10(Interleukin 10,IL-10)水平检测采用酶联免疫吸附法,试剂盒来自上海康朗生物科技。
1.5 统计学方法 所有数据均采取双人不交流录入EXCEl表格,SPSS17.0采用统计学软件分析数据。计量资料符合正态分布,以均数±标准差(x-±s)表示,组间比较采取t检验;计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组新生儿的体格指标比较 两组新生儿出生时以及出生后7 d的体质量、身长、头围比较差异均无统计学意义(P>0.05),见表1。
表1 两组新生儿的体格指标比较(±s)

表1 两组新生儿的体格指标比较(±s)
组别观察组对照组t值P值例数4646出生时2049.23±193.512 060.14±180.750.2790.781出生后7 d 2087.95±202.092 080.73±190.110.1520.880出生时45.81±4.0945.72±5.020.0940.925出生后7 d 46.83±2.1946.50±2.880.6190.538出生时30.39±1.0530.47±1.130.3520.726出生后7 d 31.02±1.1630.89±1.220.5240.602体质量(g) 身长(cm) 头围(cm)
2.2 两组新生儿的营养指标比较 两组新生儿出生时的血液营养指标比较差异均无统计学意义(P>0.05);两组新生儿的出生后7 d血ALB、PA、TP水平均较出生时升高,且观察组明显高于对照组,差异均有统计学意义(P<0.05),见表2。
表2 两组新生儿的营养指标比较(±s)

表2 两组新生儿的营养指标比较(±s)
注:与本组出生时比较,a P<0.05。
组别观察组对照组t值P值例数4646出生时27.53±3.8127.05±2.970.6740.502出生后7 d 35.09±4.05a 32.18±3.42a 3.7230.001出生时81.09±10.7580.95±9.220.0670.947出生后7 d 115.63±8.01a 108.07±7.45a 4.6870.001出生时41.14±4.2940.73±3.130.5240.602出生后7 d 52.92±3.8749.23±4.144.4160.001 ALB(g/L) PA(mg/L) TP(g/L)
2.3 两组新生儿的电解质指标比较 两组新生儿出生时的电解质指标水平比较差异均无统计学意义(P>0.05);两组新生儿出生后7 d血钠水平比较差异无统计学意义(P>0.05),但观察组新生儿出生后7 d血钾水平明显低于对照组,血钙水平明显高于对照组,差异均有统计学意义(P<0.05),见表3。
表3 两组新生儿的电解质指标比较(±s)
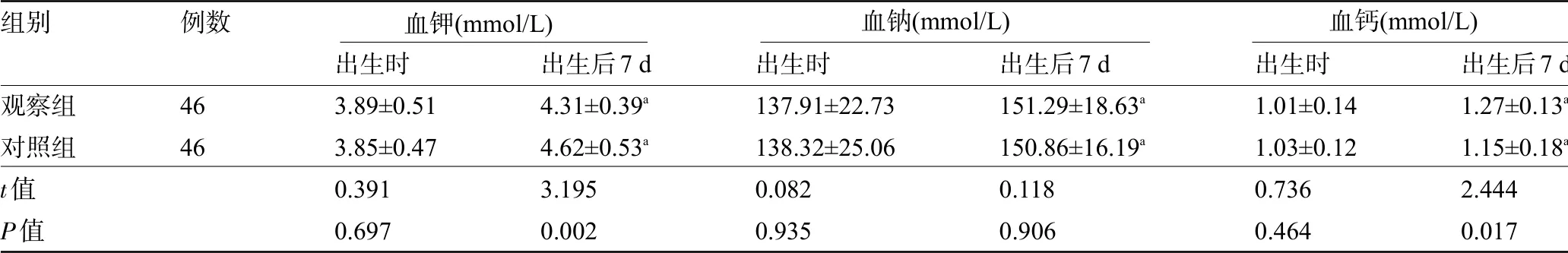
表3 两组新生儿的电解质指标比较(±s)
注:与本组出生时比较,a P<0.05。
组别观察组对照组t值P值例数4646出生时3.89±0.513.85±0.470.3910.697出生后7 d 4.31±0.39a 4.62±0.53a 3.1950.002出生时137.91±22.73138.32±25.060.0820.935出生后7 d 151.29±18.63a 150.86±16.19a 0.1180.906出生后7 d 1.27±0.13a 1.15±0.18a 2.4440.017出生时1.01±0.141.03±0.120.7360.464血钾(mmol/L) 血钠(mmol/L) 血钙(mmol/L)
2.4 两组新生儿的生长调节指标水平比较 两组新生儿出生时与出生后7 d血清IGFBP-3、GH水平比较差异均无统计学意义(P>0.05);两组新生儿出生后7 d的血清IGF-1水平较出生时升高,且观察组明显高于对照组,差异均有统计学意义(P<0.05),见表4。
表4 两组新生儿的生长调节指标水平比较(±s)
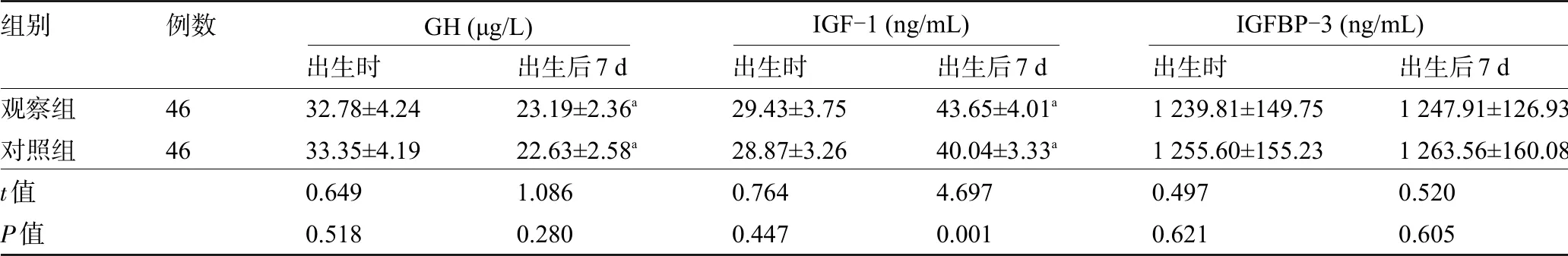
表4 两组新生儿的生长调节指标水平比较(±s)
注:与本组出生时比较,a P<0.05。
组别观察组对照组t值P值例数4646出生时32.78±4.2433.35±4.190.6490.518出生后7 d 23.19±2.36a 22.63±2.58a 1.0860.280出生时29.43±3.7528.87±3.260.7640.447出生后7 d 43.65±4.01a 40.04±3.33a 4.6970.001出生后7 d 1247.91±126.931 263.56±160.080.5200.605出生时1239.81±149.751 255.60±155.230.4970.621 GH(μg/L) IGF-1(ng/mL) IGFBP-3(ng/mL)
2.5 两组新生儿的炎性指标比较 两组新生儿出生时的炎性指标比较差异均无统计学意义(P>0.05);两组新生儿出生后7 d的血清TGF-β、IL-10水平较出生时升高,且观察组明显高于对照组,TNF-α水平较出生时降低,且观察组明显低于对照组,差异均有统计学意义(P<0.05),见表5。
表5 两组新生儿的炎性指标水平比较(±s)
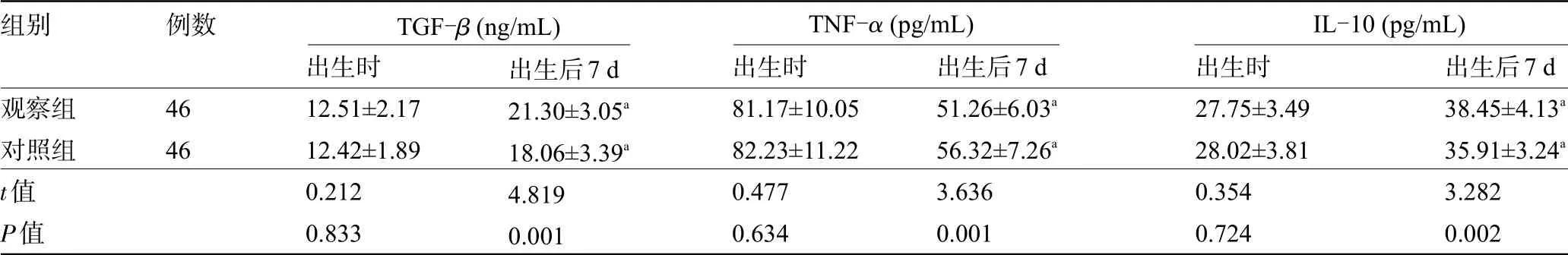
表5 两组新生儿的炎性指标水平比较(±s)
注:与本组出生时比较,a P<0.05。
组别观察组对照组t值P值例数4646出生时12.51±2.1712.42±1.890.2120.833出生后7 d 21.30±3.05a 18.06±3.39a 4.8190.001出生时81.17±10.0582.23±11.220.4770.634出生后7 d 51.26±6.03a 56.32±7.26a 3.6360.001出生后7 d 38.45±4.13a 35.91±3.24a 3.2820.002出生时27.75±3.4928.02±3.810.3540.724 TGF-β(ng/mL) TNF-α(pg/mL) IL-10(pg/mL)
3 讨论
PLBW新生儿因胃肠消化功能尚不成熟,能量摄取过多可导致代谢及排泄负担均加重,但为了有效弥补早产导致的体质量偏低,又需要增加营养摄入[5-6]。
PLBW新生儿胃容量较、进食量少、肠道血流少、耐受不良,再加上呕吐吮吸以及呑咽反射不良,食管贲门括约肌差,凡经口喂养无法满足热量需求,应积极予以肠道外营养[7-8]。传统肠外营养形式,通常在出生后48~72 h给予葡萄糖注射液,72 h后补充氨基酸、脂肪乳,但研究显示[9],胎儿经胎盘吸取维持正常生长发育所必须的营养素,因此如若不是有相应禁忌证,均需要在出生后保持必要的营养素供应。一般来说,早产儿在出生后的第1天即能够耐受1.0 g/(kg·d)氨基酸,48 h即能够耐受输注脂肪乳[10]。
本研究中两组新生儿干预后体质量、身长、头围比较无明显差异,这可能是由于本研究仅对比出生后7 d两组新生儿体格指标差异,研究时间较短。营养状态对早产低出生体质量儿生长速度与发育具有重要影响,进一步比较两组营养指标差异,结果显示观察组出生后7 d,ALB、PA、TP水平均高于对照组,说明早期胃肠外营养治疗有利于改善PLBW新生儿体内蛋白质缺失,改善蛋白质负平衡。PLBW新生儿营养储存有限但需求较大,一般来说,出生后1周,每天至少需保持60 kcal/kg及以上的热量摄入,机体才不会通过组织分解来维持热量需求;80~90 kcal/kg热量摄入才可大致保持和宫内相近的生长水平,早期营养支持提升必需氨基酸浓度,增加蛋白质合成,以达到与宫内相近蛋白质增长效率[11]。GH/IGF-1轴是人体质量要生长调节机制,GH刺激骨、软骨细胞的生长与分化;GH刺激IGF-1合成,IGF-1又介导GH促生长作用,IGFBP-3与IGF-1结合调节其体内分布与清除。GH/IGF-1轴促进细胞DNA、RNA、蛋白质合成与细胞增殖[12-13]。本研究中出生后7 d,观察组新生儿血清IGF-1水平高于对照组,提示早期胃肠外营养可以尽早为PLBW新生儿提供与正常宫内生长胎儿接近的能量与蛋白质,促进IGF-1分泌,有利于患儿生长发育。
PLBW新生儿出生72 h内易出现电解质紊乱,胃肠外营养不合理可致细胞能量供应不足,导致钠离子-钾离子-ATP酶活性降低,细胞内钾离子外流,若情况严重,可致死亡性心律失常[14]。本研究对比两组新生儿出生后7 d电解质指标差异。临床研究表明,早期胃肠外营养治疗及时予以氨基酸补充,有效降低超低出生体质量儿高钾血症风险,改善糖耐量[15]。本研究中观察组干预后7 d血钾低于对照组,血钙高于对照组,提示早期胃肠外营养可缓解PLBW新生儿电解质紊乱,与上述研究结果一致。相较于健康足月儿,PLBW新生儿感染性疾病发生风险较大,Th1/Th2平衡直接影响机体病原体抵御能力。本研究对比两组干预后血清TGF-β、IL-10、TNF-α水平,TGF-β是调节性T细胞亚群细胞因子,有利于Th1/Th2细胞平衡维持;IL-10作为抗炎因子,抑制Th1表达,降低促炎因子表达;TNF-α为促炎因子,在炎症发生发展中发挥重要作用,观察组出生后7 d血清TGF-β、IL-10水平高于对照组,TNF-α低于对照组,提示PLBW新生儿给予早期肠外营养有利于维持体内免疫细胞因子平衡状态。
综上所述,PLBW新生儿给予早期胃肠外营养有利于改善新生儿营养状态,促进IGF-1合成分泌,促进电解质平衡恢复,调节促炎性细胞因子与抗炎性细胞因子间的平衡。

