DC-CIK疗法联合伽马刀治疗局部淋巴结转移性食管癌患者的疗效
张百乐 张建东 丁岩
食管癌(esophageal cancer,EC)常表现为消瘦脱水、吞咽困难等,其发病率、死亡率较高,是八大恶性肿瘤之一[1]。随着疾病进展,EC患者会出现局部淋巴结转移,锁骨淋巴结转移病灶多与周围组织粘连,侵犯神经,纵隔淋巴结转移病灶常压迫食管、气管、喉返神经等,引发进食梗阻、呼吸困难、声音嘶哑等[2]。目前,临床多以手术、放化疗、生物疗法等手段治疗EC,虽可取得一定临床疗效,但单独应用效果有限[3]。伽马刀对肿瘤细胞杀伤力较大,可有效促进肿瘤细胞凋亡,但治疗后易复发[4]。树突状细胞联合细胞因子诱导的杀伤细胞(DC-CIK)疗法是将化学和生物治疗结合的一种新型抗肿瘤治疗模式,其在EC的治疗方面越来越受到临床重视[5]。本研究尝试以DC-CIK疗法联合伽马刀治疗局部淋巴结转移性EC患者,观察其临床疗效及对免疫功能的影响,旨在为临床治疗EC提供参考。
1 资料与方法
1.1 一般资料 选取南阳市第一人民医院2018年2月至2019年10月收治的108例局部淋巴结转移性EC患者,随机数字表分为对照组54例、联合组54例。两组性别、年龄、病程、肿瘤分期、肿瘤位置等一般资料比较,差异无统计学意义(P>0.05),见表1。
表1 两组患者一般资料比较[n(%),(±s)]

表1 两组患者一般资料比较[n(%),(±s)]
项目 对照组(n=54)联合组(n=54) 统计值 P值性别 0.037 0.847男28(51.85) 29(53.70)女26(48.15) 25(46.30)年龄(岁) 52.24±3.62 53.19±4.07 1.282 0.203病程(月) 13.74±2.87 12.96±2.48 1.511 0.134肿瘤分期 0.348 0.555Ⅱ期 31(57.41) 34(62.96)Ⅲ期 23(42.59) 20(37.04)肿瘤位置 0.148 0.700颈段 25(46.30) 27(50.00)胸上段 29(53.70) 27(50.00)
1.2 选取标准 纳入标准:符合局部淋巴结转移性EC相关诊断标准[6];无沟通交流障碍;临床分期Ⅱ~Ⅲ期;卡氏功能状态评分>60分;患者同意本文采用的治疗方案,并签署知情同意承诺书。排除标准:对本研究相关药物过敏;伴有心、肺、肾等严重功能不全;全身免疫性反应;治疗依从性差;精神状态异常。
1.3 治疗方法 对照组采用伽马刀治疗,联合组采用DC-CIK联合伽马刀治疗。
1.3.1 伽马刀 5次/周,治疗操作均由伽马刀专科医师进行。患者取仰卧位(可根据病灶部位及其周围组织调整),选取SGS-Ⅰ型立体定向伽马刀(深圳渤海科技有限公司),根据患者具体病情给予初始剂量50~60 Gy,病灶区给予总剂量50%进行照射,病灶周围以4 Gy/次进行10~12次照射(使用总剂量40~48 Gy)。
1.3.2 DC-CIK疗法 采集患者外周静脉血,采用血液成分分离机(郑州飞龙医疗设备有限公司)分离单个核细胞,使用磷酸盐缓冲液(ScienCell)洗涤2~4次,37 ℃下置于培养瓶中孵育2 h,移除悬浮细胞至GT-T601培养袋中。加入30 mL GT-T551培养液[重组人粒细胞巨噬细胞刺激因子(GM-CSF,厦门特宝生物工程有限公司)、白细胞介素-4(IL-4,Pepro-tech公司) 含量均为1 000 U/mL] 至培养瓶中,于培养箱(5% CO2,37 ℃)内培养,每3 d进行一次换液并扩充相关细胞因子,第6天加入注射用重组人干扰素(IFN-γ,上海凯茂生物医药有限公司),诱导DC细胞成熟。CIK细胞的培养:向培养袋中加入GT-T551培养液(GM-CSF、IFN-γ含量均为1 000 U/mL),24 h后加入CD3单克隆抗体(50 ng/mL,古巴分子免疫学中心)和重组人白介素-2(rhIL-2,1 000 U/mL,北京四环生物制药有限公司),每3 d进行一次换液并补充rhIL-2。第8天收获成熟DC细胞,按照5∶1与CIK细胞继续培养,第14天获得DC-CIK细胞。以生理盐水冲洗2~4次后静脉回输,1×109个/次,1次/d,连续5 d。两组均以3周为1个周期,共治疗2个周期。
1.4 检测方法
1.4.1 免疫功能指标(CD3+、CD4+、CD4+/CD8+) 于清晨采集患者空腹状态下外周血,采用流式细胞术测 定 外 周 血CD3+、CD4+、CD4+/CD8+水 平,并 计 算CD4+/CD8+比值,检测仪器为CytoFLEX流式细胞仪(美国贝克曼库尔特公司)。
1.4.2 血清血小板反应蛋白-1(TSP-1)、基质金属蛋白酶-9(MMP-9)、血管内皮生长因子(VEGF)、钙结合蛋白(S100A4)水平 取上述血液标本,以3 500 r/min转速离心处理,10 min后取血清,采用酶联免疫吸附试验测定血清TSP-1、MMP-9、VEGF、S100A4水平,相关试剂盒分别购自上海酶研生物科技有限公司 (TSP-1、MMP-9、VEGF)、南京赛泓瑞生物科技有限公司(S100A4)。
1.5 疗效判定标准 治疗2个周期后参照相关评价标准[7]评估疗效,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。其中CR:基线病灶完全消失且维持30 d以上;PR:基线病灶缩小≥50%及以上,未出现新病灶,且维持30 d以上;SD:基线病灶缩小<50%或增大<25%,未出现新病灶,且维持30 d以上;PD:基线病灶增大≥25%或有新病灶出现。客观缓解率(ORR)=(CR+PR)例数/总例数×100%。
1.6 观察指标 ①临床疗效。②治疗前、治疗2个周期后免疫功能指标(CD3+、CD4+、CD4+/CD8+)。③治疗前、治疗2个周期后血清TSP-1、MMP-9、VEGF、S100A4水平。④随访2年,1年、2年生存率。
1.7 统计学方法 以SPSS 22.0对结果进行分析。计数资料以率[n(%)]表示,行χ2检验,计量资料以均数±标准差(±s)表示,行t检验,等级资料采用秩和检验,P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较 两组ORR比较,联合组79.63%高于对照组61.11%(P<0.05),见表2。

表2 两组患者临床疗效比较[n(%)]
2.2 两组患者免疫功能指标比较 治疗2个周期 后 联 合 组CD3+、CD4+、CD4+/CD8+明 显 高 于 对 照 组(P<0.05),见表3。
表3 两组患者免疫功能指标比较(±s)

表3 两组患者免疫功能指标比较(±s)
注:CD3+、CD4+、CD4+/CD8+=免疫功能指标;与同组治疗前比较,aP<0.05。
组别 例数 CD3+(%) CD4+(%)治疗前 治疗2个周期后 治疗前 治疗2个周期后 治疗前 治疗2个周期后联合组 54 53.46±4.18 62.85±5.46a 31.42±4.19 39.76±4.03a 1.07±0.22 1.24±0.18a对照组 54 52.27±5.03 47.79±4.57a 30.85±4.37 26.27±3.31a 1.05±0.19 0.86±0.10a t值 1.337 15.543 0.692 19.009 0.506 13.561 P值 0.184 <0.001 0.491 <0.001 0.614 <0.001 CD4+/CD8+
2.3 两组患者血清TSP-1、MMP-9、VEGF、S100A4水平比较 治疗2个周期后联合组血清TSP-1水平高于对照组,MMP-9、VEGF、S100A4水平低于对照组(P<0.05),见表4。
表4 两组患者血清TSP-1、MMP-9、VEGF、S100A4水平比较(±s)
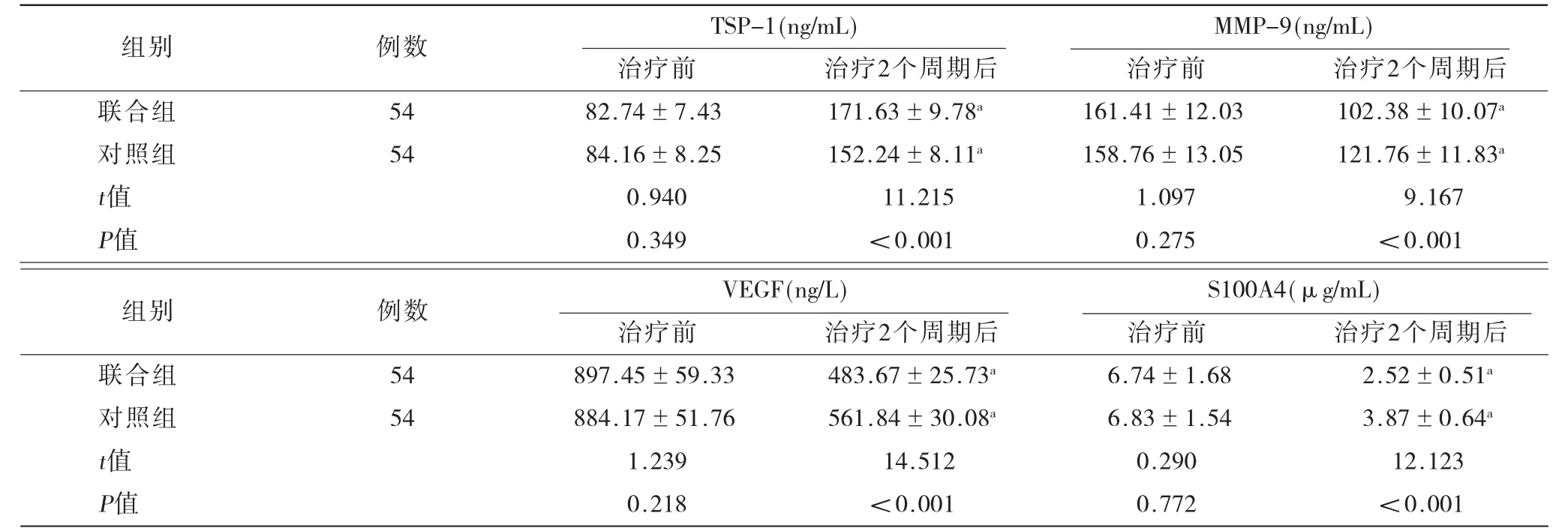
表4 两组患者血清TSP-1、MMP-9、VEGF、S100A4水平比较(±s)
注:TSP-1=血小板反应蛋白-1,MMP-9=基质金属蛋白酶-9,VEGF=血管内皮生长因子,S100A4=钙结合蛋白;与同组治疗前比较,P<0.05。
组别 例数 TSP-1(ng/mL) MMP-9(ng/mL)治疗前 治疗2个周期后 治疗前 治疗2个周期后联合组 54 82.74±7.43 171.63±9.78a 161.41±12.03 102.38±10.07a对照组 54 84.16±8.25 152.24±8.11a 158.76±13.05 121.76±11.83a t值 0.940 11.215 1.097 9.167 P值 0.349 <0.001 0.275 <0.001组别 例数 VEGF(ng/L) S100A4(μg/mL)治疗前 治疗2个周期后 治疗前 治疗2个周期后联合组 54 897.45±59.33 483.67±25.73a 6.74±1.68 2.52±0.51a对照组 54 884.17±51.76 561.84±30.08a 6.83±1.54 3.87±0.64a t值 1.239 14.512 0.290 12.123 P值 0.218 <0.001 0.772 <0.001
2.4 两组患者生存率比较 随访2年,联合组失访5例,对照组失访4例。联合组1年、2年生存率高于对照组(P<0.05),见表5。
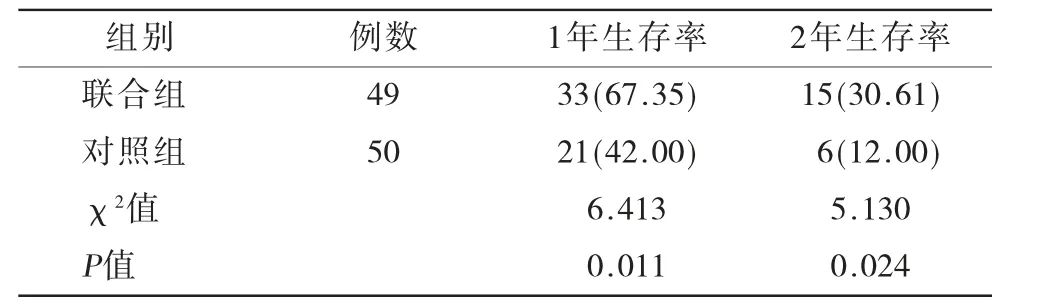
表5 两组患者生存率比较[n(%)]
3 讨论
随着医学科技进步,EC治疗手段不断被完善,但其5年生存率仅15%左右,且易复发,严重威胁患者生命健康[8]。因此优化EC治疗方案以提高生存率仍是临床研究重点方向[9]。
伽马刀采用多线束、多野、多源三维空间聚焦,射线呈锥形分布,具有射线集中、局部剂量高等特点,可对肿瘤细胞产生较大杀伤力,且对周围正常组织照射较少,可保护周围组织及器官;但伽马刀治疗常伴随呕吐、恶心等胃肠道不良反应,对患者身心带来极大痛苦[10]。
DC-CIK疗法是一种过继性细胞免疫疗法,其中DC细胞具有较强抗原呈递作用,可诱导抗原特异性T细胞功能,激活自然杀伤T细胞肿瘤识别能力;CIK细胞具备抗原活性及抗肿瘤活力,可杀死肿瘤细胞,增强机体免疫细胞功能,具有杀伤力强、增殖快、杀瘤谱广等特点[11]。DC细胞、CIK细胞共培养得到DC-CIK细胞,可有效提高机体免疫系统功能,提高杀死肿瘤细胞的能力[12]。本研究结果显示,与对照组相比,联合组ORR、1年及2年生存率较高,CD3+、CD4+、CD4+/CD8+水平较高,表明DC-CIK疗法可在伽马刀杀伤肿瘤细胞、减轻肿瘤负荷基础上,进一步杀死隐匿肿瘤细胞,并增强机体免疫应答反应,缓解毒副损伤,从而延长患者生存期,提高临床疗效及生存质量。
有研究表明S100A4高表达可影响细胞周期,引发细胞恶变导致肿瘤发生;还可抑制细胞间黏附作用,加速降解、重塑细胞外基质及血管生成,从而加重肿瘤转移风险[13]。TSP-1属于血管生成抑制因子,其高表达可抑制血管内皮细胞增殖及血管生成,而VEGF属于血管生成促进因子,与TSP-1机制相反[14]。有研究表明MMP-9参与炎症反应、血管形成、创伤修复等多种病理生理过程,且在肿瘤细胞侵袭及转移中发挥重要作用[15]。本研究中,联合组血清TSP-1 水平高于对照组,MMP-9、VEGF、S100A4水平低于对照组,表明联合组治疗方案可增强细胞间黏附作用,抑制血管生成,有效抑制肿瘤细胞转移,进一步抑制EC疾病进展。
综上所述,采用DC-CIK疗法联合伽马刀治疗局部淋巴结转移性EC患者,可显著提高机体免疫系统功能,增强对肿瘤细胞的杀伤力,缓解临床毒副反应,进一步提高临床疗效、延长生存期。

