MRI、TRUS联合血清PSA诊断前列腺癌的价值观察
王环震 席 玉
1.南阳市第一人民医院生殖医学科(河南 南阳 473000)
2.南阳市第一人民医院多学科综合门诊(河南 南阳 473000)
前列腺癌(prostate cancer,PCA)是在中老年男性中常见的泌尿生殖系统恶性肿瘤[1]。目前诊断PCA的方法有血清前列腺特异性抗原(PSA)、经直肠超声(TRUS)及磁共振成像(MRI)等,PSA与PCA病变有密切关系,是PCA的重要鉴别参考指标,血清PSA升高越明显则癌病变可能性越大,但PSA轻度上升时医生较难鉴别其良恶性,TRUS有图像实时动态、无创等优点,但TRUS前列腺阳性预测值仅18%~60%,缺乏特异性[2]。MRI对软组织有较高的分辨率,近年来随MRI技术不断发展,MRI多参数、多序列成像的优势使其对PCA的检出率也不断提高[3],然而目前关于MRI、TRUS、PSA联合检测对PCA的诊断价值研究甚少。本文主要探讨MRI、TRUS、PSA联合诊断PCA的临床价值。
1 资料及方法
1.1 基线资料选取我院2018年9月至2020年3月收治的140例疑似PCA患者,均行MRI检查、TRUS引导下的前列腺穿刺活检、血清PSA检测。患者均为男性,年龄26~65岁,平均(45.16±4.62)岁;体重50~63 kg,平均(54.89±5.51)kg。
纳入标准:均有完整的穿刺活检及病理组织检查结果,入组前1周未行前列腺穿刺、前列腺按摩或膀胱镜检查等;入院时自诉夜尿增多、尿频、血尿等,血清PSA>4 ng/mL;签订知情同意书并积极配合参与本研究。排除:同时存在急性尿潴留病变;合并精神障碍或医师沟通障碍;合并PCA以外的其他肿瘤疾病者。
1.2 方法
1.2.1 MRI检查 检查前禁食禁水6h,检查前将膀胱排空。经西门子Avanto 1.5T超导型磁共振仪进行扫描,患者取仰卧位,8通道腹部相控阵线圈固定于耻骨和耻骨上方腹壁处。对前列腺开展T2WI与DWI扫描,T2WI各项参数:TR 4000ms,TE 95ms,厚度4mm,层间距0.8mm,FOV 180mm×180mm,矩阵=460×512,DWI各项参数为:TR 4584 ms,TE为最小值,厚度4mm,FOV 250mm×250mm,层间距1mm,激励2次,设定b值为0,100,200,600,800 s/mm2,以单次自旋回波扫描方式予以扫描。扫描完毕注入0.1mmol/kg的钆喷酸葡胺,速率3mL/s。将图像传送至MRI工作站进行后处理和分析。
1.2.2 TRUS检查 应用彩色多普勒超声诊断仪,以16G或18G×200mm规格的活检针,直肠探头6V3(频率在5~10 MHz)附加穿刺引导架。病人仰卧或取膀胱截石位,进行直肠指诊,对病变部位、硬度和前列腺的大小进行了解,采用5%聚维酮碘常规消毒肛周、会阴部和肛管,铺以无菌巾,在直肠内灌注10~20 mL的盐酸奥布卡因凝胶,直肠探头涂抹无菌的耦合剂,将保护套套好并固定穿刺架后送到病人的直肠内部,观察前列腺的大小及血流,明确病灶的部位及和邻近组织结构关系,采用12+N针的多点系统穿刺法进行穿刺。所选取的组织标本置于滤纸上,后送病理科检查。术后直肠内以凡士林纱布填塞压迫止血。
1.2.3 血清PSA水平检测 取空腹静脉血2mL,4000 r/min离心10 min分离血清,采用PSA试剂盒以化学发光免疫分析法对PSA水平进行测定。
1.3 统计处理经SPSS 23.0软件对数据进行处理,计数资料采用率(%)的形式表示,予以χ2检验,计量资料经()的形式表示,行单因素方差分析及LSD-t检验,绘制ROC曲线对诊断效能进行评估,采用秩和检验比较曲线下面积(AUC),P<0.05为差异有显著性。
2 结 果
2.1 病理结果140例疑似病例经病理确诊为非PCA 59例(包括前列腺良性增生33例、前列腺炎26例)、PCA 81例。
2.2 影像学特点及典型病例MRI下PCA病灶T2WI呈斑片状低信号,DWI病灶部位存在异常高信号,ADC呈低信号,TRUS下病灶呈低密度阴影、边缘毛躁、与周围组织分界不清,血流信号丰富,典型病例见图1~图4。

图1~图4 患者男,61岁,病理证实为PCA。图1:T2WI,中央区、左侧外周带稍低信号占位(短箭),右前方包膜外凸改变(长箭);图2:DWI示肿块呈稍高信号;图3:PCA穿刺后,ADC图可见病灶呈低信号;图4:TRUS可见前列腺散在多发低回声结节,边缘不整齐,回声不均质,前列腺膜被膜连续中断,被膜破坏明显。
2.3 PCA与非PCA患者血清PSA水平比较PCA患者血清PSA水平高于前列腺良性增生、前列腺炎患者(P<0.05),前列腺炎患者血清PSA水平高于前列腺良性增生患者(P<0.05),见表1。

表1 PCA与非PCA患者血清PSA水平比较
2.4 MRI、TRUS及血清PSA的诊断结果ROC曲线显示,MRI、TRUS及血清PSA诊断PCA的灵敏度、特异度、曲线下面积高于三者单独诊断(P<0.05),见表2、图5。
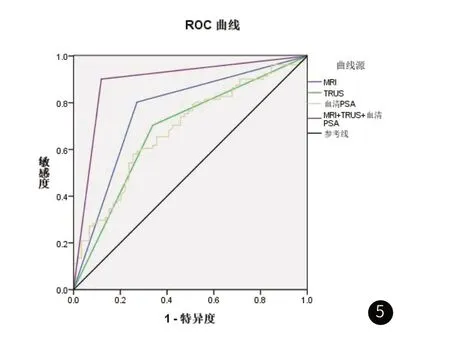
图5 ROC曲线
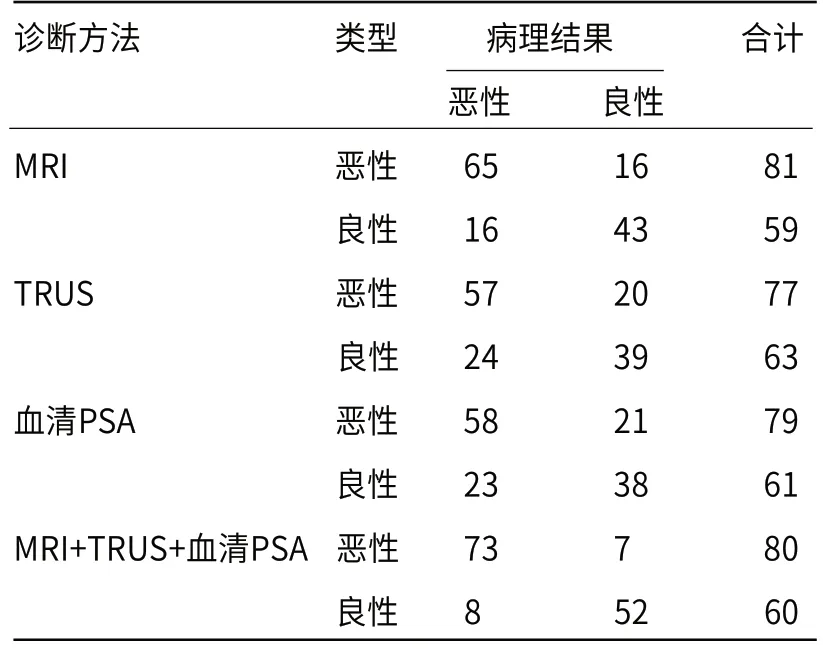
表2 MRI、TRUS、血清PSA诊断结果

表3 MRI、TRUS及血清PSA的诊断效能
3 讨 论
PCA的潜伏时间较长,发病率约为男性肿瘤的20%,其发病机制较复杂,患者的病情及性生活可互相影响,出现射精疼痛,近年来PCA发病率有上升趋势,对其进行准确诊断有重要意义[4]。正常情况下机体产生的PSA大部分随精液排出,仅少量进入血液中,一旦机体出现前列腺炎症、前列腺增生及PCA等疾病时,PSA均会大量释放入血,因而PSA常作为PCA的重要标志物[5]。TRUS因有高分辨率、成像清晰、安全性高等优势而成为诊断PCA的主要途径[6],有研究[7]显示,血清PSA升高的病人PCA检出率为47.8%,随血清PSA值升高,PCA患者TRUS穿刺活检的检出率越高。MRI检查受骨盆影响小,可较好地将前列腺细微结构进行显示,因此多数PCA检查采用MRI,研究[8]发现,MRI与TRUS靶向穿刺和第二版前列腺图像报告和数据系统(PI-RADS)相结合较系统穿刺可有效提高前列腺的穿刺阳性率,且能提高有临床意义PCA的检出率,因此考虑MRI、TRUS及PSA联合检测对PCA有一定诊断价值。
本研究发现,PCA病灶在MRI及TRUS下均有一定影像学特征,且PCA与非PCA患者血清PSA差异也有统计学意义,表明MRI、TRUS、血清PSA均对PCA有一定诊断价值。MRI、TRUS、血清PSA三项单独诊断时,MRI的效能最高,灵敏度为80.25%,特异度为72.88%,AUC为0.766,高于TRUS的0.685、血清PSA的0.680,这与早期上官勋等[9]的报道结果(MRI、PSA、TRUS诊断前列腺癌的曲线下面积分别为0.813、0.569、0.568)相近,表明单纯诊断时MRI有一定诊断效能,可能与MRI的高分辨率、多参数成像可更清晰显示病灶,对病灶进行定性诊断有关[10]。上述上官勋等学者也发现,联合MRI-T2WI、DWI、DCE-MRI利于对PSA水平在4~10μg/L的PCA者予以早期诊断,可明显地提高预测穿刺阳性准确率,因此考虑将MRI与PSA联合诊断有一定价值。既往有学者[11]报道,PSA与TRUS引导下前列腺穿刺活检联合可将灵敏度、特异度分别提高至98.65%、87.04%。汪洋等[12]指出,MRI与TRUS联合定位穿刺活检与12针系统穿刺活检对临床有意义PCA的诊断率分别是74.1%、35.1%。本研究借鉴以往经验,分析发现MRI、TRUS与血清PSA三者联合可将诊断PCA的灵敏度、特异度分别提高至90.12%、88.14%,而AUC为0.891,这与上述研究基本一致,表明MRI、TRUS与血清PSA联合诊断PCA价值较高。MRI的多参数成像如DWI、T2WI及ADC图像等可将前列腺包膜与各区形态及结构清晰显示出来,对PCA病灶进行准确的大小判断和定位,尤其是DWI可反映微观结构,对PCA有较高诊断价值,TRUS可较好显示良恶性肿瘤形态大小、边界及周边组织情况,研究[13]发现,MRI与TRUS联合定位穿刺活检成本相对较低,且操作简便而快捷;而血清中PSA虽然是PCA的特异性诊断标志物,但中老年男性前列腺增生及PCA可能同时存在,且二者症状表现较相似,如夜尿增多、尿频、血尿等,此外血清PSA水平可受尿路感染、前列腺炎、尿道操作、留置导尿等多因素影响而呈升高趋势,因此单一PSA诊断PCA的灵敏度与特异度不佳,而将MRI、TRUS与PSA联合有望进一步提高诊断效能。当然本研究样本量较小,且为单中心、前瞻性研究,对MRI与TRUS联合靶向穿刺准确性及相关并发症的预防方面未涉及,后期值得进一步深入分析。
综上所述,MRI、TRUS联合血清PSA诊断PCA效果较好,可明显提高诊断灵敏度、特异度,有推广价值。

