能谱CT多参数成像在肾透明细胞癌病理分级中的应用价值
郭君君 姜 伦 胡必富 江广斌
湖北医药学院附属随州医院放射科(湖北 随州 441300)
肾细胞癌是肾脏发生最多的一类恶性肿瘤,其在成年女性、男性中的占比各是3%、5%,16%左右的病人确诊时已出现转移,发病率和死亡率较高[1]。在肾癌众亚型中,肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)最为常见,约占病例的75%[2],其可通过诸多方法来治疗,诸如根治性切除术、射频消融术、肾部分切除术。针对初期低级别的ccRCC病人,建议采取部分肾切除术,能够提高其生存率与生活质量(QOL),缩短住院天数,减少术后并发症,具有较好预后[3-4]。许多因素影响RCC患者预后,包括核分级、分期、分型与手术切缘阳性等皆被证实属于本病独立预后因子,并在COX风险评估中发现核分级是影响患者出院的重要因素[5]。本研究通过对比分析ccRCC的常规CT表现及能谱CT相关参数,探索各参数在ccRCC病理分级中的诊断价值以及常规CT征象是否有助于提高ccRCC的检出率及诊断准确性,为临床治疗及患者预后评估提供有效的指导。
1 资料与方法
1.1 一般资料搜集2018.06至2020.12期间在我院实施手术且由病理确诊的38名肾癌病人的资料,女、男各18例、20例,年龄最小26岁,最大73岁,平均年龄(58.13±8.8)岁,在Furhman分级方面,Ⅰ~Ⅱ级、Ⅲ~Ⅳ级各为28例、10例,所有病例均为单侧肾单发肿瘤。有18例临床未见明显症状、通过体检检出,有5例见血尿,8例见腰痛,5例见血尿+腰痛,1例表现为乏力、消瘦,1例确诊时已发生转移。
1.2 设备与方法通过GE Revolution CT扫描,病人呈仰卧位,扫描范围为从膈顶到髂前上棘,每例病人皆接受常规平扫、能谱CT皮质期与实质期扫描。参数设定:平扫设定120kvp的管电压,自动毫安秒。在增强扫描方面,选择能谱成像模式,设置管电压80/140kvp(0.5ms)迅速切换,探测器宽度0.625×64mm,管电流最大限设置为600mA,旋转速度1.0s/r,螺距0.984,重建层厚与层间距均为1.25mm。用团注法,通过肘静脉高压注射器注射350mg/mL对比剂(碘海醇),用量为65~70mL,流速3mL/s,腹主动脉(AA)监测触发阈值是100HU,肾脏皮质期与实质期各自于触发后25s、55s扫描。
1.3 能谱CT图像处理与数据测量向工作站输送图像数据,通过软件GSI Viewer进行图像后处理与数据测量。默认单能量图像为70kev,并完成椭圆形或圆形ROI(感兴趣区)的设置,范围大约80mm2,在避开血管、钙化、出血与坏死囊变的前提下,选择面积较大,密度较均匀且强化明显的区域。为了降低误差,各病灶于上下连续层面进行3次测量,将均值当做终值,尽量使皮质期与实质期每次测定的ROI面积一致,同时处于同一部位、相同层面。对以下数据展开测量:(1)标准化碘浓度(NIC),此值为肿瘤碘浓度与同层AA碘浓度之比;(2)70kev单能量CT值;(3)能谱曲线斜率k,k=(CT40kev-CT90kev)/50;(4)有效原子序数(effective atomic numbers,Zeff)。
1.4 常规CT影像征象分析在科室两位资深医师的指导下对常规CT图像进行阅片,采用双盲法分析低级别和高级别ccRCC的常规CT表现,涉及病灶形态、大小、有无坏死与钙化、有无肾盂或肾周脂肪侵犯、肾静脉(RV)或下腔静脉(IVC)产生瘤栓与否。
1.5 统计学方法通过SPSS 25.0及MedCalc18.0软件进行统计分析,呈正态分布的计量数据用均数±标准差表示,基本信息及常规CT征象采用χ2检验(也可为Fisher确切概率法)进行统计学分析;能谱CT数据比较采用独立样本t检验及ROC曲线分析。用ROC(受试者工作特征曲线)分析差异具统计学意义的能谱参数的诊断作用,同时计算出AUC(ROC曲线下面积)、最佳诊断效能参数与阈值、敏感度及特异度。
2 结 果
2.1 低级别和高级别ccRCC在皮质期和实质期的能谱CT参数比较及ROC曲线分析具体见表1~表2。
低级别ccRCC皮质期、实质期的70kev能量CT值、NIC值能谱曲线斜率k及有效原子序数Zeff均大于高级别ccRCC,且表现出显著区别(P<0.05),见表1和图1~图2。ROC曲线分析显示,当NIC值为0.28时,鉴别低、高级别ccRCC的AUC最大(图3),诊断敏感度、特异度分别为85.71%、70%,见表2。
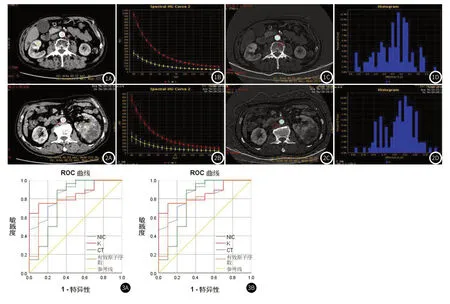
图1 A~图1D 男,63岁,右ccRCC II级。皮质期:A.70kev单能量CT值为115.25Hu;B.皮质期碘基图示NIC值为0.34mg/mL;C.能谱曲线图示K为5.2;D.有效原子序数Zeff为9.55。图2 A~图2D 男,66岁,左ccRCC III-IV级。皮质期:A.70kev单能量CT值为95.98Hu;B.碘基图示NIC值为0.21mg/mL;C.能谱曲线图示K为3.8;D.有效原子序数Zeff为9.25。图3 高、低级别ccRCC的不同能谱参数的ROC曲线示意图(图3A、图3B图分别指皮质期、实质期)

表1 低级别和高级别ccRCC皮质期及实质期能谱CT多参数比较
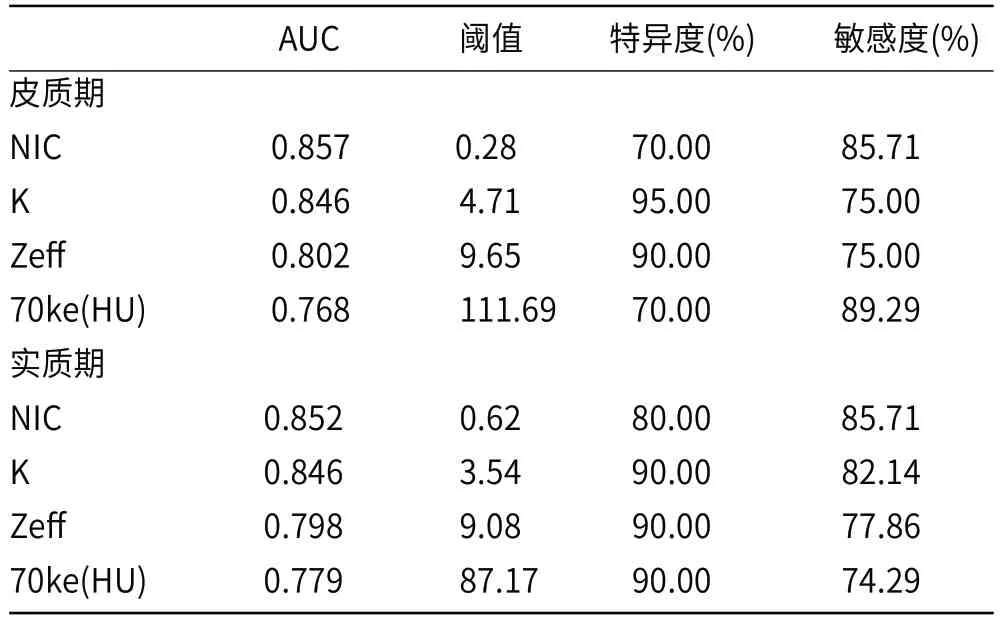
表2 能谱CT参数鉴别低级别和高级别ccRCC的ROC曲线分析
2.2 低级别和高级别ccRCC的基本信息及CT征象的分析在肿瘤最大径、肾盂(或肾周)侵犯等方面,低、高级别ccRCC表现出显著区别(P<0.05)
3 讨 论
在影像技术不断发展、人类生活水平不断提升下,无症状肾癌病人的检出率日渐提升。本研究中,大概50%的病人在体检时被发现而接受入院治疗。目前,CT是ccRCC最常用的影像学检查方法,ccRCC为富血供肿瘤,常伴囊变、出血及坏死,增强扫描皮质期不均匀强化表现明显,实质期强化水平下降,表现为“快进快出”[6]。将CT表现与临床病史相结合可以为大多数ccRCC作出准确诊断,然而,在对ccRCC病理分级评估方面,传统CT存在很大不足,能谱CT参数的定量分析比传统CT图像定性分析的特异度和敏感度更高[7]。
在肾癌分级系统中,Fuhrman核分级的应用最广泛,基于肿瘤细胞核大小、形态分为Ⅰ~Ⅳ级。为了提高可重复性,同时增加客观评估标准,制定出WHO/ISUP病理分级系统(2016版),将Fuhrman Ⅰ~Ⅱ级分为高分化组,Fuhrman Ⅲ~Ⅳ级分为低分化组[8]。核分级和肾癌预后存在紧密联系,分级愈高,预后愈差,临床干预方案也存在区别。低级别ccRCC建议采取肾部分切除术,相对于肾根治性切除术,不仅可使术后并发症减少,同时可获得理想疗效,且相关实验发现,核分级呈Ⅰ、Ⅱ、Ⅲ~Ⅳ级的肾癌病人五年生存率依次达95.9%、86.8%、60.1%[4,9]。因此,术前评估ccRCC的恶性程度对临床手术的选择及患者预后具有重要意义。
近年来,能谱CT多参数成像在临床广泛应用,能谱CT可以进行碘定量分析,通过检测肿瘤中的碘浓度分布,从而间接反映肿瘤内微循环情况[10]。先前大量研究表明与常规增强CT相比,能谱CT碘定量分析能更准确地区分良性病变与恶性病变[11-13],但将能谱CT多参数定量分析用于ccRCC分级的研究比较少。此项研究中,分析了能谱CT碘定量参数在低、高分化组ccRCC的碘浓度区别。Dai C等学者[14]对肿瘤强化最明显部位、肿瘤最大截面、整个肿瘤体积的碘浓度分别进行测量,对比这三种途径在鉴别肾癌亚型方面的区别,结果显示,ROI最适区域为肿瘤强化最突出的部位,所以此项研究中,将肿瘤实性成分最多且强化最突出的部位作为ROI。为避免个体循环差异、对比剂浓度等因素影响到碘浓度值,将同层AA碘浓度当做基准,得到相应NIC值,但是学者赵娜[15]等发现很多中老年人肾动静脉常会发生钙化,将同层肾实质碘浓度当做基准,可以更为有效地减小肾灌注所导致的差异,但此项研究排除了肾动脉明显钙化、狭窄的病例。结果表明在皮质期及实质期,高分化组ccRCC的NIC均大于低分化组,且差异具有统计学意义。我们的数据再次验证了Zhang CL等学者[16]先前的研究成果,通过双源CT扫描,低级别ccRCC的NIC值相较高级别组偏高。这可能是因为低级别组肿瘤存在较多的成熟血管,血流速度快,同时血管具备较好的通透性,造影剂易于进入肿瘤组织,高级别组肿瘤恶性程度较高,生长迅速,导致血管迂曲扩张而产生动静脉短路,此外肿瘤血管高渗透性使得血液粘滞度、间质渗透压增高,这些皆会使肿瘤灌注减低并出现不均匀的血流,最终仅有少量造影剂进入肿瘤[17-19],所以,相较于高级别ccRCC,低级别的碘摄取量更多。
能谱曲线能够体现物质的CT值在不同X线能量下的吸收特性,物质不同,能谱曲线有所区别,对肿瘤的定性、定位及分级有所帮助[20]。相关研究显示,皮质期与实质期的CT值与kev呈负相关,形态变化最大时对应的能量段为40~90kev。所以,此项研究确定以此能量范围下的CT值来计算能谱曲线斜率。结果显示,在皮质期与实质期,低分化组ccRCC的能谱曲线斜率均小于高分化组,这与以往相关研究结果相符[21]。出现该结果的原因与不同分化程度的ccRCC病理学特点有关,肿瘤分级越高,血供越差,造影剂进入少,能谱曲线斜率小。
有效原子序数所指为某化合物(或混合物)原子核所含质子数,确定了Z就确定了该物质。通常通过有效原子序数来鉴别泌尿系结石成分。这些年,有很多学者开始对有效原子序数在肿瘤的应用产生兴趣,李健文等[22]对有效原子序数在肾癌分型方面的应用进行探索,他们发现在双能量CT有效原子序数(Z)上,ccRCC较nccRCC(非透明细胞癌)偏大。Mileto A等学者[23]分析了有效原子序数在增强、非增强肾脏病变的应用情况,发现肾癌的有效原子序数较肾囊肿更大。由于低级别肿瘤血管成熟,进入肿瘤的碘对比剂较多,而在测量病灶内碘含量方面,有效原子序数可能更具直接性,此项研究结果显示,低级别ccRCC的有效原子序数大于高级别ccRCC,与先前的学者研究一致。
不同分化程度的ccRCC的CT征象有所不同,本研究结果显示,在肿瘤最大径、肾盂(或肾周)脂肪侵犯方面,高、低分化组存在显著区别,此发现支持早期的研究成果,高级别ccRCC肿瘤具备更大的直径,累及肾实质周围的几率更高[24-25],与高级别肿瘤血管中内皮生长因子表达上调可能相关,即在肿瘤Fuhrman分级增加的同时,恶性程度愈高,长速愈快,侵袭活性愈强[19]。Wei JY等学者[7]通过二元Logistic回归分析表明坏死和ccRCC病理学分级存在联系,但本研究对象中73%患者发生了坏死,认为高、低分化组在此方面不存在明确区别,可能与研究涉及的肿瘤体积偏大,血供不足相关。
本研究中,经ROC曲线分析发现,皮质期70kevCT值、NIC值、能谱曲线斜率及有效原子序数区分高分化组与低分化ccRCC的诊断效能更高,诊断效能最好的是皮质期NIC值,此时对应的AUC为0.857,阈值为0.28,得到的敏感度为85.71%、特异度为70%。本次研究中有1名高级别ccRCC病人因NIC值为0.48被错误归为高分化组,但结合肿瘤直径较大,且见肾周受累等CT征象最终准确分类,所以,能谱CT定量分析与CT征象相结合可以对高、低分化组ccRCC做出更为准确的诊断。有学者[7]应用双源CT研究表明鉴别高、低分化组ccRCC的最适定量参数是皮质期能谱曲线斜率k,且最佳NIC阈值为0.35,两项研究的不同可能是受到了所用设备、扫描参数不同的影响。
本研究证实,能谱CT的70kev单能量CT值、NIC值、能谱曲线斜率及有效原子序数可以作为评估ccRCC生物学行为的指标,尤其是NIC值,有助于临床治疗及预后评估。但本研究样本量有限,仅有极少数的研究涉及有效原子序数在肾肿瘤的应用,需要更大样本量进一步验证。

