四神丸对溃疡性结肠炎模型大鼠结肠组织TLR4、NOD2 表达的影响
何兰娟,邓渊,王燕,3,朱向东,3*
(1.甘肃中医药大学,兰州 730101;2.甘肃省人民医院,兰州 730000;3.宁夏医科大学,银川 750004)
溃疡性结肠炎是一种病因尚不明确的慢性非特异性炎性肠病,且发病率逐年増长。 目前UC 的发病机制多认为与免疫因素相关[1]。 固有免疫作为人体第一道机体防御感染性防线,它的启动和实施主要依靠模式识别受体(pattern recognition receptors,PRRs) 识别病原体相关分子模式(pathogen associated molecular pattern,PAMP)。 而哺乳动物中的最典型的两类PRRs 为TOLL 样受体(Toll-like receptors,TLRs)和核苷酸结合寡聚化结构域受体( nucleotide-binding domain leucine-rich repeats,NLRs)[2]。
目前临床多采用糖皮质激素、免疫抑制剂等免疫疗法,但是疗效不稳定,所以急需寻找一种新的特异性疗法[3-4]。 近年来,中医药在治疗UC 和缓解UC 症状等方面优势明显[5]。 四神丸之名首载于《陈氏小儿痘疹方论》,临床研究发现其对UC 具有良好的治疗作用,本课题通过对比四神丸治疗UC大鼠后结肠组织中的TLR4、NOD2 的表达变化,进一步明确其治疗UC 的机制,为进一步开发利用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
6 ~ 8 月龄体重为(180 ± 20)g 的SPF 级Wistar大鼠40 只(雌雄各20 只),饲养于温度21 ~ 25℃,相对湿度50% ~ 60%,光照昼夜交替各12 h 的环境中,饮水自由,普通饲料喂养。 实验用鼠购买和喂养均在甘肃中医药大学实验动物中心进行【SCXK(甘)2020-0001】【SYXK(甘)2020-0009】。 本实验符合甘肃中医药大学实验动物伦理会审查要求(2018-081)。
1.1.2 主要试剂与仪器
四神丸(补骨脂、肉豆蔻、五味子、吴茱萸)、柳氮磺胺嘧啶肠溶片均购自于兰州惠仁堂大药房,生产 批 号 分 别 为 20140502、 1412001、 20140812、20140822、09140703。 四神丸制备浓缩为1 g/mL 的药液;柳氮磺胺嘧啶肠溶片研磨后制成浓度为0.025 g/mL 的药液。 所有药品均于4℃保存。
2,4,6-三硝基苯磺酸/TNBS(美国Sigma 公司,批号2508-19-2);PCR 试剂盒(Promega Corporation公司);PCR 引物(生工生物工程股份有限公司);Anti-TLR4 antibody、Anti-NOD2 antibody(abcam 公司,批号ab13556、ab124348);BCA 蛋白定量试剂盒(北京索莱宝科技有限公司,批号:1431401);DAB显色试剂盒、SP 检测试剂盒(中杉金桥生物技术有限公司,批号K156921A、15155A06)等。
iMark 酶标仪、S1000TM型PCR 仪、凝胶成像仪、电泳仪电源、电泳槽(美国Bio-Rad 公司);7500 实时定量PCR 仪(美国ABI 公司);XS-212-202 双目显微镜(日本奥林巴斯公司);冷冻离心机(中国上海天美生化仪器设备有限公司)等。
1.2 方法
1.2.1 造模及分组
将40 只SPF 级Wistar 大鼠随机分为空白组、模型组、西药组、四神丸组,每组10 只。 将大鼠喂养1 周后,除空白组外,用三硝基苯磺酸(TNBS)/乙醇溶液灌肠(100 mg/kg)缓慢注入结肠部位制备UC大鼠模型[6]。
1.2.2 给药与取材
给药剂量按照人与大鼠体表系数折算法计算[7],空白组和模型组以等体积生理盐水灌胃,柳氮磺胺嘧啶组用SASP 溶液0.36 g/(kg·d)灌胃治疗,中药组用四神丸5 g/(kg·d)灌胃治疗。 共计干预21 d。 治疗结束后,取动脉血及结肠组织备用。
1.2.3 肉眼观察大鼠结肠粘膜损伤及进行损伤评分
将大鼠处死后取结肠病变部分,洗净后观察大鼠结肠粘膜损伤情况,并参考Wallace & Keenan 标准[8]进行评分(见表1)。

表1 结肠粘膜损伤评分表Table 1 Colonic mucosal injury score
1.2.4 HE 染色法观察大鼠结肠病理组织变化
采用苏木素-伊红染色法染色,将结肠组织玻片放置在显微镜下观察大鼠结肠病理学改变,并拍照分析。
1.2.5 RT-qPCR 法检测大鼠结肠组织中TLR4、NOD2 mRNA 的表达
采用TRIzol 法提取RNA 后,按照Go Taq 2-Step RT-qPCR System 试剂盒说明书进行操作,逆转录为cDNA。 运用PCR 仪进行扩增,具体配置比例按照Reverse Transcription System 试剂盒说明进行。 采用ΔCt 法计算基因的相对表达量,TLR4、NOD2 引物信息见表2。

表2 引物信息Table 2 Information of primers
1.2.6 SP 免疫组化法检测大鼠结肠组织中TLR4、NOD2 蛋白的表达
将切片放入二甲苯及乙醇溶液中脱蜡水化,灭活内源性过氧化物酶后进行抗原修复,滴加封闭用正常山羊血清工作液阻断非特异性反应,加入一抗TLR4(1 ∶200),NOD2(1 ∶400),再滴加生物素标记山羊抗兔/小鼠IgE 及滴加辣根酶标记链霉卵白素工作液,最后DAB 显色、复染、脱水透明封片分析其平均光密度值。
1.2.7 Western Blot 检测TLR4、NOD2 蛋白的表达
蛋白提取后,电泳跑胶转膜封闭后,加入一抗TLR4 ( 1 ∶ 500), NOD2 ( 1 ∶ 2000), β-actin(1 ∶1000),37℃孵育30 min,4℃过夜;加入二抗(1 ∶5000)。 曝光后进行分析。
1.3 统计学分析
结果采用SPSS 19.0 软件处理,数据均以平均值± 标准差(±s)表达,多组间均数比较采用单因素方差分析,P< 0.05 表示组间比较具有显著性差异。
2 结果
2.1 大鼠结肠粘膜损伤情况
空白组大鼠结肠粘膜光滑,未见充血、溃疡等情况;模型组大鼠结肠可见不同程度粘膜充血,部分可见水肿糜烂溃疡,肠壁增厚;柳氮磺胺嘧啶组和中药组大鼠结肠可有不同程度恢复,轻度充血水肿,基本无糜烂及溃疡面。 模型组结肠组织损伤评分较空白组明显升高(P< 0.01),柳氮磺胺嘧啶组和四神丸组结肠组织损伤评分较模型组明显降低(P< 0.05,P< 0.01)(见表3)。
表3 各组症状积分及结肠肉眼评分表(±s,n = 10)Table 3 Symptom score and macroscopic colon score of each group(±s,n = 10)
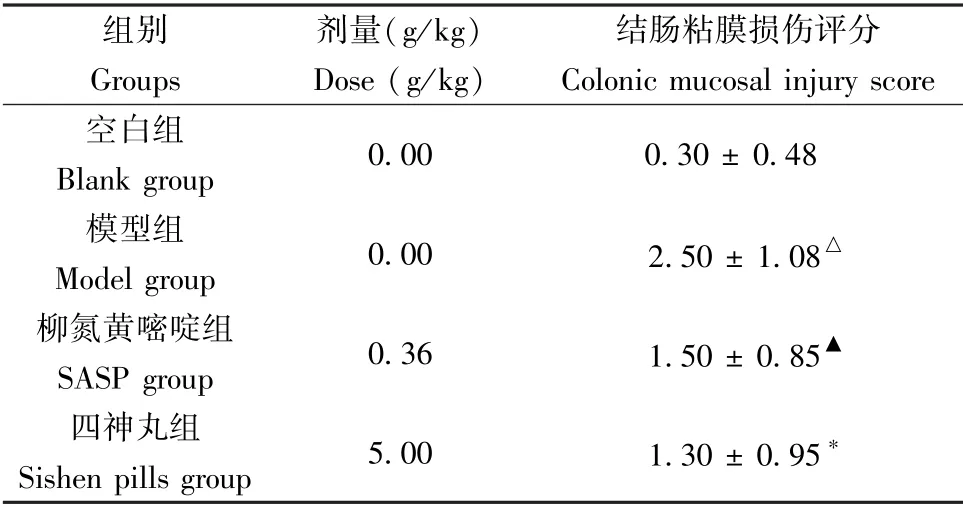
表3 各组症状积分及结肠肉眼评分表(±s,n = 10)Table 3 Symptom score and macroscopic colon score of each group(±s,n = 10)
注:与空白组相比,△P < 0.01;与模型组相比,*P < 0.01,与柳氮磺嘧啶组相比,▲P < 0.05。 (下表同)Note. Compared with the blank group, △P < 0.01. Compared with the model group, *P < 0.01. Compared with the SASP group,▲P < 0.05.(The same in the following tables)
组别 剂量(g/kg) 结肠粘膜损伤评分Groups Dose (g/kg) Colonic mucosal injury score空白组Blank group 0.00 0.30 ± 0.48模型组Model group 0.00 2.50 ± 1.08△柳氮黄嘧啶组SASP group 0.36 1.50 ± 0.85▲四神丸组Sishen pills group 5.00 1.30 ± 0.95*
2.2 大鼠结肠病理形态学观察
空白组大鼠结肠黏膜结构清晰无异常;模型组结肠组织结构被破坏,可见大量炎性细胞浸润并伴有溃疡;柳氮磺胺嘧啶组和四神丸组结肠粘膜逐步恢复正常结构,炎性细胞浸润情况较模型组减轻,可见肠壁增厚及肉芽组织增生(见图1)。
2.3 对大鼠结肠组织TLR4、NOD2 mRNA 的影响
模型组大鼠结肠组织中TLR4、NOD2 mRNA 表达水平较空白组明显上升(P< 0.01);柳氮磺胺嘧啶组和四神丸组结肠组织中TLR4、NOD2 mRNA 表达水平较模型组明显降低(P< 0.05,P< 0.01)(见表4)。
表4 各组大鼠结肠组织中TLR4、NOD2 mRNA 的表达(±s,n = 10)Table 4 Expression of TLR4 and NOD2 mRNA in colon tissue of rats in each group(±s,n = 10)
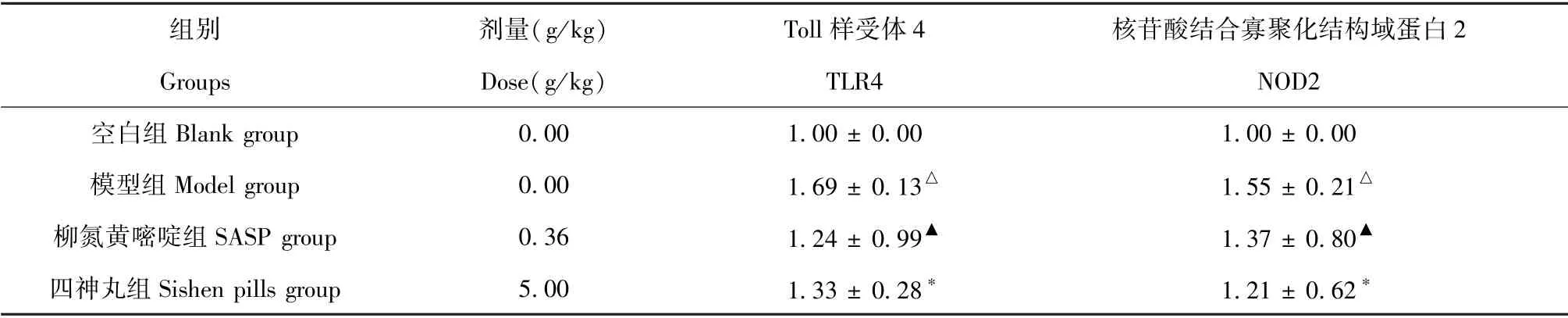
表4 各组大鼠结肠组织中TLR4、NOD2 mRNA 的表达(±s,n = 10)Table 4 Expression of TLR4 and NOD2 mRNA in colon tissue of rats in each group(±s,n = 10)
组别 剂量(g/kg) Toll 样受体4 核苷酸结合寡聚化结构域蛋白2 Groups Dose(g/kg) TLR4 NOD2空白组Blank group 0.00 1.00 ± 0.00 1.00 ± 0.00模型组Model group 0.00 1.69 ± 0.13△ 1.55 ± 0.21△柳氮黄嘧啶组SASP group 0.36 1.24 ± 0.99▲ 1.37 ± 0.80▲四神丸组Sishen pills group 5.00 1.33 ± 0.28* 1.21 ± 0.62*
2.4 对大鼠结肠组织TLR4、NOD2 蛋白定位的影响
TLR4 和NOD2 在空白组中基本不表达,在模型组中的黏膜上层和固有层中表达明显增多,经治疗后,表达明显降低。 模型组结肠组织中TLR4、NOD2蛋白表达水平较空白组明显升高(P< 0.05);氮磺胺嘧啶组和四神丸组结肠组织中TLR4、NOD2 蛋白表达水平较模型组明显下降(P< 0.05,P< 0.01)(见图2,表5)。
表5 各组大鼠结肠组织中TLR4、NOD2 蛋白表达(±s,n = 10)Table 5 Expression of TLR4 and NOD2 protein in colon tissue of rats in each group(±s,n = 10)
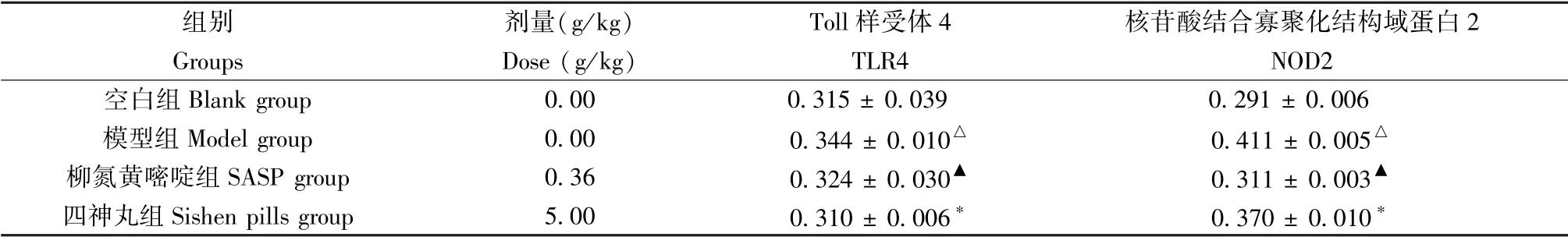
表5 各组大鼠结肠组织中TLR4、NOD2 蛋白表达(±s,n = 10)Table 5 Expression of TLR4 and NOD2 protein in colon tissue of rats in each group(±s,n = 10)
组别 剂量(g/kg) Toll 样受体4 核苷酸结合寡聚化结构域蛋白2 Groups Dose (g/kg) TLR4 NOD2空白组Blank group 0.00 0.315 ± 0.039 0.291 ± 0.006模型组Model group 0.00 0.344 ± 0.010△ 0.411 ± 0.005△柳氮黄嘧啶组SASP group 0.36 0.324 ± 0.030▲ 0.311 ± 0.003▲四神丸组Sishen pills group 5.00 0.310 ± 0.006* 0.370 ± 0.010*
2.5 对UC 大鼠结肠组织TLR4 与NOD2 蛋白表达的影响
与空白组比较,模型组大鼠结肠组织中TLR4、NOD2 蛋白表达水平明显上升(P< 0.01);氮磺胺嘧啶组和四神丸组大鼠结肠组织中TLR4、NOD2 蛋白表达水平较模型组明显下降(P< 0.01)(见图3,表6)。
表6 各组大鼠结肠组织中TLR4、NOD2 蛋白的相对表达量 (±s,n = 10)Table 6 Relative expression of TLR4 and NOD2 proteins in colon of rats in each group(±s,n = 10)

表6 各组大鼠结肠组织中TLR4、NOD2 蛋白的相对表达量 (±s,n = 10)Table 6 Relative expression of TLR4 and NOD2 proteins in colon of rats in each group(±s,n = 10)
组别 剂量(g/kg) Toll 样受体4 核苷酸结合寡聚化结构域蛋白2 Groups Dose(g/kg) TLR4 NOD2空白组Blank group 0.00 0.459 ± 0.079 0.643 ± 0.237模型组Model group 0.00 0.920 ± 0.032△ 1.045 ± 0.186△柳氮黄嘧啶组SASP group 0.36 0.808 ± 0.077▲0.859 ± 0.107▲四神丸组Sishen pills group 5.00 0.751 ± 0.049* 0.825 ± 0.029*
3 讨论
UC 属于中医学中“泄泻”的范畴,若先天禀赋不足,则会导致肾阴阳之亏虚,继而导致脾失濡养,脾肾亏虚最终运化无能导致泄泻,所以UC 的发病多与脾肾密切相关,而脾肾阳虚又进一步助长了湿气的产生,因此“阳虚湿盛”为UC 发生的重要病机。四神丸由肉豆蔻、五味子、补骨脂、吴茱萸、生姜、大枣组成,适用于由脾肾虚寒所致的肠失固摄之证。诸药相配,则脾肾温则运化复,大肠固而泄可止。
TLR4 作为人类首个发现的TLR 相关蛋白,广泛存在于人体的各类细胞中,是参与免疫炎症反应的重要因子[9],TLR 与内源性配体结合后触发炎症,产生免疫应答。 NF-κB 是位于TLR4 的下游信号通路,大量的研究显示TLR4/NF-κB 信号通路与抗炎免疫机制密切相关,在炎症发生发展过程中发挥着重要作用[10]。 近年来,相关研究在肠粘膜上皮细胞中也发现TLR4 的存在,并证明其在减轻肠道损伤方面具有重要意义[11]。
NOD2 作为一种细胞内模式识别受体,通过与其配体MDP 相结合,主要存在于单核细胞、巨噬细胞、淋巴细胞等[12]。 正常情况下,NOD2 通过NF-κB信号通路激活其下游的各种炎症介质,从而介导机体的炎症反应[13]。 有研究显示NOD2 在识别和杀灭细菌功能方面有密切的联系,提示NOD2 可能还有直接杀菌的作用[14]。 另外,有研究显示,NOD2基因突变可以导致肠道屏障受损,使得肠道杀菌能力降低, 引起致病菌侵入并导致相关炎症反应[15-16]。
因此,Toll 样受体和NOD 样受体作为启动固有免疫,激活免疫应答的重要因子,在免疫反应中有着至关重要的作用。 本研究结果显示,模型组中TLR4 和NOD2 含量明显增高,经四神丸治疗后,TLR4 和NOD2 含量明显降低,提示四神丸可以提高大鼠的免疫功能,抑制炎症反应,修复大鼠肠道屏障,达到治疗UC 的目的。
参 考 文 献(References)
[ 1] Liu ZJ, Yadav PK, Su JL, et al. Potential role of TH17 cells in the pathogenesis of inflammatory bowel disease [J]. World J Gastroenterol, 2009, 15(46): 5784-5788.
[ 2] 饶振华, 谢小梅. NODs 蛋白及其与TLRs 相互调控在机体抗病原真菌感染中的作用 [J]. 中华微生物学和免疫学杂志,2012, 32(3): 281-285.Rao ZH, Xie XM. The role of NODs proteins and their interaction with TLRs in the body’s resistance to fungal infection[J]. Chin J Microbiol Immunol, 2012, 32(3): 281-285.
[ 3] 冉志华, 童锦禄. 炎症性肠病诊断与治疗的共识意见(2018年, 北京)克罗恩病部分解读 [J]. 中华消化杂志, 2018, 38(5): 315-317.Ran ZH, Tong JL. Interpretation of the consensus on diagnosis and management of inflammatory bowel disease(Beijing, 2018)from the perspective of diagnosis of Crohn’s disease [J]. Chin J Dig, 2018, 38(5): 315-317.
[ 4] Guo BJ, Bian ZX, Qiu HC, et al. Biological and clinical implications of herbal medicine and natural products for the treatment of inflammatory bowel disease [J]. Ann N Y Acad Sci, 2017, 1401(1): 37-48.
[ 5] 顾思臻, 薛艳, 张玉丽, 等. 口服中药复方治疗溃疡性结肠炎临床疗效Meta 分析 [J]. 中国中西医结合消化杂志,2018, 26(12): 981-986.Gu SZ, Xue Y, Zhang YL, et al. Meta-analysis of the efficacy of oral traditional chinese medicine in the treatment of ulcerative colitis [J]. Chin J Integr Tradit West Med Dig, 2018, 26(12):981-986.
[ 6] 梁勇, 颜丽萍, 苏林, 等. 枯草杆菌二联活菌对溃疡性结肠炎大鼠的作用及机制 [J]. 中国老年学杂志, 2017, 37(1):27-29.Liang Y, Yan LP, Su L, et al. Effect and mechanism ofBacillus subtilison rats with ulcerative colitis [J]. Chin J Gerontol,2017, 37(1): 27-29.
[ 7] 赖慧敏, 黄敏聪, 楼招欢, 等.天台乌药对TNBS 诱导的溃疡性结肠炎模型大鼠的抗炎作用研究 [J]. 中国比较医学杂志, 2021, 31(2): 37-44.Lai HM, Huang MC, Lou ZH, et al. The effect of Tiantai Radix Linderae on a rat model of ulcerative colitis induced by TNBS[J]. Chin J Comp Med, 2021, 31(2): 37-44.
[ 8] Wallace JL, Keenan CM. An orally active inhibitor of leukotriene synthesis accelerates healing in a rat model of colitis [J]. Am J Physiol, 1990, 258(4): G527-G534.
[ 9] 郭晓强. Toll 受体的发现及其意义 [J]. 生物学教学, 2012,37(3): 59-60.Guo XQ. Discovery of toll like receptor and its significance [J].Biol Teach, 2012, 37(3): 59-60.
[10] 王娜, 张雪梅, 陈立杰. TLR4 信号通路与炎症相关性疾病[J]. 中国实验诊断学, 2015, 19(5): 857-860.Wang N, Zhang XM, Chen LJ. TLR4 signaling pathway and inflammation related diseases [J]. Chin J Lab Diagn, 2015, 19(5): 857-860.
[11] 于志坚. 溃疡性结肠炎菌群变化对肠上皮细胞TLRs 表达影响 [D]. 乌鲁木齐: 新疆医科大学; 2016.Yu ZJ. Effect of bacterial flora of ulcerative colitis on the expression of TLRs in intestinal epithelial cells [D]. Urumqi:Xinjiang Medical University; 2016.
[12] 高其宏, 芮景. 细胞内模式识别受体NOD2 蛋白的研究进展[J]. 放射免疫学杂志, 2008, 21(5): 432-434.Gao QH, Rui J. Research progress of intracellular pattern recognition receptor NOD2 protein [J]. J Radioimmunol, 2008,21(5): 432-434.
[13] Inohara N, Ogura Y, Chen FF, et al. Human nod1 confers responsiveness to bacterial lipopoly-saccharides [J]. Biol Chem,2001, 276(4): 2551-2554.
[14] Hismatsu T, Suzuki M, Reinecker HC, et al. CARD15/NOD2 functions as an antibacterial factor in human intestinal epithelial cells [J]. Gastroenterology, 2003, 124(4): 993-1000.
[15] Kim YG, Shaw MH, Warner N, et al. Cutting edge: Crohn’s disease-associatedNod2mutationlimitsproductionof proinflammatory cytokines to protect the host fromEnterococcus faecalis-induced lethality [J]. J Immunol, 2011, 187(6): 2849-2852.
[16] Ferreira CM, Vieira AT, Vinolo MAR, et al. The central role of the gut microbiota in chronic inflammatory diseases [J]. J Immunol Res, 2014, 2014: 1-12.

