探讨不同浓度Matrigel 对小鼠Lewis 肺癌异位皮下移植瘤的影响
邢淑雁,晋一帆,王含雪,孙竹筠,孙启慧,刘孝云,叶冬雪,宫宁远,李正昊,杨勇*,容蓉,3*
(1.山东中医药大学药学院,济南 250355;2.山东中医药大学实验中心,济南 250355;3.山东省高校中医药抗病毒协同创新中心,济南 250355;4.山东省中医药抗病毒工程研究中心,济南 250355)
目前,肺癌动物模型的构建方法有异位移植法、原位移植法、化学诱导法等[1-4]。 其中,异位皮下移植是将体外培养的肿瘤细胞移植到动物身上与肿瘤原发部位不相关的部位。 由于其操作简单方便、实验周期短、可复制性强以及易于观察等特点,故成为肺癌实验研究中动物造模最常用的方法[5]。 但由于肿瘤细胞脱离了体外培养条件而进入体内,生长环境发生改变,加之实验人员操作误差、动物个体差异等因素,易导致成瘤率、肿瘤大小均不稳定,使该造模方法的应用受到局限。 因此,找到一种优化并稳定该造模方法的解决方案意义重大。 研究发现,近年来基质胶越来越多的应用于构建小鼠异位皮下移植瘤模型。 Matrigel 基质胶来源于Engelbreth-Holm-Swarm(EHS)小鼠肉瘤的基底膜基质,其主要成分有层粘连蛋白、Ⅳ型胶原、巢蛋白、硫酸肝素糖蛋白,还包含基质金属蛋白酶和各种细胞因子[6-7]。 这是一种4℃时呈液体状态,22 ~35℃时迅速凝胶,以固态形式存在形成交联网络,从而使细胞分散均匀,聚合形成具有生物学活性的三维基质[8]。 基质胶作为一种辅助物质,可为肿瘤细胞的侵袭、迁移、管腔结构的形成及细胞的生化功能等提供有利的生存条件,更好的模拟了肿瘤细胞的体内生长环境,从而提高了肿瘤细胞在体内成瘤的比例和速度[9-10]。
尽管基质胶在稳定成瘤率及提高肿瘤生长速度方面优势明显,但其应用的适宜浓度尚未明确,因此,本研究旨在探讨Matrigel 浓度对小鼠Lewis 肺癌异位皮下移植瘤成瘤的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级C57BL/6J N 雄性小鼠24 只,4 周龄,体重17 ~ 19 g,购于北京维通利华实验动物技术有限公司【SCXK(京)2021-0006】;饲养于山东省高校中医药抗病毒协同创新中心【SYXK(鲁)2017-0022】。经适应性喂养3 d 后,按体重随机分为4 组,分别为肺癌组、50%基质胶组、75%基质胶组、100%基质胶组,每组各6 只。 饲养期间小鼠自由饮食和饮水,灯光12 h 循环,室温维持在22 ~ 25℃,湿度40% ~60%。 本实验所有操作已通过山东中医药大学实验动 物 福 利 伦 理 审 查 委 员 会 的 批 准(SDUTCM20211123001)。
1.1.2 细胞
LLC 小鼠肺癌细胞(CL-0140),购于武汉普诺赛生命科技有限公司,培养于山东省高校中医药抗病毒协同创新中心二级生物安全实验室,将细胞置于含10%胎牛血清、1%双抗的DMEM 完全培养基中,置于37℃、5% CO2培养箱中培养,每1 d 更换培养液1 次,每2 d 用0.25%胰酶消化传代1 次。
1.1.3 主要试剂与仪器
胎牛血清(BI 公司,以色列,批号:2022057);高糖DMEM 培养基(Gibco 公司,美国,批号8121488);青霉素-链霉素溶液(Gibco 公司,美国,批号:2321127);0.25%胰蛋白酶(Gibco 公司,美国,批号:2186956);1 × PBS 缓冲液(biosharp 公司,美国,批号:71012000);Matrigel 高浓度基质胶(BD 公司,美国,货号:354248);氯化钠注射液(青州尧王制药有限公司,批号:2220030305);异氟烷(深圳市瑞沃德生命科技有限公司,批号:21082101);75%乙醇消毒液(山东利尔康医疗科技股份有限公司,批号:210407)。
HF safe 1200LC 生物安全柜、HF-90 CO2培养箱(上海力申科学仪器有限公司);CKX41 倒置相差显微镜(日本奥林巴斯株式会社);TC20 细胞计数仪(美国Bio-Rad 公司);TDZ5-WS 医用离心机(湖南平凡科技有限公司);MP10001 型电子天平(上海舜宇恒平科学仪器有限公司);TC25H6 型独立通气笼IVC(苏州市苏杭科技器械有限公司;R550IE 小动物麻醉机(深圳市瑞沃德生命科技有限公司);250 μL 微量进样器(上海高鸽工贸有限公司);宠物局部剃毛器(宁波锐雷森电器有限公司)。
1.2 方法
1.2.1 Matrigel 基质胶的分装及处理
-20℃保存的基质胶冰浴条件下置于4℃冰箱过夜,待完全融化后将其置于超净台内,使用经无菌并提前预冷的1.5 mL EP 管、1 mL 枪头进行分装,每个EP 管装有基质胶体积为1 mL,分装后将其置于-20℃冰箱保存。 每次实验前,将分装冻存的Matrigel 基质胶从-20℃冰箱取出,冰浴条件下置于4℃冰箱解冻。 待完全融化后,进行后续实验。
1.2.2 构建Lewis 肺癌模型
待细胞汇合率达90%以上,吸弃旧细胞培养基,用PBS 缓冲液洗1 遍,加1 mL 0.25%胰酶消化1 min 左右,吹打,制成单细胞悬液。 1095 r/min 离心4 min 后,弃上清,加入生理盐水重悬细胞沉淀,使细胞充分悬浮于生理盐水中,并进行细胞计数,参照文献[11]方法并进行调整,配制浓度为4 × 107cells/mL 的细胞悬液,备用。 用pH=7.4 的PBS 稀释已完全解冻的基质胶,分别配制浓度为50%、75%和100%的基质胶溶液,将上述4 × 107cells/mL 密度的细胞悬液,与Matrigel 基质胶溶液按体积1 ∶1混匀,各制备1 mL 的混悬液,于SPF 级实验室备用,所有操作均在冰浴中进行。 对小鼠进行呼吸麻醉,将异氟烷麻醉剂量调为4、氧气流速调为3,小鼠麻醉后,对其右侧前肢腋下脱毛,并用75%乙醇消毒,用250 μL 无菌微量进样器吸取上述混悬液,按照每只100 μL,即每只小鼠注射约2 × 106个活细胞,于右侧前肢腋下处斜行入针,刺入皮下,形成圆形小皮丘,注射完按压入针点,缓慢出针。
1.2.3 动物一般情况观察
每天测量小鼠体重、饮食、饮水量,记录一般体征,包括自主活动、对外界刺激的反应、皮毛光泽情况和精神状态等。
1.2.4 肿瘤体积的测量
观察肿瘤形成情况,实体瘤形成后,每天用游标卡尺读取小鼠皮下肿瘤最大长径a(mm)和短径b(mm),根据瘤体体积计算公式:V(mm3)= 1/2 ab2,计算各组小鼠肿瘤体积变化。
1.2.5 肿瘤重量的记录
造模14 d 结束后,完整剥取瘤体,拍照并称重,比较各组小鼠实体瘤的重量。
1.2.6 HE 染色检测肿瘤组织病变情况
完整剥离肿瘤组织,立即切取大约5 mm 厚度的瘤块,放入4%多聚甲醛溶液中固定,常规制备石蜡包埋块,切片5 μm,常规HE 染色,封口片后,于光学显微镜下观察肿瘤组织形态。
1.3 统计学分析
运用SPSS 21.0 软件进行统计分析,各组数据在分析前进行正态性检验和方差分析,正态分布数据以平均值 ± 标准差(±s)表示,多组数据间的比较采用单因素方差分析,以P< 0.05 表示差异具有统计学意义。
2 结果
2.1 肿瘤细胞生长情况
Lewis 肺癌细胞放于倒置显微镜下观察,细胞形态正常,呈上皮细胞样,贴壁生长,多数呈圆形,少数呈梭形,外形完整,大小不一,排列不规则,生长状态良好。
2.2 一般情况检测结果
2.2.1 一般体征
造模前7 d,小鼠活泼好动,皮毛光亮顺滑,反应灵敏,精神状态良好。 造模8 d 后,随着肿瘤增长,部分小鼠出现行动迟缓,精神倦怠,皮毛失去光泽,形体消瘦,75%基质胶组和100%基质胶组小鼠因肿瘤体积较大,出现行动不便、疲乏无力等现象。
2.2.2 体重
肺癌组小鼠体重总体呈现缓慢上升趋势。 与肺癌组相比,自造模第2 天起,75%基质胶组小鼠体重显著升高(P< 0.05 或P< 0.01);自造模第10天起,100%基质胶组小鼠体重明显上升(P< 0.05或P< 0.01);50%基质胶组小鼠体重没有明显差异(P> 0.05)。 各组小鼠的体重变化趋势见图1。
2.2.3 平均日饮食量
造模前7 d,小鼠平均日饮食量维持在3 g 左右,造模第8 天后,小鼠平均日饮食量较前7 d 有所降低,与肺癌组相比,各基质胶组小鼠平均日饮食量没有明显变化。 小鼠平均日饮食量变化见图2。
2.2.4 平均日饮水量
各组小鼠平均日饮水量总体呈现上升趋势,与肺癌组相比,各基质胶组小鼠平均日饮水量无明显差异。 各组小鼠的平均日饮水量变化见图3。
2.3 肿瘤评价结果
2.3.1 成瘤率及肿瘤形态
与肺癌组相比,添加基质胶组的小鼠成瘤较早。 各基质胶组小鼠于接种肿瘤细胞第6 天、肺癌组小鼠于接种肿瘤细胞第7 天,在接种部位触及到质地较软的突起,随着时间的延长,肿块逐渐增大,成瘤率为100%。 与肺癌组相比,75%基质胶组和100%基质胶组的肿瘤形状较规则,大小较均匀。 各组小鼠肿瘤情况见图4。
2.3.2 肿瘤体积
与肺癌组相比,添加基质胶组的小鼠肿瘤生长速度较快。 接种肿瘤细胞第6 天,50%基质胶组、75%基质胶组、100%基质胶组于接种部位可见小突起,第7 天肺癌组小鼠于右侧前肢腋下可触及较软突起,自接种肿瘤细胞第8 天起,与肺癌组相比,75%基质胶组和100%基质胶组肿瘤增长迅速,体积显著增大(P< 0.05,P< 0.01);自接种肿瘤细胞第10 ~ 13 天,与肺癌组相比,50%基质胶组肿瘤体积明显增大(P< 0.05,P< 0.01)。 各组小鼠肿瘤体积增长结果见图5。
2.3.3 肿瘤重量
与肺癌组相比,添加基质胶组的小鼠肿瘤重量均有所增大,其中,75%基质胶组肿瘤重量最大,100%基质胶组次之,50%基质胶组最小;与肺癌组相比,75%基质胶组和100%基质胶组肿瘤重量增大具有显著性差异(P< 0.05)。 75%基质胶组小鼠的肿瘤变异系数最小,低于肺癌组,说明此基质胶浓度下的成瘤均一性最好。 各组小鼠肿瘤重量结果见表1。
表1 各组小鼠的肿瘤重量测定结果(±s,n = 6)Table 1 Tumor weight measurement results of mice in each group(±s, n = 6)
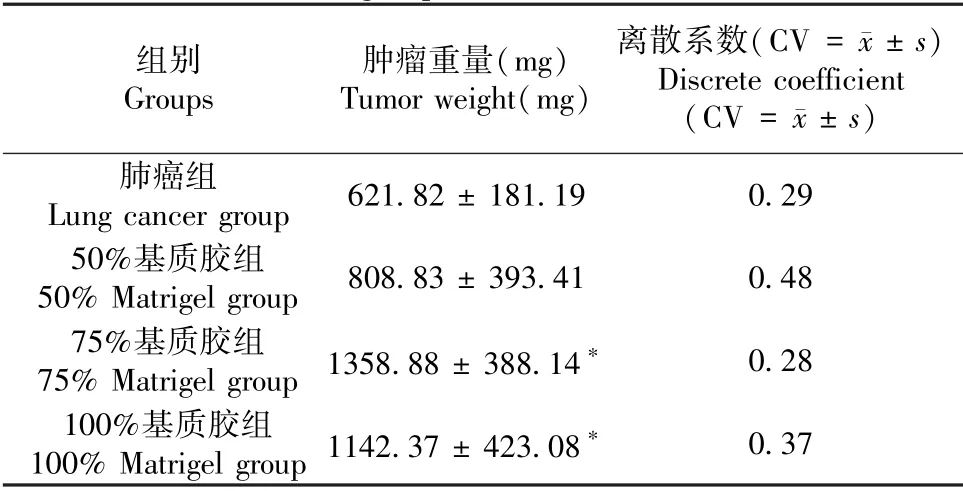
表1 各组小鼠的肿瘤重量测定结果(±s,n = 6)Table 1 Tumor weight measurement results of mice in each group(±s, n = 6)
组别Groups肿瘤重量(mg)Tumor weight(mg)离散系数(CV = images/000.png±s)Discrete coefficient(CV = images/000.png±s)肺癌组Lung cancer group 621.82 ± 181.19 0.29 50%基质胶组50% Matrigel group 808.83 ± 393.41 0.48 75%基质胶组75% Matrigel group 1358.88 ± 388.14* 0.28 100%基质胶组100% Matrigel group 1142.37 ± 423.08* 0.37
2.4 肿瘤组织病理学检查结果
肿瘤组织切片HE 染色观察,肺癌组的肿瘤细胞形状不规则,多呈圆形或椭圆形,细胞核大小不一,深染,异形性明显;50%基质胶组、75%基质胶组、100%基质胶组的肿瘤细胞轮廓清晰、核体积较大,分布密集,多呈现片状分布,细胞生长旺盛,随着基质胶浓度的增大,肿瘤组织间质中血管成分明显增多,细胞间有结缔组织浸润。 各组小鼠肿瘤组织病理切片结果见图6。
3 讨论
肺癌动物模型是人类研究肺癌的重要手段,建立合适的动物模型对肺癌的发生机制、诊断的研究及药物筛选具有十分重要的意义。 按照肿瘤细胞来源不同,小鼠肺癌模型主要分为自发性、诱发性、移植性和基因修饰等[12]。 其中,移植性肿瘤模型是目前应用最多的肿瘤模型。 移植性动物模型又可分为原位移植和异位移植。 异位皮下移植因其操作简单且易于观察成瘤情况,此建模方法已被广泛采用。 但也存在一定的局限性,异位皮下移植脱离了其起源组织器官的肿瘤微环境,需要克服肿瘤细胞由体外培养条件转入小鼠体内环境的不适应性而导致的成瘤率及肿瘤大小不稳定等问题。 因此,如何实现肿瘤细胞从体外培养到体内生长的过渡、稳定成瘤率及肿瘤生长的均一性,是肺癌动物模型研究亟待解决的问题。
近年来,Matrigel 已广泛应用于构建小鼠体内肿瘤模型。 研究发现,Matrigel 可以促进细胞分化,提高肿瘤细胞接种后的成瘤性[13]。 Matrigel 是从小鼠肿瘤中提取出的基底膜基质,包含多种蛋白和生长因子,有利于肿瘤细胞在动物体内的快速增殖,同时Matrigel 在生理体温下会迅速凝结固化,有助于肿瘤细胞锚定在皮下某一固定位置,促进实体瘤的形成[14],具有促进细胞增殖分化、血管生成、组织成形等作用,对提高成瘤率、缩短成瘤时间及促进肿瘤生长具有重要作用[15-16]。 本文研究发现,添加基质胶对小鼠一般体征、饮食量及饮食量影响不大,对体重的影响可能是由于肿瘤本身重量增长引起,而且基质胶的成分多来源于小鼠,相对安全可靠。
尽管Matrigel 应用广泛,但其应用的适宜浓度尚未明确。 Matrigel 常用的种类有标准浓度Matrigel(蛋白浓度范围:8 ~ 12 mg/mL)和高浓度Matrigel(蛋白浓度范围:18 ~ 22 mg/mL)两种,标准型Matrigel 融化后为澄清液体,蛋白浓度越高,融化后的液体越粘稠。 对于小鼠体内的成瘤实验,应选用高浓度Matrigel,高蛋白浓度不仅增加肿瘤的生长,还能保证注射后的细胞的定位及肿瘤的完整性[17]。但高浓度的Matrigel 在使用时也存在一定的问题,不仅液体流动性差,且较易凝固成胶,给注射操作带来一定的困难。 对于Matrigel 基质胶的应用浓度,文献方法多以基质胶原始浓度与细胞悬液按照等体积1 ∶1 稀释[18-19]。 是否蛋白浓度越高越有利于肿瘤的生长,尚待进一步研究。
找到Matrigel 应用的最佳浓度以进一步突出该建模方法的优势,对后续实验的理论及实践基础的建立具有重要意义。 本研究在已有研究的基础上,用pH=7.4 的PBS 配置了50%、75%、100% 3 种浓度的基质胶,再将不同浓度的基质胶与细胞悬液按照等体积1 ∶1 稀释,按照每只100 μL 给小鼠注射。探讨不同浓度的Matrigel 对小鼠Lewis 肺癌异位皮下移植瘤成瘤的影响。 结果显示,75%浓度的基质胶组小鼠肿瘤体积增长最快,肿瘤最大,且形状规则、大小均匀;100%浓度的基质胶组肿瘤体积增长和肿瘤重量次之;50%浓度的基质胶组肿瘤体积增长最慢,肿瘤最小。 表明75%浓度的基质胶是小鼠皮下肿瘤生长的适宜浓度条件,可为后期基质胶应用于小鼠皮下移植瘤模型的建立提供理论参考。
参 考 文 献(References)
[ 1] 侯伟. 肺癌Ⅰ号方对Lewis 肺癌小鼠癌细胞凋亡相关蛋白表达的实验研究 [D]. 昆明: 云南中医药大学; 2019.Hou W. The experimental research of lung cancer I prescription affect apoptosis-related proteins of lewis lung cancer mice [D].Kunming:YunnanUniversity of TrditionalChinese Medicine; 2019.
[ 2] 陈正庭. PTTG1 通过TGF-β1/SMAD3 通路调控放射后肺腺癌侵袭转移能力和免疫功能改变的研究 [D]. 昆明: 昆明医科大学; 2020.Chen ZT. PTTG1 via TGF-β1/SMAD3 pathway regulates the invasion, metastasis and immune function of lung adenocarcinoma afterradiation[ D ].Kunming:KunmingMedical University; 2020.
[ 3] 陈婷, 王双, 张恋, 等. 多次注射乌拉坦诱导的BALB/C 及C57BL/6J 小鼠肺癌模型的比较 [J]. 四川动物, 2014, 33(2): 275-278.Chen T, Wang S, Zhang L, et al. Comparative study of lung cancer models on BALB/C and C57BL/6J mice induced by multiple urethane injections [J]. Sichuan J Zool, 2014, 33(2):275-278.
[ 4] 韩靓, 刘殿峰, 祁明辉, 等. TETs 蛋白在乌拉坦诱导小鼠肺癌模型中的表达模式 [J]. 中国比较医学杂志, 2020, 30(1): 1-6.Han L, Liu DF, Qi MH, et al. Analysis of the expression pattern of TET proteins in lung cancer mouse model induced by urethane[J]. Chin J Comp Med, 2020, 30(1): 1-6.
[ 5] 胥孜杭, 刘菲, 邹纯朴, 等. 小鼠肺癌原位模型的建立 [J].中国医药导报, 2015, 12(1): 15-18, 169.Xu ZH, Liu F, Zou CP, et al. Establishment of orthotopic lung cancer model in mice [J]. Chin Med Her, 2015, 12(1): 15-18, 169.
[ 6] 李杰, 缪维芳, 吴秀兰. Matrigel 在肿瘤体内外研究模型中的应用 [J]. 海峡药学, 2014, 26(8): 74-76.Li J, Miao WF, Wu XL. Application of matrigel in tumor research modelinvivoandinvitro[J]. Strait Pharm J, 2014,26(8): 74-76.
[ 7] Kastana P, Zahra FT, Ntenekou D, et al. Matrigel plug assay forinvivoevaluation of angiogenesis [J]. Methods Mol Biol, 2019,1952: 219-232.
[ 8] 张斌斌, 高全文, 李冰, 等. 骨髓间充质干细胞在Matrigel 凝胶支架上的生长与变化 [J]. 中国组织工程研究, 2018, 22(13): 1993-1998.Zhang BB, Gao QW, Li B, et al. Bone marrow mesenchymal stem cells on matrigel: growing and changing [J]. Chin J Tissue Eng Res, 2018, 22(13): 1993-1998.
[ 9] Nelson CM, Bissell MJ. Of extracellular matrix, scaffolds, and signaling:tissuearchitecture
regulatesdevelopment,homeostasis, and cancer [J]. Annu Rev Cell Dev Biol, 2006,22: 287-309.
[10] Fliedner FP, Hansen AE, Jørgensen JT, et al. The use of matrigel has no influence on tumor development or pet imaging in fadu human head and neck cancer xenografts [J]. BMC Med Imaging, 2016, 16: 5.
[11] 李杨, 杨玲玲, 白彦丽, 等. 黄芪多糖对气阴两虚Lewis 肺癌荷瘤小鼠肿瘤生长、转移及细胞周期的影响 [J]. 肿瘤防治研究, 2018, 45(3): 131-137.Li Y, Yang LL, Bai YL, et al. Effects of astragalus polysaccharides on the growth, metastasis and cell cycle of lewis lung cancer in tumor-bearing mice with qi and yin deficiency[J]. Cancer Res Prev Treat, 2018, 45(3): 131-137.
[12] 张娜, 田燕歌, 刘学芳, 等. 小鼠移植性肺癌转移模型研究进展 [J]. 中国实验动物学报, 2020, 28(4): 557-562.Zhang N, Tian YG, Liu XF, et al. Research progress in the metastatic model of transplanted lung cancer in mouse [J]. Acta Lab Anim Sci Sin, 2020, 28(4): 557-562.
[13] 李宁, 张晓晔, 蒋中秀, 等. 小鼠Lewis 肺癌原位模型的建立[J]. 中国实验动物学报, 2014, 22(5): 79-83.Li N, Zhang XY, Jiang ZX, et al. Establishment of a mouse model of orthotopic Lewis lung cancer [J]. Acta Lab Anim Sci Sin, 2014, 22(5): 79-83.
[14] 袁志强. RGD 介导的环境敏感型胶束在治疗非小细胞肺癌中的应用 [D]. 苏州: 苏州大学; 2017.Yuan ZQ. Application of RGD mediated environment sensitive micelles in the treatment of non-small cell lung cancer [D].Suzhou: Suzhou University; 2017.
[15] 张胜行, 张诗兰, 兰小鹏. 人结肠癌SW480 细胞裸鼠皮下移植瘤模型的建立 [J]. 东南国防医药, 2012, 14(2): 108-110.Zhang SX, Zhang SL, Lan XP. The establishment of subcutaneous transplantation model of human colon cancer SW480 cells in nude mice [J]. Mil Med J Southeast Chin,2012, 14(2): 108-110.
[16] 雷霞, 伍津津. 基质胶的生物学活性研究进展 [J]. 口腔医学, 2011, 31(6): 368-371.Lei X, Wu JJ. Research progress on biological activity of matrigel[J]. Stomatol, 2011, 31(6): 368-371.
[17] Hadley MA, Byers SW, Suárez-Quian CA, et al. Extracellular matrix regulates sertoli cell differentiation, testicular cord formation, and germ cell developmentinvitro[J]. J Cell Biol,1985, 101(4): 1511-1522.
[18] 张龙, 孙晓娟, 陈成龙, 等. Matrigel 对人骨肉瘤动物模型移植瘤形成的影响 [J]. 肿瘤研究与临床, 2017, 29(11): 721-725.Zhang L, Sun XJ, Chen CL, et al. Effect of Matrigel on the formation of transplanted tumor in human osteosarcoma animal model [J]. Cancer Res Clin, 2017, 29(11): 721-725.
[19] 郭建勋, 王任先, 刘巍峰, 等. 人骨肉瘤OS-732、Saos-2 和U2OS 裸鼠成瘤模型的建立和比较 [J]. 现代肿瘤医学,2021, 29(7): 1103-1107.Guo JX, Wang RX, Liu WF, et al. Establishment and comparison of tumor forming models of human osteosarcoma OS-732, Saos-2 and U2OS in nude mice [J]. J Mod Oncol, 2021,29(7): 1103-1107.

