同型半胱氨酸通过miR-21靶向CDC25A介导细胞周期阻滞
朱霞 金益峰 张陆军 章建梁 赵仙先 董少华
(1乌鲁木齐市友谊医院心血管内科,新疆 乌鲁木齐 880049;2上海嘉定区中医医院普通外科;3海军医科大学附属长海医院心血管内科)
Homocysteine induces cell cycle arrest by miR-21 targeting CDC25A in endothelial cells
ZHU Xia, JIN Yi-Feng, ZHANG Lu-Jun,etal.
Department of Cardiology, Urumqi Friendship Hospital, Urumqi 880049, Xinjiang, China
【Abstract】ObjectiveTo investigate the role and potential mechanism of miR-21 in homocysteine (Hcy) -induced human umbilical vein endothelial cells (HUVECs).MethodsThe apoptosis and cell cycle of HUVECs treated with different concentrations of Hcy were detected by flow cytometry.RT-qPCR was used to detect the expression levels of 15 miRNA and 15 target genes of miR-21. The effect of miR-21 on the expression of cell cycle regulator (CDC25A) was detected by luciferase and Western blot.Flow cytometry was used to revealed how lentivirus induced CDC25A overexpression and miR-21 mimics affected cell cycle progression.ResultsCompared with 0 mmol/L Hcy group, the cell number and proliferation of 3 mmol/L and 5 mmol/L Hcy groups were significantly decreased (P<0.05), and cell apoptosis was significantly increased(P<0.05), B cell lymphoma(Bcl)-2 mRNA and protein levels in cells were significantly reduced in a dose-dependent manner(P<0.05). Compared with 0 mmol/L Hcy group, the expression level of miRNA-21 was significantly increased (P<0.05)and the expression level of CDC25A was significantly decreased in 3 mmol/L Hcy group. Compared with NC group, miR-21-5p level of miR-21-5p mimic group was significantly increased, CDC25A mRNA and protein expression were significantly decreased(P<0.01). Compared with miR-21-5p mimic group, the level of miR-21-5p in miR-21-5p inhibitor group was significantly decreased(P<0.01). Dual luciferase reporter assay showed that miR-21-5p mimic in experimental group significantly inhibited luciferase activity in wild-type CDC25A 3 '-UTR cells(P<0.01). The expression of CDC25A protein in 0 mmol/L and 3 mmol/L Hcy group were significantly decreased(P<0.05). Compared with blank control group, CDC25A protein level was significantly increased in CDC25A lentivirus group, and the expression of CDC25A protein was significantly decreased in CDC25A lentivirus +miR-21 mimic group(P<0.05). Compared with blank control group, the proliferation ability of CDC25A lentivirus group was significantly increased(P<0.05), and the cells resumed to enter S phase,CDC25A lentivirus +miR-21 mimic group reduced the effect of CDC25A overexpression on cell cycle progression(P<0.05).ConclusionsmiR-21 plays an important role in modulating cell cycle progression and cell proliferation by targeting CDC25A in a Hcy-induced cell and suggests new insights into the prevention of Hcy-associated cell dysfunction.
【Keywords】 Homocysteine; miR-21; CDC25A; Cell cycle; Proliferation
同型半胱氨酸(Hcy)是一种含硫的非蛋白质氨基酸,由蛋氨酸转化形成〔1〕。Hcy水平升高称为高同型半胱氨酸血症(HHcy),Hcy被认为是动脉粥样硬化、营养不良和恶性肿瘤等多种疾病的独立危险因素,严重危害老年人的身体健康〔2〕。Hcy可通过多种生物学途径影响心血管疾病(CVD)的发生,例如内皮细胞的损伤和功能障碍〔3〕,胆固醇三酰甘油合成紊乱〔4〕,血栓紊乱〔5〕,平滑肌细胞过度增殖等〔6〕。血管内皮细胞是血液和血管的分界,Hcy直接影响血管内皮细胞的损伤或者功能障碍〔7〕,但是目前Hcy介导内皮细胞的机制并不清楚。miRNA是由19~24个核苷酸组成的单链内源性非编码RNA,通过抑制其靶mRNA的翻译或降解来调节基因表达〔8〕。miRNA在人脐静脉内皮细胞(HUVEC)中表达丰富〔9,10〕。有证据表明,miRNA在许多生物学过程中发挥重要作用,包括增殖、凋亡、代谢、炎症和衰老,并参与多种疾病的病理过程〔11〕。有研究报道Hcy在诱导心肌重构过程中,通过增加核酸内切酶水平诱导miRNA的差异表达〔12〕。此外,miRNA影响内皮细胞增殖〔13〕。例如,高水平的miR-21通过复制和应激诱导导致HUVECs细胞周期阻滞和细胞增殖抑制〔1〕。然而参与调节内皮细胞功能障碍的miRNA的异常表达是否由Hcy诱导尚不明确。
miRNA可以通过诱导目的mRNA的降解或者抑制翻译来调控基因表达。细胞周期调控因子(CDC25)双特异性磷酸酶(DSP)有3个亚单位:CDC25A、CDC25B和CDC25C〔14〕。而CDC25A是miR-21的主要靶基因〔15〕,也是一个重要的细胞周期调节因子,通过蛋白与蛋白之间的相互作用,在激活不同的周期蛋白CDK复合物,促进染色体聚集,调控细胞周期G1/S和G2/M期的转变等方面发挥重要的作用〔16,17〕。在多种癌细胞体系中可发现CDC25A高表达,其原因是增殖不可控和凋亡逃逸〔18〕。miR-21通过靶向CDC25A调节细胞周期进程引起血清饥饿〔19〕。本文主要研究在HUVECs中,miR-21的靶基因及其在细胞周期进程和增殖的作用,探究Hcy引起内皮细胞功能障碍的分子机制。
1 材料与方法
1.1材料 HUVECs和HEK293T细胞从美国菌种保藏中心中获得;杜氏改良培养基DMEM购自美国HyClone公司;Lipofectamine 2000试剂购自美国Invitrogen公司;miR-21 模拟物(mimic)、miR-21抑制剂(inhibitor)购自中国广州锐博生物科技公司;细胞增殖(CCK8)检测试剂盒、膜联蛋白(Annexin) V-异硫氰酸荧光素(FITC)凋亡检测试剂盒和蛋白提取试剂盒购自碧云天生物科技有限公司;Hcy购自美国Sigma公司;荧光素酶报告基因检测试剂盒购自美国Promega公司;RNA提取试剂盒购自德国Qiagen公司;逆转录试剂盒购自日本Toyobo公司;SYBR®Premix Ex TaqTMⅡ购自丹麦Vedbæk公司;CDC25A和GAPDH抗体均购自美国abcam公司;Western印迹化学发光辣根过氧化物酶(HRP)底物电化学发光(ECL)液购自美国Millipore公司;ABI 7900型实时荧光定量PCR系统购自美国Applied Biosystems公司;流式细胞仪购自美国BD公司。
1.2方法
1.2.1细胞培养和处理 HUVECs和HEK293T细胞使用杜氏改良培养基(包含10%胎牛血清、1%青霉素/链霉素和1%谷氨酰胺)培养在37℃,5% CO2环境的湿化培养箱中。细胞密度达到80%~90%时,使用胰酶消化细胞传代培养。取对数生长期的 HUVECs,分为Hcy组和对照组。Hcy组培养基中加入3 mmol/L、5 mmol/L的Hcy处理细胞,对照组加入等体积的DMEM完全培养液,分别标记为3 mmol/L Hcy组、5 mmol/L Hcy组、0 mmol/L Hcy组。
1.2.2CCK8试剂盒检测细胞增殖状况 将细胞以1×104细胞/孔的密度接种于96孔板中,培养基中加入不同浓度的Hcy处理细胞;24 h后每孔加入10 μl CCK8溶液,培养1 h,在450 nm处用酶标仪测定吸光度。每组实验均设3个复孔,用数据平均值来反映细胞生长状况。 转染组细胞增殖活性检测同上。
1.2.3细胞周期检测 取适当浓度(1~5)×106个/ml的细胞,用预冷的磷酸盐缓冲液(PBS)洗涤3次后,使用75%的冷乙醇-20℃固定过夜。次日向细胞中加入200 μl RNaseA(300 g/ml),加入碘化丙啶(PI)进行细胞染色,洗涤后用流式细胞仪进行细胞周期分析。
1.2.4细胞凋亡检测 细胞凋亡检测使用Annexin V-FITC凋亡检测试剂盒。使用1 ml结合缓冲液重悬约1×106个细胞,在每个样品中加入10 μl Annexin V-FITC和10 μl PI溶液,进行流式细胞术检测。
1.2.5荧光素酶检测 将人源CDC25A的3′UTR全长克隆到psiCheck-2荧光素酶报告质粒中,PCR产生的突变miR-21-5p使用以下引物:CDC25A-3′UTR正向:5′-ATTACTCGAGAATCTCCCAGACCCACCACT GG-3′,反向:5′-ATACGCGGCCGCCACCTCCCA CCAAATAGATATCGG-3′;CDC25A-3′UTR突变正向:5′-ATTACTCGAGTATTCGAAAATCTCCCAGAC CCACCACTGG-3′,反向:5′-TAAAGCGGCCGCCACCTCCCACCAAATAGATATCGG-3′。使用Lipofectam-ine2000试剂将CDC25A 3′UTR荧光素酶报告质粒或对照质粒与15 nmol/L或30 nmol/L的miR-21 mimic共转染到HEK293T细胞中〔分别为15 nmol/L组和30 nmol/L组,以0 nmol/L作为对照(0 nmol/L组)〕。转染48 h后收集细胞,使用双荧光素酶报告基因检测试剂盒检测荧光〔20〕。
1.2.6慢病毒构建和转染 慢病毒的构建、制备和转染参照文献〔21〕报道的方法。 取对数生长期的 HUVECs和HEK293T细胞,以 2×105个/孔接种于6孔板中培养,当细胞达50%~70%融合时,使用LipofectamineTM2000转染试剂分别将阴性对照、miR-21 mimic、miR-21 inhibitor转染到细胞中,并分别标记为NC组、miR-21-5p mimic组、miR-21-5p inhibitor组,每组设置6个复孔,转染6 h后,更换新鲜培养基,加入终浓度为 3 mmol/L或5 mmol/L的Hcy转染24 h后检测转染效率,进行后续实验。
为了验证Hcy的诱导效应是通过影响miR-21的水平靶向抑制CDC25A表达。分别用阴性对照Hcy、miR-21 mimic、miR-21 inhibitor、Hcy+miR-21 inhibitor处理细胞,分为NC组、Hcy组、miR-21 mimic组、miR-21 inhibitor组和Hcy+miR-21 inhibitor组。
从HUVEC cDNA文库中扩增CDC25A的开放阅读框序列,并使用以下引物构建质粒pCDHCMV-MCS-EF1-copGFP正向:5′-ACTGAATTCACCATGGAACTGGGCCCGGAG-3′,反向:5′-CGGGATCCTCAGAGCTTCTTCAGACGACTG-3′。将慢病毒重组质粒、空载质粒、pML-Δ8.9或pVSV-G质粒共转染到HEK293T细胞中,分别为CDC25A慢病毒组、空白对照组、CDC25A慢病毒+miR-21 mimic组,制备重组慢病毒细胞株。通过计数HEK293T细胞中GFP阳性细胞比值来检测转染效率。慢病毒感染HUVEC细胞的病毒感染复数(MOI)为10。
1.2.7实时荧光定量PCR 使用miRNeasy试剂盒提取RNA。总量RNA用20 μl无RNA酶的H2O洗脱,检测260 nm波长处的OD值,测定RNA浓度。使用ReverTra Ace®qPCR RT试剂盒,将分离得到的RNA逆转录得到cDNA。逆转录反应混合物包括3.5 μl RT primer mix (每个miRNA 0.5 μl),4 μl (5X) RT缓冲液,1 μl RT Enzyme Mix 和总RNA。用于RT-qPCR的miRNAs有miR-10a、miR-18a、miR-22、miR-21、miR-24、miR-28、miR-29b、miR-30b、miR-128、miR-140、miR-203、miR-214、miR-296、miR-425、miR-486,其对应的上游引物序列:5′-ACACTCCAGCTGGGTACCCTGTAGATCCGAA-3′、5′-ACACT-CCAGCTGGGTAAGGTGCATCTAGTGC-3′、5′-ACAC-TCCAGCTGGGAAGCTGCCAGTTGAAG-3′、5′-ACAC-TCCAGCTGGGTAGCTTATCAGACTGA-3′、5′-ACAC-TCCAGCTGGGTGGCTCAGTTCAGCAG-3′、5′-ACAC-TCCAGCTGGGCACTAGATTGTGAGCT-3′、5′-ACAC-TCCAGCTGGGTAGCACCATTTGAAATC-3′、5′-ACA-CTCCAGCTGGGTGTAAACATCCTACAC-3′、5′-ACA-CTCCAGCTGGGCGGGGCCGTAGCACTGT-3′、5′-AC-ACTCCAGCTGGGCAGTGGTTTTACCCTA-3′、5′-ACA-CTCCAGCTGGGGTGAAATGTTTAGGAC-3′、5′-ACA-CTCCAGCTGGGACAGCAGGCACAGACA-3′、5′-ACA-CTCCAGCTGGGGAGGGTTGGGTGGAGG-3′、5′-ACA-CTCCAGCTGGGAATGACACGATCACTCC-3′、5′-AC-ACTCCAGCTGGGTCCTGTACTGAGCTGC-3′;其对应的下游引物序列:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCACAAA-3′、5′-CTCA-ACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCTA-TCA-3′、5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGACAGTT-3′、5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTCAACA-3′、5′-CTCA-ACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCTG-TTC-3′、5′-CTCAACTGGTGTCGTGGAGTCGGCAATT-CAGTTGAGTCCAGG-3′、5′-CTCAACTGGTGTCGTG-GAGTCGGCAATTCAGTTGAGAACACT-3′、5′-CTCA-ACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAGC-TGA-3′、5′-CTCAACTGGTGTCGTGGAGTCGGCAATT-CAGTTGAGTCTCAG-3′、5′-CTCAACTGGTGTCGTG-GAGTCGGCAATTCAGTTGAGCTACCA-3′、5′-CTCA-ACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCTA-GTG-3′、5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGACTGCC-3′、5′-CTCAACTGGTGTCGTG-GAGTCGGCAATTCAGTTGAGGGAGAG-3′、5′-CTCA-ACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTCA-ACG-3′、5′-CTCAACTGGTGTCGTGGAGTCGGCAAT-TCAGTTGAGCTCGGG-3′,通用下游引物序列:5′-TGTCGTGGAGTCGGCAATTC-3′。
RT-qPCRs使用ABI Prism7900系统,使用SYBR®Premix Ex TaqTMⅡ,反应混合物中含有10 μl SYBR®Premix Ex TaqTMⅡ,0.5 μl正向引物(10 μmol/L),0.5 μl反向引物(10 μmol/L),2 μl cDNA模板,7 μl RNase-free H2O。qRT-PCR程序为95℃ 30 s,95℃ 5 s,60℃ 60 s,第二步到第四步进行40个循环。每个样品重复3次实验。结果采用2-ΔΔCt计算各miRNA表达量。用于RT-qPCR的基因有CDC25A、张力蛋白同源物(PTEN)、程序性死亡因子(PDCD)4、软脂酰化磷蛋白(SPRY)1、SPRY2、反转录富含半胱氨酸蛋白(RECK)、肿瘤抑制基因(TP)63、白细胞介素(IL)12A、B细胞易位基因2(BTG)、富亮氨酸重复序列相互作用蛋白(LRRFIP)1、骨形态发生蛋白2型受体(BMPR2)、转化生长因子(TGF)β2、E3泛素连接酶(PELI1)、人错配修复蛋白(MSH)2和酸性核磷蛋白(ANP)32A,上游引物序列:5′-CTCCTCCGAGTCAACAGATTCA-3′、5′-CCGGCAGCATCAAATGTTTCAG-3′、5′-ACAGGTGT-ATGATGTGGAGGA-3′、5′-GAGAGAGATTCAGCCTA-CTGCT-3′、5′-ATGGCATAATCCGGGTGCAA-3′、5′-TGTGAACTGGCTATTGCCTTG-3′、5′-GGACCAGCA-GATTCAGAACGG-3′、5′-CCTTGCACTTCTGAAGAG-ATTGA-3′、5′-ACCACTGGTTTCCCGAAAAG-3′、5′-GCTATGGTTTCCAATGCTCAGC-3′、5′-CGACAGGAGA-CCGTAAACAAGG-3′、5′-ATGGCTTGACCACTAATGGTG-3′、5′-AGGCATCCAAGGAGAATGATTG-3′、5′-CACCTCAATCGCAAACTTACCA-3′,下游引物序列:5′-CAACAGCTTCTGAGGTAGGGA-3′、5′-AACTGGCAGGTAGAAGGCAACTC-3′、5′-TTCTCAAATGCC-CTTTCATCCAA-3′、5′-GCAGGTCTTTTCACCACCGA-A-3′、5′-TGTCGCAGATCCAGTCTGATG-3′、5′-GCA-TAACTGCAACAAACCGAG-3′、5′-AGGACACGTCGA-AACTGTGC-3′、5′-ACAGGGCCATCATAAAAGAGGT-3′、5′-CTGGCTGAGTCCGATCTGG-3′、5′-GCCGCCT-AGATTCAGCCAG-3′、5′-CCATATCGACCTCGGCCA-ATC-3′、5′-CGATCTGGTTTCACGTAGGCTA-3′、5′-G-GAATCCACATACCCAACTCCAA-3′、5′-AACACATT-TTCTCGGTAGTCGTT-3′。
1.2.8Western印迹分析 用蛋白提取试剂盒提取总蛋白。Bradford法定量蛋白浓度后,取20 μg蛋白裂解液在分离胶为12%的十二烷基硫酸钠-聚丙烯酰胺凝胶上进行电泳,湿转法转移到聚偏氟乙烯(PVDF)膜上,然后用5%的脱脂牛奶常温封闭1 h。将膜分别与含有CDC25A和GAPDH的一抗在4℃孵育过夜,用TBST洗涤后,将膜与HRP二抗室温孵育1 h,TBST洗涤后进行免疫印迹显影检测。
1.3统计学分析 采用SPSS21.0统计软件进行Wilcoxon-Mann-Whitney检验和t检验。
2 结 果
2.1Hcy影响HUVEC细胞凋亡、增殖和细胞周期 与0 mmol/L Hcy组相比,3 mmol/L Hcy组、5 mmol/L Hcy组细胞增殖活性显著下降(P<0.05),5 mmol/L Hcy组细胞增殖活性显著低于3 mmol/L Hcy组(P<0.05)。见图1、表1。利用流式细胞术检测细胞凋亡和细胞周期。与0 mmol/L Hcy组相比,3 mmol/L Hcy组、5 mmol/L Hcy组细胞凋亡显著增加(P<0.05),且5 mmol/l Hcy组显著高于3 mmol/L Hcy组(P<0.05)。见表1、图2。

与0 mmol/L Hcy组比较,5 mmol/L Hcy组显著延迟了细胞周期G1/S向G2/M的转换(P<0.05)。见表1、图3。与0 mmol/L Hcy组相比,3 mmol/L Hcy组、5 mmol/L Hcy组,B细胞淋巴瘤(Bcl)-2 mRNA和蛋白水平以剂量依赖的方式显著降低(P<0.05)。见表1和图4。由于Hcy会导致细胞数量呈剂量依赖性下降,因此后续实验采用3 mmol/L Hcy处理细胞作为实验组,以便有足够的细胞用于后续实验。
2.2Hcy影响miR-21和CDC25A的表达 与0 mmol/L Hcy组相比,3 mmol/L Hcy组中miR-21和miR-203表达水平上升,miR-29b表达水平下调,差异均有统计学意义(均P<0.05)。见表2。在这3种显著变化的miRNA中,miRNA-21变化最为明显,显著上升2.19倍。推测miR-21可能在Hcy诱导细胞功能障碍中扮演非常重要角色。与0 mmol/L Hcy组相比,3 mmol/L Hcy组MSH2和ANP32A mRNA表达水平分别下降51%和41%,而CDC25A表达水平变化最大,下降85%,差异有统计学意义(P<0.05)。见表3。因此选择对CDC25A进行进一步的研究。
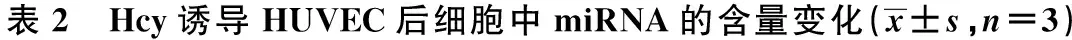

2.3miRNA-21靶向调控CDC25A 与NC组相比,miR-21-5p mimic组细胞内miR-21-5p水平显著升高,CDC25A水平显著下调(P<0.01)。与miR-21-5p mimic组相比,miR-21-5p inhibitor组细胞内miR-21-5p水平显著降低(P<0.01),CDC25A水平显著上升(P<0.05)。见表4、图5。
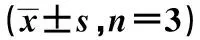
表4 miR-21 mimic和miR-21 inhibitor转染HUVECs后,miR-21-5p含量和CDC25A mRNA及蛋白表达比较
CDC25A的mRNA 3′-UTR 包含miR-21-5p的互补位点。用TargetScan和miRBase预测CDC25A是miR-21-5p的一个潜在靶点。将人的CDC25A mRNA的3′-UTR片段克隆到报告质粒中:其中1个编码CDC25A mRNA的3′-UTR野生型(WT)序列,另1个编码CDC25A mRNA的3′-UTR的突变(Mut)序列,该突变序列缺乏与miR-21-5p结合位点见图6。
NC组、Hcy组、miR-21 mimic组、miR-21 inhibitor组、Hcy+miR-21 inhibitor组CDC25A蛋白表达分别为:1.00±0.09、0.31±0.02、0.54±0.04、2.14±0.02、1.27±0.13。与NC组比较,Hcy组、miR-21 mimic组CDC25A蛋白表达显著降低(P<0.05);miR-21 inhibitor组CDC25A蛋白表达显著升高(P<0.01);与miR-21 inhibitor组比较,Hcy+miR-21 inhibitor组CDC25A蛋白表达显著降低(P<0.05)。见图7。
miR-21-5p mimic显著抑制CDC25A 3′-UTR WT细胞的荧光素酶活性(P<0.05),而对CDC25A 3′-UTR Mut细胞的荧光素酶活性影响没有统计学意义(P>0.05)。miR-21-3p mimic不能抑制CDC25A 3′-UTR的荧光素酶。见表5。
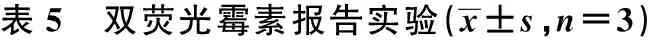
2.4miR-21调控CDC25A的表达 与0 mmol/L Hcy组CDC25A、MSH2、ANP32蛋白表达(1.00±0.13、1.00±0.15、1.00±0.09)比较,3 mmol/L Hcy组CDC25A蛋白表达(0.29±0.03)显著下调(P<0.05),而MSH2(0.94±0.13)和ANP32蛋白表达(1.04±0.16)下调不明显(P>0.05)。见图8。
2.5CDC25A过表达促进细胞增殖和细胞周期 与空白对照组(1.00±0.12)相比,CDC25A慢病毒组细胞中CDC25A蛋白水平(3.31±0.02)显著上升,CDC25A慢病毒+miR-21 mimic组CDC25A的蛋白表达(1.26±0.40)较CDC25A慢病毒组明显减少(P<0.05)。见图9。与空白对照组(0.31±0.08)相比,CDC25A慢病毒组细胞的增殖能力(0.58±0.08)明显增强(P<0.05);而CDC25A慢病毒+miR-21 mimic组增殖能力(0.35±0.09)无明显变化(P>0.05)。CDC25A慢病毒组与空白对照组比较,细胞恢复进入S期,也恢复了G2/M期过渡检验点,不影响Hcy诱导的细胞凋亡。CDC25A慢病毒+miR-21 mimic组降低了CDC25A过表达对细胞周期进程的影响 (P<0.05)。见图10、表6。

3 讨 论
CVD的一些生物学机制与Hcy诱导的生理功能障碍有关,包括内皮细胞损伤、修复和增殖〔22,23〕。miRNAs参与调控细胞增殖、凋亡和细胞周期等过程〔24~26〕。为研究miRNA水平的变化,我们检测了Hcy处理HUVECs后,15个miRNA的水平。其中miR-21和miR-203上调,miR-29b下调。miR-21比miR-29b和miR-203的变化更显著。因此,推测miR-21可能在Hcy对HUVECs的影响中起到重要作用。在人类许多癌症的上皮细胞、造血细胞、生殖细胞和神经细胞中,经常发现miR-21的水平升高,这表明miR-21可能是一种致癌因子〔14〕。此前有报道称抑制miR-21可以减缓细胞生长,延缓细胞周期,影响多种细胞系,如A172、U87、LN229和LN308的凋亡〔27〕。与之相反的研究〔15〕称,在某些应激条件下,miR-21水平升高可能抑制细胞增殖并影响细胞周期检查点进展。本研究揭示Hcy处理HUVECs后,miR-21-5p通过调控CDC25A表达来抑制细胞增殖和延迟细胞周期进程的新功能。
CDC25A涉及G1/S、G2/M转换和G2检查点已经被广泛研究〔16〕,高CDC25A水平导致细胞过度增殖,而敲除CDC25A则影响细胞周期进程抑制肿瘤发生〔28,29〕。本研究发现,过表达CDC25A可逆转升高的miR-21对细胞增殖和细胞周期的影响。因此,我们提出在HUVECs中,Hcy介导miR-21表达上升靶向抑制CDC25A表达的机制。本研究有助于寻找治疗HHcy的新策略,改善Hcy诱导的细胞功能障碍,减少老年病如心血管疾病和肿瘤的发生。然而,Hcy代谢物如同型半胱氨酸硫代内酯和蛋白结合型同型半胱氨酸对人内皮细胞功能的影响还需要进一步研究〔30〕。本研究中Hcy处理细胞后,其他关键靶基因是否也发生了变化尚不清楚,有待发掘。

