17β-雌二醇降解微生物筛选及环境因素的影响
谢文骁,来超超,黄斌,潘学军
(昆明理工大学 环境科学与工程学院,昆明 650500)
类固醇雌激素(Steroid estrogens, SEs)对生态环境与人体健康的危害广受关注。17β-雌二醇(E2)是一种典型的SEs,仅在1 ng/L环境浓度时即可使水生生物产生慢性毒性,使其产生畸变或致癌[1]。课题组前期对昆明市8家城市污水处理厂研究时发现,污水处理厂中E2的去除率仅为30%~40%,日环境负荷量高达7.8 g/d,城市生活污水已成为水环境中E2的重要来源之一[2]。而E2的环境累积对人类的危害日渐显现,最近有研究报道[1],在饮用水及蔬菜水果中均检出了E2,且最大检出浓度分别达到1.7、2.2 μg/L。因此,急需寻求高效去除污水处理厂中E2的方法,而提高生化法对E2的处理效率受到了广泛关注[3]。
大多传统的生物法与物理化学法污水处理技术可去除一部分SEs[4-5],其中,光催化等高级氧化法处理水中的SEs已有研究[6]。然而,这些方法都存在高能耗和高成本的缺陷,因而,研究人员正探寻更有效且经济的方法来控制污水中的SEs。SEs在水环境中的半衰期从几周到几年不等[7]。相关研究表明,在自然环境中,微生物和光化学作用均能有效削减SEs浓度[8-9],但吸附在水中沉积物上的SEs难以接收光照,表明生物降解在SEs的自然削减中产生了关键作用。同时,微生物去除污染物也是一种廉价且环境友好的技术[10]。因此,研究分析微生物降解SEs的过程及关键影响因素,对污水中SEs的去除尤为重要。
微生物去除污染物有两种方法,即生物吸附和生物降解[11]。生物吸附是一种利用微生物细胞在水生环境中的一系列物理化学作用吸收污染物的过程[12]。而生物降解是指水中污染物被微生物转化成中间代谢产物,并最终被矿化的过程。然而,尽管之前一些文献中已经报道了SEs的生物转化,但生物吸附及生物降解过程对SEs去除的贡献尚不清楚,复杂的环境因素对去除SEs的影响也尚不明确,包括碳源、pH值、腐殖质(HS)、重金属和溶解氧等。为了提高SEs的微生物去除效率,笔者选择类固醇雌激素化合物E2作为目标污染物,并从洱海底泥中提取富集E2降解微生物进行生物吸附和生物降解实验,以探究自然过程中微生物对E2的生物吸附和生物降解过程及不同环境因素对该过程的影响,并分析微生物高效降解E2的最佳环境条件。
1 材料与方法
1.1 材料准备
E2和标准品腐殖酸(HA)购买自Sigma-Aldrich公司。沉积物来自中国云南省大理市洱海,干燥后使用4.0 mm筛子筛分,用去离子水冲洗。采用国际腐殖酸物质学会的碱溶酸析法提取湖泊沉积物腐殖酸(LHA)和富里酸(LFA)[13]。最后,将制备的LHA和LFA储备溶液储存在聚乙烯容器中,在黑暗中以4 ℃保存,并在3周内使用。如未另外说明,所有其他试剂均为分析纯。
1.2 实验方法
1.2.1 E2降解微生物Y2的分离与鉴定 称取100 g洱海底泥样品与150 mL无机盐培养基(MSM)混合置于500 mL锥形瓶中,充分振荡20 min后取上清液。其中,MSM成分为600 mg/L K2HPO4·12H2O、800 mg/L KH2PO4、1 000 mg/L NaCl、800 mg/L NH4NO3、200 mg/L MgSO4、50 mg/L CaCl2·2H2O和10 mg/L酵 母 提 取 物[14]。取5 mL上清液到扩大培养基中(含有10 g/L胰蛋白胨、5 g/L酵母提取物和10 g/L NaCl),在30 ℃的旋转振荡器上以160 r/min的速度培养24 h,以获得微生物悬浮液。将1.0 mL微生物悬浮液移至含1.00 mg/L E2的250.0 mL MSM中,培 养 至E2浓 度 稳定、不被降解为止。E2浓度用高效液相色谱仪(HPLC)检测。将上述过程循环7次,以获得E2降解菌。此后,将1.0 mL微生物悬浮液涂抹至琼脂平板,并在30 ℃下培养12 h。用新琼脂将发育良好的菌落划线3次后,对培养的菌株进行微生物种类鉴别。
1.2.2 生物吸附实验 为阐明E2降解微生物对E2的吸附过程,进行了吸附平衡实验。生物量为1.00 g/L,E2浓度为1.00 mg/L,吸附时间为5 h。生物吸附在30.0 mL MSM中进行,并在30 ℃的旋转摇床上以160 r/min培养。在溶液中加入浓度为650 mg/L的叠氮化钠以抑制微生物活性。此后,取1.0 mL样品于离心管中,以12 000 r/min的速度离心10.0 min。离心后取样品上清液,使用高效液相色谱仪对E2进行分析。如无额外说明,所有吸附实验均在此条件下进行。
等温吸附实验使用1.00 g/L的生物量吸附不同 浓 度 的E2溶 液(0.25、0.50、0.75、1.00、1.50、1.75、2.00 mg/L)。E2吸附在微生物上,吸附量G(mg/g) 可用式(1)计算。

式中:C0为E2的初始浓度,mg/L;Ce为E2的平衡浓度,mg/L;Cb为微生物浓度,g/L。
为评估pH值、生物量对E2生物吸附的影响。分别对初始pH值范围为4.0~10.0和初始生物量为0.08~1.20 g/L的样品进行吸附实验。
1.2.3 生物降解实验 为了评估碳源、H2O2、腐殖质及重金属对E2生物降解的影响,将1.00 mg/L E2和1.00 g/L微生物加入30 mL MSM的烧瓶中后,在避光条件下以160 r/min的转速在30 ℃的旋转摇床上培养。如无额外说明,所有生物降解实验均在此条件下进行。实验中,所加碳源为葡萄糖与甲酸钠,浓度为0.0、5.0、10.0、15.0、20.0、25.0、30.0、35.0、40.0、45.0、50.0 mg/L。H2O2的浓度为0.0、1.0、2.0、3.0、4.0、5.0、8.0、10.0、15.0、20.0 mmol/L,HA浓 度 梯 度 设 为 从0.0到50.0 mg/L不等。
为确定重金属(Zn2+、Cu2+、Pb2+和Cd2+)存在条件对微生物去除E2的影响,选择初始浓度分别为0.5、1.5、3.0、5.0、8.0、10.0、12.0、15.0 mg/L的重金属与1.00 mg/L E2 培养72 h,以阐明重金属对E2生物降解的影响。
所有实验在相同条件下进行,试剂及容器均在高压灭菌锅中以121 ℃灭菌30 min后使用。所有操作重复3次。
1.2.4 分析方法 采用配备 Waters symmetry-C18 反相柱(5 μm,4.6 mm×250 mm)和荧光检测器的高效液相色谱仪(Agilent Technologies1260)对E2进行定量分析。E2以1.00 mL/min的速度用流动相洗脱,在283 nm/345 nm的激发/发射波长下检测。流动相由含有0.1%三氟乙酸的乙腈和超纯水以60:40的比例混合而成。E2的检测限值为0.01 mg/L,所有样品的相对标准偏差在5%以内。吸附数据使用SigmaPlot 12.5进行拟合。
2 结果讨论
2.1 E2降解微生物Y2的鉴定
在对底泥样本中E2降解微生物Y2进行富集筛选后,对培养的菌株进行微生物种类鉴别,鉴别结果如图1所示,Y2为大肠杆菌。因此,以下实验均以从底泥样本中富集的大肠杆菌为降解菌种。
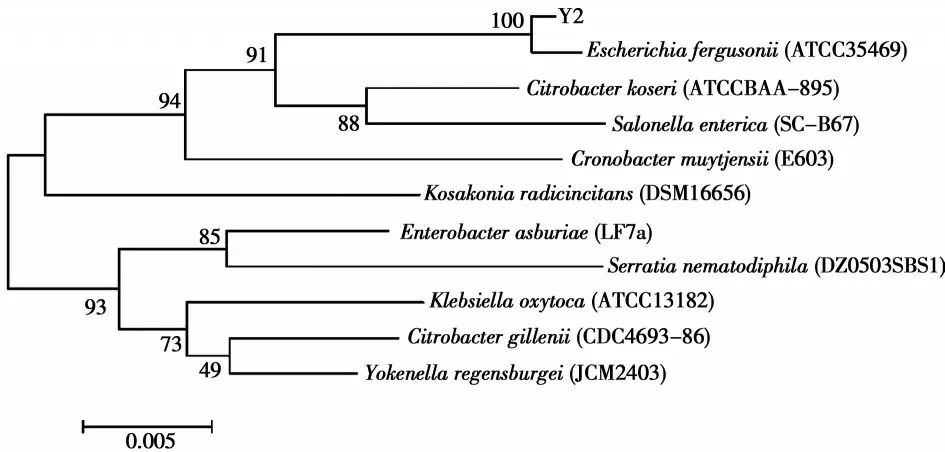
图1 E2降解菌Y2鉴定层次聚类树Fig. 1 The phylogenetic tree of E2 degrading bacteria Y2 identification
2.2 生物吸附和生物降解过程的鉴别
为明确生物吸附和生物降解过程对水溶液中E2去除率的贡献,首先,在30 ℃下进行了1.00 g/L大肠杆菌对1.00 mg/L E2的生物吸附实验,结果如图2所示。在最初15 min内,大肠杆菌吸附E2的速率较快,已达到吸附平衡总量的75%,随后吸附速率变缓,并在60 min时达到吸附平衡,在接下来的4 h内,E2的浓度几乎没有变化。大肠杆菌对E2最高吸附量为0.20 mg/g。因此,生物吸附是污水中E2去除的重要过程之一,对该过程的研究具有重要的工程指导意义。

图2 大肠杆菌对E2的吸附平衡曲线Fig. 2 E. coli adsorption equilibrium curve for E2
为了更好理解大肠杆菌对E2的生物吸附作用,在30 ℃下进行等温吸附实验。并根据E2两种不同的吸附模型,分别使用Freundlich和Langmuir等温线吸附模型进行拟合,结果见图3,具体参数见表1。这两种吸附等温线模型都较好地拟合了生物吸附E2过程。因此,研究中的生物吸附过程主要是细胞表面与E2之间的单层吸附过程[15-16]。在后续实验中,使用Langmuir等温方程计算不同时间细胞上的吸附量。

表1 两种不同的吸附模型拟合结果Table 1 Fitting results of two different adsorption models
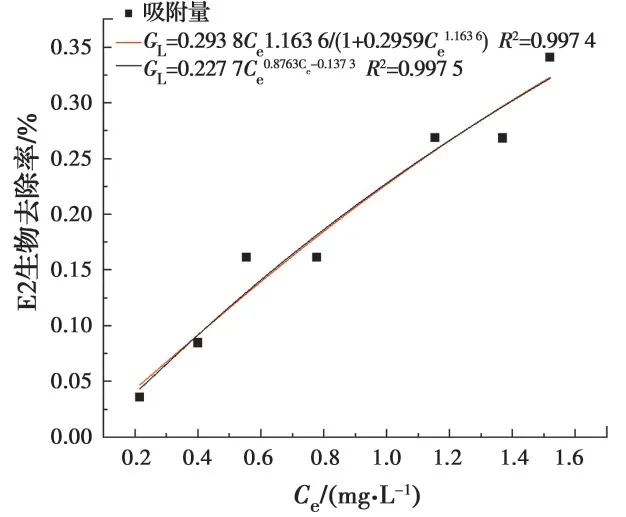
图3 两种不同的吸附模型拟合曲线Fig. 3 The fitting curves of two different adsorption models
在72 h的1.00 g/L大肠杆菌对1.00 mg/L E2生物去除实验中,生物降解率为生物去除率减去生物吸附率,结果如图4所示,表明在初期8 h内E2的去除主要归因于生物吸附作用。这可能是由于初期大肠杆菌处于适应期,生物降解速率较慢。随后生物降速率变快,E2浓度持续下降。72 h后生物降解率为63.74%,E2的剩余浓度约为0.30 mg/L。因此,生物对E2的去除是初期的快速生物吸附和生物降解的共同作用过程[17]。
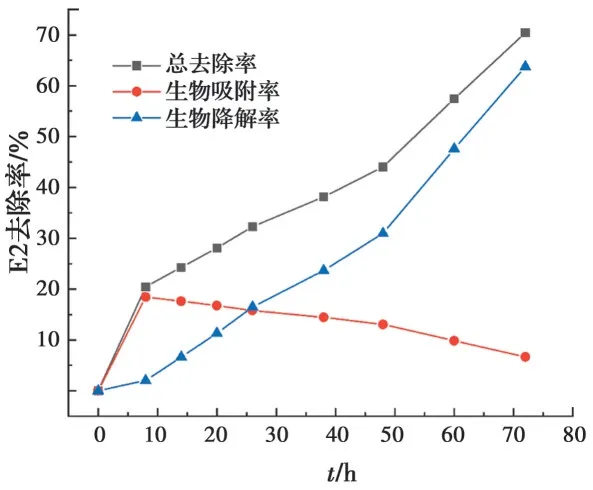
图4 E2的总去除率、生物吸附率及生物降解率Fig. 4 Total removal efficiency, biosorption efficiency and biodegradation efficiency of E2
2.3 pH值与生物量对E2生物吸附的影响
不同pH值和生物量对1.00 mg/L E2的生物吸附率如图5所示。图5(a)中,在酸性条件下,1.00 g/L大肠杆菌的生物吸附量随着pH值的增大逐渐从0.05 mg升高至0.12 mg。当pH值为8时,吸附效率突增至0.28 mg,pH值继续升高,吸附效率又急剧下降至0.06 mg。这是由于在酸性条件下高浓度的质子会与E2形成竞争吸附,且质子会与细胞表面的官能团结合成键,从而降低生物吸附率[18]。而pH值过高时,溶液中阴离子可能会与E2络合,导致生物吸附效率下降。因此,将pH值调整为8更有利于微生物对E2的吸附,进而促进微生物降解。在图5(b)中,生物量与E2的生物吸附效率呈明显正相关。生物量在0.08~1.20 g/L时,1 h内E2吸附效率从0.08 mg增加至0.21 mg。因此,增加生物量可以有效提高E2的生物吸附率。

图5 pH值与生物量对生物吸附的影响Fig. 5 Effect of pH value and biomass on the biosorption
2.4 E2的生物降解
2.4.1 碳源对E2生物降解的影响 持久性有机污染物流入水生环境,可抑制微生物的生长[19]。微生物需要一定时间去适应被污染的环境。然而,营养物质和SEs会形成共代谢机制来影响水环境中SEs的生物降解[20-21]。为加速E2的生物降解,研究了不同类型及浓度的碳源对E2生物降解的影响。由于培养72 h后残留E2浓度太低,无法区分有机碳源对生物降解的影响,因而选择48 h作为培养周期,结果见图6。在碳源的浓度范围为0.0~50.0 mg/L时,生物降解率呈现先增大后减小的趋势。其中,当达到10.0 mg/L甲酸钠和40.0 mg/L葡萄糖时,对E2的微生物降解促进效果最明显,分别提升26.31%和57.47%。主要是由于低浓度外界碳源的增加使微生物活性增加,加速了对E2的代谢过程。但是,降解率并不会随着碳源的增加而继续增大。可能的原因之一是当存在高浓度的外源有机碳时,微生物将主要代谢有机碳源,而减少了对污染物的代谢降解活动。因此,目标污染物的降解变得难以进行[22]。与甲酸钠相比,葡萄糖作为碳源更有利于微生物降解E2,降解率最高达到90.50%,这是因为大肠杆菌可以直接利用葡萄糖,而大肠杆菌需要适应甲酸钠后才能依靠其生长[23]。

图6 碳源对生物降解率的影响Fig. 6 Effect of carbon sources on the biodegradation efficiency
2.4.2 H2O2对E2生物降解的影响 已有研究表明[24],溶解氧对水生环境中SEs的微生物代谢过程非常重要。但精确定量溶解氧相对困难,为了控制溶解氧浓度梯度,选用H2O2作为补充氧源进行48 h实验[25],评估H2O2对E2降解可能造成的影响,结果见图7。结果表明,0.0~20.0 mmol/L H2O2仅可氧化 约0.50%~6.60% E2,而0.0~3.0 mmol/L H2O2与大肠杆菌存在协同作用,当达到3.0 mmol/L H2O2时,大肠杆菌和H2O2对E2的协同去除率达到最大值49.44%。当更高浓度的H2O2和大肠杆菌同时存在时会对生物降解产生明显抑制作用。当H2O2浓度增加到15.0 mmol/L时,E2的降解率仅为1.97%。添加低浓度H2O2后,由于溶解氧的增加提高了微生物的活性,从而获得更好的生物性能与更高的E2去除率。但H2O2浓度过高时,对细菌的强氧化作用破坏了细胞内的酶,从而抑制了生物活性,导致E2的生物降解率降低[26-27]。
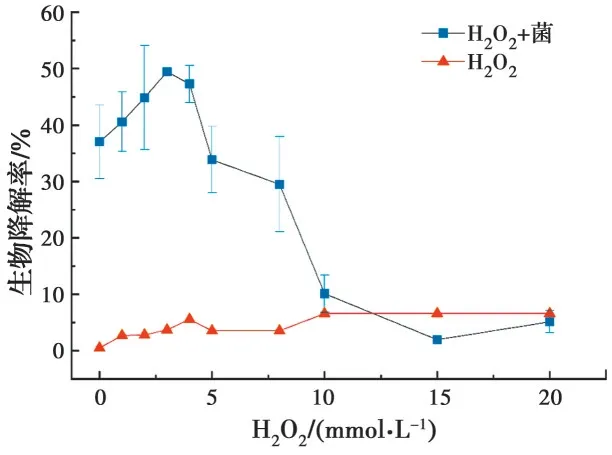
图7 H2O2对生物降解率的影响Fig. 7 Effect of H2O2 on the biodegradation efficiency
2.4.3 腐殖质对E2生物降解的影响 E2具有稳定的芳香结构,表现出较强的疏水性和极低的水溶性,很难被生物体利用,从而限制了生物降解技术的应用[28]。而腐殖质可能作为一种天然表面活性剂促进E2的生物降解[29-30]。因此,研究了72 h内不同浓度腐殖质对E2生物降解率的影响,见图8。结果表明,当LFA浓度在0.0~10.0 mg/L时,生物去除率最高提升了7.53%,总去除率为77.95%。而相同浓度下LHA对E2生物去除的促进效果更明显,最高提升21.91%,总去除率达到92.33%。标准品HA效果与其相似。主要存在以下原因:1)腐殖质可以调节细胞表面的疏水性,增强E2降解菌株的亲和力,使生物吸附和代谢得到改善;2)由于腐殖质中具有的亲水性和亲油性基团能在水溶液中形成聚合物胶团,使E2溶解在其中,增加其在水相中的溶解度,从而提高多环芳烃的生物可利用性[29]。不同腐殖质在0.0~10.0 mg/L浓度范围内对E2生物降解的促进作用排序如下: LHA>HA>LFA。这是由于它们各自的芳香结构不同,在其他多环芳烃降解研究中也发现了类似的结果[31]。而当腐殖质浓度的继续增加时,E2的生物降解率迅速下降,这主要由两方面导致:一方面,当更高浓度的腐殖质与MSM共存时,它们将与E2吸附结合形成包裹态物质,以抑制细胞和E2之间的直接接触;另一方面,高浓度的腐殖质会破坏各种生物酶,从而导致E2的生物降解率降低[25]。因此,与低浓度的腐殖质相比,高浓度的腐殖质对E2的去除具有抑制作用。

图8 腐殖质对生物降解率的影响Fig. 8 Effect of humic on the biodegradation efficiency
2.4.4 重金属对E2生物降解的影响 微量元素是维持微生物生长发育所必需的,可刺激微生物活动。但当单一微量元素过量时,对微生物具有很高毒性。研究了72 h内不同重金属对生物降解率的影响,见图9。由于污水中重金属含量相对自然水体较高,因此,实验浓度采用了高于自然水体的浓度水平。结果表明,较低浓度的Zn2+和Cu2+对E2降解有促进作用。因为Zn2+和Cu2+是许多生物学过程和酶活性过程的重要辅因子,对大肠杆菌的生长活性和稳定性至关重要[32]。但是,高浓度的Zn2+能显著抑制E2的微生物降解。这是由于高浓度的Zn2+能抑制微生物的代谢过程,并形成与E2的竞争性生物吸附,从而导致E2的生物吸附率及降解率下降[33]。而且高浓度的Zn2+比Cu2+有更明显的抑制作用,这与之前的研究有相似的趋势[34]。相比之下,即使Pb2+和Cd2+的浓度很低也会强烈抑制E2的微生物降解。这是因为它们对水生动物、植物及微生物有较大的毒性,会抑制微生物的生长和酶的活性,从而降低E2的生物降解率[35-36]。不仅如此,除了抑制代谢外,Pb2+和Cd2+的同步生物吸附同样会与E2形成竞争关系,使得E2的生物去除率降低[33]。

图9 重金属对生物降解率的影响Fig. 9 Effect of heavy mental on biodegradation efficiency
3 结论
1)大肠杆菌是洱海底泥中的E2降解优势菌种,E2的生物去除过程由生物吸附及生物降解两部分组成。
2)生物吸附过程主要受pH值、生物量和E2浓度限制。其中吸附过程对pH值具有明显的依赖性,与生物量和E2浓度则呈明显正相关。弱碱性下(pH=8)吸附效率最为显著,约是酸性和强碱性的2~5倍,可达0.28 mg/g。
3)当 葡 萄 糖、甲 酸 钠、H2O2、腐 殖 质、Zn2+和Cu2+浓 度 分 别 为40.0 mg/L、10.0 mg/L、3.0 mmol/L、2.0~15.0 mg/L、0.5 mg/L及0.5 mg/L时,E2的生物降解率提高近12.41%~57.47%。而当浓度过高时即产生明显抑制作用。另外,Pb2+或Cd2+在低浓度就会产生强烈抑制效果。

