圆苞车前子壳粉对鱼糜凝胶热稳定性的影响及机理研究
朱士臣,陈小草,郑佳妮,李伟,范文龙,丁玉庭,周绪霞*
1(浙江工业大学 食品科学与工程学院,浙江省深蓝渔业资源高效开发利用重点实验室,国家远洋水产品加工技术研发分中心(杭州),浙江 杭州,310014) 2(浙江渔福食品有限公司,浙江 杭州,310014)
近年来,即食食品需求量日益增大。其中即食鱼糜制品是以鱼肉为原料,经漂洗、斩拌、灌肠、凝胶化加热、杀菌等工序加工而成的凝胶类制品[1]。生产即食鱼糜制品的前提是产品无致病菌且具有较长保质期,其中高温灭菌是最有效的处理方式。ZHANG等[2]研究发现高温处理会改变鱼糜蛋白三维网络结构进而破坏其凝胶特性,导致鱼糜制品品质降低。此外,高温处理还可使鱼糜凝胶中蛋白含量显著降低且持水性下降[3]。为了降低高温处理对鱼糜制品的不利影响,提高产品的热稳定性,目前多以添加外源性添加物(多糖、蛋白、淀粉、预乳化油脂等)为主,鱼糜制品热稳定性的增强程度有限。
圆苞车前子壳粉(psyllium husk powder,PHP)来源于圆苞车前的干燥成熟种子外壳,因其具有丰富的营养功能特性而引起人们关注。PHP于2014年被国家卫计委列为新食品原料,富含膳食纤维、黄酮类、环烯醚萜类和多糖等成分,具有润肠通便、降低血脂和血糖等作用[4-5]。圆苞车前子多糖属于阴离子多糖,富含木糖和阿拉伯糖,是一种亲水性胶体[6]。周扬等[4]研究发现,添加PHP可以明显改善猪肉糜的质构特性及持水性。朱亚军等[7]研究发现添加0.1% PHP可以显著增加鱼糜凝胶的硬度。这表明PHP较强的持水性和吸水膨胀能力有利于肉糜制品形成致密的凝胶网络,提高产品品质。然而,当前研究主要围绕PHP对肉糜凝胶品质的影响,关于PHP对鱼糜制品热稳定性的影响及热稳定机制有待进一步探索。
前期的研究结果表明,添加一定程度的预乳化油脂能够保持脂质的结构稳定以及增强鱼糜的凝胶特性,但对于乳化油脂的种类及乳化程度对鱼糜凝胶热稳定性的影响尚未报道[8-9]。基于此,本文以冷冻鳕鱼鱼糜为研究对象,将PHP与油脂预乳化处理相结合,研究不同PHP添加量对高温处理鱼糜凝胶的质构特性、动态流变学特性及热稳定性等的影响,并从分子间作用力、水分分布状态及鱼糜蛋白二级结构等角度,分析不同PHP添加量对鱼糜凝胶热稳定性的影响机制。研究结果可为即食型功能化鱼糜制品的开发提供一定的借鉴。
1 材料与方法
1.1 材料与试剂
冷冻鳕鱼鱼糜购自浙江渔福食品有限公司,其水分含量为(74.12±0.24)%;圆苞车前子壳粉购自沧州乡韵食品科技有限公司,粒径(4.56±0.16)μm,其中蛋白质(0 g/100 g),脂肪(7.2 g/100 g),膳食纤维(90.5 g/100 g),钠(16 mg/100 g);紫苏籽油,河北家丰植物油有限公司;其余化学试剂均为国产分析纯。
1.2 仪器与设备
HR2850型飞利浦打浆机,珠海经济特区飞利浦家庭电器有限公司;CR21GⅡ高速冷冻离心机,日本日立公司;HH-1型数显恒温水浴锅,江苏省金坛市江南仪器厂;TA-XT2i型食品物性测试仪,英国Stable Micro System公司;MCR302型高级拓展流变仪,奥地利安东帕有限公司;Q100型差示扫描量热仪,美国TA公司;UV-VIS型紫外可见分光光度计,上海美谱达仪器有限公司;MesoMR21-060H-I核磁共振成像分析仪,上海纽迈电子科技有限公司;HR 800 Lab RAM 显微共焦激光拉曼光谱仪,法国Jobin-Yvon 公司。
1.3 实验方法
1.3.1 肌原纤维蛋白的提取
参考周扬等[4]的方法并稍作修改。配制蛋白提取缓冲液A(0.1 mol/L NaCl,1 mmol/L EGTA,2 mmol/L MgCl2和10 mmol/L Na3PO4,pH 7.0)、溶液B(0.1 mol/L NaCl)。用3倍体积的A液将鱼糜搅拌洗涤后过滤,重复3次以除去杂蛋白质和其他物质。用3倍体积的B液洗涤,用2层干净的纱布过滤后,取蛋白悬浮液于4 000 r/min、4 ℃下冷冻离心15 min,沉淀即为提纯的肌原纤维蛋白,4 ℃冷藏备用。肌原纤维蛋白提取过程需控制在4 ℃条件下进行,并在2 d内使用。
1.3.2 预乳化油脂的制备
将1.3.1制备的肌原纤维蛋白质量浓度调节为30 mg/mL,以肌原纤维蛋白为乳化剂对紫苏籽油进行预乳化。将乳化液分为5组,每组乳液中肌原纤维蛋白添加量控制为10 mL,紫苏籽油为1.2 g(占油脂总添加量的40%),混合后分别于10 000 r/min乳化均质1 min。
1.3.3 鱼糜-脂质复合凝胶的制备
参考ZHOU等[8]的方法并稍作修改。分别取5份100 g的冷冻鱼糜,4 ℃半解冻后切成约1 mm×1 mm×1 mm的小块放入打浆机内。每份均添加2.5%食盐、1.3.2制备的乳化液,水分调节至78%。PHP于盐擂阶段以粉末状态直接添加至鱼糜体系中,控制添加量分别为0.25%、0.5%、0.75%和1%(以湿基鱼糜质量计),其中未添加PHP的样品为对照组。混合样品于3 000 r/min斩拌5 min(整个过程控制斩拌温度在8 ℃以下)。将斩拌后的鱼浆灌入胶原蛋白肠衣内(Φ22 mm),排走气泡后两端扎紧,采用两段式加热(40 ℃,1 h;90 ℃,20 min),置于高压灭菌锅115 ℃灭菌15 min,随后立即冷却,于4 ℃冰箱中冷藏过夜,分析各项指标。
1.3.4 凝胶强度
将鱼糜凝胶切成Φ22 mm×20 mm的圆柱体,在室温下平衡30 min后采用TA-XT2i型物性测试仪测定凝胶强度[10]。参数设定如下:探头P/5S;测前速度1.00 mm/s;测试速度2.00 mm/s;测后速度10.00 mm/s;位移15 mm;触发力10 g。每组样品平均测定10次取平均值。
1.3.5 持水性
采用离心法测定凝胶的持水性[4]。将凝胶切成约5 mm×5 mm×5 mm的小块,准确称取质量为m1(约3 g)凝胶,用2层滤纸包裹装入离心管,10 000 r/min离心10 min,取出凝胶并用滤纸擦除表面水分后准确称量,测得离心后凝胶的质量为m2。凝胶持水性的计算如公式(1)所示:
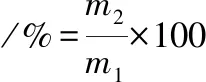
(1)
1.3.6 质构
将鱼糜凝胶切成Φ22 mm×20 mm的圆柱体,在室温下平衡30 min后采用TA-XT2i型物性测试仪测定凝胶的质构[11]。参数设定如下:探头P/36R;测前速度1.00 mm/s;测试速度2.00 mm/s;测后速度10.00 mm/s;应变50%;触发模式:自动(力);触发力10 g。每组样品平均测定10次取平均值。
1.3.7 流变学特性
采用MCR302型高级拓展流变仪测定鱼糜的流变特性[12]。首先将样品均匀地涂布在测试平台上,去除气泡,采用25 mm平板测试。测试参数为:频率0.1 Hz;应变2.85%;上下狭缝1 mm。样品由20 ℃以4 ℃/min恒定速度升温至120 ℃,记录鱼糜在加热过程中储能模量(G′)随温度升高的变化情况。
1.3.8 热稳定性
参考JIAN 等[13]的方法并稍作修改。准确称取15 mg斩拌好的鱼糜样品于铝坩埚内,以同等质量的空坩埚做参比。升温速率:10 ℃/min,温度范围:20~120 ℃。整个过程在干燥N2下进行,吹扫气速率20 mL/min,保护气速率60 mL/min。
1.3.9 微观结构
将鱼糜凝胶切为厚度约1 mm的薄片,于2.5%戊二醛中浸泡固定24 h,用磷酸缓冲液(0.1 mol/L,pH 7.2)漂洗3次,每次计时10 min。随后依次用50%、70%、80%、90%及100%(体积分数)梯度乙醇进行洗脱,每次计时15 min。最后将处理好的样品进行冷冻干燥,干燥后的样品用导电双面胶固定于样品台,经溅射仪喷金后,置于扫描电镜下观察[14]。
1.3.10 化学作用力
鱼糜凝胶化学作用力的测定参考徐祖东等[15]的方法:鱼糜凝胶样品各取2 g,分别加入10 mL 0.05 mol/L NaCl(SA)、0.6 mol/L NaCl(SB)、0.6 mol/L NaCl+1.5 mol/L 尿素(SC)、0.6 mol/L NaCl+8 mol/L尿素(SD)、0.6 mol/L NaCl+8 mol/L尿素+0.05 mol/L β-巯基乙醇(SE),混合均匀之后均质1 min,于4 ℃条件下静置1 h,然后在10 000×g的转速下离心15 min。用考马斯亮蓝法测定上清液中蛋白质的含量。
离子键、氢键、疏水相互作用和二硫键贡献表示如下:离子键贡献=溶解于SB中的蛋白质含量-SA中的蛋白质含量;氢键贡献=溶解于SC中的蛋白质含量-SB中的蛋白质含量;疏水相互作用贡献=溶解于SD中的蛋白质含量-SC中的蛋白质含量;二硫键贡献=溶解于SE中的蛋白质含量-SD中的蛋白质含量。
1.3.11 低场核磁共振(low field nuclear magnetic field,LF-NMR)
采用MesoMR21-060H-I型核磁共振成像分析仪进行T2弛豫时间测定[16]。将鱼糜凝胶切成约2 cm的长度,准确称取其质量,放入直径为60 mm的核磁共振专用试管,然后置于永久磁场中心位置的射频线圈的中心,利用标准油样进行预扫描,寻找磁场中心频率及磁场脉冲宽度,利用CPMG脉冲序列测定样品的自旋-自旋弛豫时间T2,测定条件为:主频率SF=23 MHz,90°脉冲射频脉宽P1=11 μs,180°脉冲射频脉宽P2=21.52 μs,信号采样点数TD=600 032,采样频率SW=250 kHz,采样间隔时间TW=4 000 ms,回拨个数NECH=12 000,累加次数NS=2。重复采集3次获取测定样品的T2弛豫时间。利用核磁共振反演软件进行反演得到T2反演图谱,并对信号强度进行质量归一化处理。
1.3.12 拉曼光谱
拉曼光谱通过HR 800 Lab RAM激光拉曼分析仪(配备531.95 nm 氩离子激光光源分析)测定[8]。测试的功率为20 mW,光谱获取条件为:开孔200 μm,光栅600 g/mm,扫描3次,积分时间60 s,分辨率2 cm-1,数据获取速度120 cm-1/ min,获取的拉曼光谱范围500~4 000 cm-1。测试完成后用Labspec 软件对拉曼光谱数据进行处理(平滑,多点基线校正去除荧光背景)。
1.4 统计分析
采用Excel 2007对数据进行整理;SPSS 19.0对数据进行方差分析;Duncan法进行多重比较(P<0.05表示差异显著);Origin 8.6绘图。
2 结果与分析
2.1 凝胶强度
凝胶强度是反映鱼糜制品品质的重要指标之一。如图1-a所示,相较于对照组,添加一定量的PHP(0%~0.5%)能显著增强鱼糜凝胶强度(P<0.05)。PHP添加量为0.5%时,鱼糜凝胶强度从对照组的1 547.75 g·mm提升至2 204.88 g·mm,提高约42.46%。PHP添加量为0.75%时,凝胶强度有所降低,但仍高于对照度。但随PHP用量进一步增至1%,凝胶强度显著低于对照组(P<0.05)。这或许是高温处理会诱导鱼糜肌原纤维蛋白的展开,更多的疏水基团暴露,从而使车前子多糖在高温条件下能够与肌原纤维蛋白相互作用,且壳粉中适量膳食纤维填充到蛋白凝胶网络中,使得凝胶强度增加;而随着PHP的过量添加(>0.75%),大量膳食纤维填充到蛋白凝胶网络中,致使鱼糜体系中蛋白质和多糖产生相分离,导致凝胶强度降低[10,17]。因此,壳粉可作为新型多糖用于替代淀粉,用于增强鱼糜凝胶强度。
2.2 硬度和持水性
凝胶硬度是仪器模拟口腔二次挤压凝胶形变所需要的力,硬度变化表明凝胶质地发生改变[11];持水性是反映鱼糜凝胶品质的重要指标,表明凝胶内部结构对鱼糜体系所含水分的截留能力,能在一定程度反映鱼糜凝胶三维网状结构的致密程度。如图1-b所示,高的持水性表明凝胶内部结构致密,具有较好的锁水能力。

a-凝胶强度;b-硬度与持水性;c-储能模量(G′);d-热稳定性图1 圆苞车前子壳粉添加量对鱼糜凝胶强度、硬度与持水性、流变特性及热稳定性的影响Fig.1 Effects of the addition of PHP on gel strength, hardness and water holding capacity,rheological properties and thermal stability of surimi gel
当PHP添加量占鱼糜质量0.5%时,鱼糜凝胶硬度和持水性最高。适量PHP能够吸收蛋白网络结构中的水分,提高鱼糜凝胶的持水性[4]。因PHP持水溶胀性较强,添加到鱼糜体系中会形成一定的腔室结构,并填充至蛋白三维凝胶网络结构中,对鱼糜体系具有一定的稳定作用,从而增强鱼糜凝胶的硬度和持水性[18]。此外,PHP结构具有丰富的亲水性基团,也赋予鱼糜凝胶较高的持水性。但PHP添加量过大(>0.75%),会导致鱼糜体系中蛋白质和多糖产生相分离,形成具有大孔隙和通道的不连贯基质,凝胶网络在一定程度上被破坏,凝胶保水性下降[10]。周扬等[4]研究发现低壳粉添加量(0.5%~1.0%)能够增加肌原纤维蛋白凝胶网络的致密性,改善猪肉糜凝胶的保水性,提高产品凝胶性能,与本研究结果一致。
2.3 动态流变学特性
储能模量(G′)反映鱼糜蛋白凝胶网络形成情况,表明凝胶弹性特征,又被称为弹性模量,其中G′值与凝胶性能呈正相关[19]。图1-c为不同PHP添加量鱼糜凝胶在加热过程中(20~120 ℃)G′值的变化。在一定温度下,5组鱼糜样品G′值随PHP添加量的增加表现出先增加后下降趋势,且壳粉添加量为0.5%时,G′值最大,表明其形成了结构更坚固的鱼糜凝胶。这与PHP中的不溶性膳食纤维、胶体成分可以有效填充到凝胶网络中,使其结构更加致密有关。G′值随PHP添加量的变化趋势与质构测试结果相似,这进一步证实了鱼糜凝胶特性与PHP浓度的依赖关系。
从动态流变学曲线可以看出,所有组别的鱼糜凝胶样品G′值具有相似的动态温度扫描曲线,均有3个不同阶段组成:在36~44 ℃,5组样品的G′值均呈增加趋势,但增幅程度不同。这是由于肌球蛋白轻链发生解离,肌球蛋白头部互相结合,同时鱼糜蛋白分子间发生交联,弱凝胶网络结构初步形成[12]。而加入少量PHP后,PHP与鱼糜中水分结合,形成黏稠状凝胶,加固了鱼糜刚形成的微弱凝胶网络结构;在44~52 ℃,5组样品的G′值均快速下降,表明该温度范围达到了内源蛋白水解酶的最适温度,部分肌原纤维蛋白发生降解,氢键被破坏,肌球蛋白尾部展开,流动性增强,致使凝胶网络结构暂时性恶化。此温度区间为鱼糜凝胶劣变温度,在加热过程中应尽快通过;在52~120 ℃,随温度上升,G′值急剧升高,这是由于肌球蛋白和肌动蛋白重链变性伸展,疏水相互作用、二硫键及非二硫共价键等重要化学键逐步形成,使鱼糜体系形成稳定有序的热不可逆凝胶网络结构。
2.4 热力学特性
热变性是鱼糜蛋白形成凝胶的先决条件。通过差示扫描量热(differential scanning calorimetry,DSC)分析可直接反映鱼糜凝胶结构对热处理的抵抗能力[13]。添加不同量PHP的鱼糜凝胶DSC谱图中(图1-d)5组样品在加热过程中均出现一个明显的吸热峰,其中添加0.5% PHP的鱼糜凝胶相转变温度Tmax为116.5 ℃,显著高于对照组Tmax108 ℃(表1),这可能是由于PHP中所含多糖与鱼糜蛋白间相互作用,形成更为致密的蛋白质三级结构,其空间构象不易被破坏,从而增加了凝胶的热稳定性。但进一步增加PHP添加量,与鱼糜肌原纤维蛋白发生相分离,导致鱼糜凝胶网络结构不均一,从而使Tmax显著降低。

表1 圆苞车前子壳粉添加量对鱼糜凝胶热力学特性的影响Table 1 The influence of the addition amount of PHP on the thermodynamic properties of surimi gel
2.5 微观结构
PHP添加量对鱼糜凝胶微观结构的影响如图2所示。
对照组鱼糜凝胶网络结构较为松散,表面断裂较多且粗糙不平整;适量PHP(0~0.75%)的添加使鱼糜凝胶的三维网络结构更加紧凑,孔洞大小和分布更加均匀。这是因为高温处理促使鱼糜蛋白结构展开,暴露出更多疏水基团,肌原纤维蛋白与多糖间的相互作用增强,从而使得鱼糜凝胶结构更加致密有序[14]。与此同时,PHP属于亲水性阴离子多糖,在高温处理过程中能够通过氢键作用使游离水向不易流动水和结合水转变,使鱼糜凝胶变得更为紧密牢固,凝胶的保水性提高,这与上述实验结果相一致。
2.6 化学作用力
鱼糜凝胶的三维网络结构由肌原纤维蛋白及其聚集体间的分子力协同维持。鱼糜凝胶的微观结构在高温处理过程中不可避免被破坏,这与高温处理对蛋白质分子间作用力如离子键、氢键、疏水相互作用、二硫键产生的影响密切相关[20]。如图3所示,凝胶中疏水相互作用与二硫键占比较大,表明两者对维持鱼糜凝胶体系的热稳定性具有重要作用;而离子键和氢键属分子间弱相互作用,易被高温破坏,因而不是维持凝胶稳定的主要化学作用力[21]。
与对照组相比,PHP添加量对鱼糜肌原纤维蛋白间的化学作用力影响显著。随PHP添加量增加,离子键、疏水相互作用与二硫键呈先上升后下降趋势,氢键呈先下降后上升趋势。离子键主要稳定蛋白质的三、四级结构。实验组离子键含量变化是由于适量PHP(阴离子多糖)与其相反带电氨基酸发生静电相互作用,致使鱼糜凝胶离子键显著增加;随PHP含量继续增加,PHP与肌原纤维蛋白的静电斥力增加,从而不利于有序鱼糜凝胶体系的形成。氢键在蛋白质二级结构中起重要作用。高温处理会破坏鱼糜肌原纤维蛋白间的氢键作用,而随着PHP添加量的增加,PHP丰富的亲水性基团与蛋白间氨基、羧基发生逐渐增强的氢键相互作用[15]。实验组凝胶疏水相互作用增加是由于加入PHP有利于促进油水乳化,使鱼糜体系中盐溶性蛋白逐渐向界面转移,油脂中不饱和脂肪酸引起更多色氨酸残基暴露,形成极性环境,促进蛋白质构象变化及其相互作用,增强热诱导蛋白质的聚集程度;随PHP含量增加,肌球蛋白对壳粉接触面积增大,会覆盖凝胶中暴露的疏水基团,从而降低凝胶的疏水相互作用[22]。二硫键的增加主要是由于蛋白质在高温处理下结构展开,导致更多的巯基暴露,从而氧化生成二硫键。而随着PHP添加量的增加,两者增强的相互作用抑制了肌原纤维蛋白结构的展开,从而使二硫键作用减弱[23]。
2.7 水分分布
利用LF-NMR可以测定鱼糜凝胶中的水分分布和流动性变化。凝胶的核磁衰减信号被拟合为3个峰,分别代表结合水(T2b)、不易流动水(T21)和自由水(T22)[16]。图4显示了以0.1~10 ms(T2b)、10~100 ms(T21)和100~1 000 ms(T22)为中心的鱼糜凝胶T2弛豫时间分布图。横向弛豫时间T2大小可反映水分自由度,T2时间越长水分自由度越高;P2为3种不同状态水分的相对含量,可以反映凝胶中水分的相互转化情况,表征凝胶保水性变化。与对照组相比,添加少量PHP(0%~0.5%)的处理组中P22均减小,而P2b和P21增大(表2)。这表明适量PHP能降低凝胶中水分自由度,增强结合水和不易流动水与蛋白质结合的能力。或许由于凝胶中原有的不易流动水与鱼糜蛋白结合紧密,PHP属于亲水性多糖,在热处理过程中通过氢键与大量自由水相结合,使其转变为不易流动水和结合水,使肉糜体系变得更为紧密牢固,凝胶的保水性提高[24]。但在PHP添加量较高时,PHP的强吸水溶胀性及大量膳食纤维存在使蛋白质和多糖发生相分离,形成具有大孔隙和通道的不连贯基质,凝胶网络致密性降低,结合水和不易流动水占比降低,凝胶保水性下降。

图4 圆苞车前子壳粉添加量对鱼糜凝胶水分分布的影响Fig.4 The effects of the addition amount of PHP on water distribution of surimi gel

表2 圆苞车前子壳粉添加量对鱼糜凝胶横向弛豫时间(T2)及水分相对含量(P2)变化的影响Table 2 Effects of the addition amount of PHP on the transverse relaxation time (T2) and the change of relative moisture content (P2) of surimi gel
2.8 圆苞车前子壳粉对鱼糜凝胶蛋白质二级结构的影响
利用拉曼图谱分析了不同PHP添加量对鱼糜蛋白构象的影响(图5)。结果表明,添加PHP使鱼糜蛋白的二级结构发生明显变化。鱼糜凝胶中添加少量PHP促使鱼糜蛋白的α-螺旋结构向β-折叠和无规则卷曲结构转变。其中α-螺旋结构向无规卷曲结构的转变导致包埋于蛋白质分子内的疏水性残基暴露,疏水作用力增加,鱼糜凝胶热稳定性提高[25-26]。ZHOU等[8]研究报道α-螺旋含量降低,β-折叠含量升高与鱼糜凝胶硬度增加密切相关。原因为β-折叠结构表面积更大,水化强度较弱,有利于蛋白之间发生交联,形成更加致密的鱼糜凝胶网络结构。

a-拉曼图谱;b-二级结构含量图5 圆苞车前子壳粉添加量对鱼糜凝胶拉曼光谱及二级结构含量的影响Fig.5 Effects of the addition amount of PHP on Raman spectra and secondary structure content of surimi gel
3 结论与讨论
本文研究了PHP添加量对高温处理的鱼糜凝胶品质的影响,并从分子间作用力、水分分布以及二级结构等方面揭示了PHP增强鱼糜凝胶热稳定性机制。鱼糜凝胶强度、硬度、持水性、储能模量(G′)和热变性温度与PHP添加量表现出非线性的浓度依赖关系。在PHP添加量为0.5%时上述凝胶特性最大。疏水相互作用和二硫键是维持鱼糜凝胶热稳定性的主要作用力;PHP可通过影响鱼糜肌原纤维蛋白的二级结构以及降低凝胶体系中水分自由度,促使自由水向不易流动水和结合水转变,从而增强鱼糜凝胶的热稳定性。本研究可为即食型功能化鱼糜制品的开发提供借鉴。

