长喙壳菌侵染对不同抗性甘薯细胞壁的影响
赵梅慧,庞林江,成纪予,陆国权,路兴花,王孙杰
(1.浙江农林大学 食品与健康学院,杭州 311300;2.绍兴市农业农村信息中心,浙江 绍兴 312099)
甘薯〔Ipomoea batatas(L.)Lam.〕是世界上第七大主要粮食作物,也是一种重要的饲用和工业原料作物,中国是世界上最大的甘薯生产国。甘薯投入低、产量高、适应性强,对保障我国粮食安全具有重要的作用[1-2]。甘薯在栽培和贮藏过程中容易感染多种病原菌,由甘薯长喙壳菌(Ceratocystis fimbriata)引起的黑腐病是世界范围内破坏性较强的病害之一[3-5],几乎没有品种可以避免染病[6],黑斑病对甘薯生产造成严重的损失,且目前没有有效的杀菌剂,无论采用何种繁殖、种植和贮藏技术,防治甘薯黑腐病都是一项严峻的挑战[4]。甘薯受黑斑病菌侵染后,会产生甘薯酮、甘薯宁、甘薯醇、4-薯醇等耐高温的毒素,这些有毒物质无法通过加工处理等手段来破坏,极易导致人畜中毒[5]。
植物细胞壁是由纤维素、半纤维素、果胶等高分子多糖和蛋白质组成高度复杂的动态网络,也是病原菌入侵的第一道屏障,以及寄主与病原菌相互作用的重要场所,在植物感受和抵抗病原菌过程中起着重要作用[7-9]。植物细胞壁的完整性、重塑性一定程度可以反映出衰老和逆境响应的情况,逆境胁迫会引起细胞壁修饰,启动防御反应[9]。很多研究表明,甘薯细胞壁的结构和生理特征会影响甘薯的腐烂率和耐贮性,甘薯贮藏期间,原果胶含量降低,纤维素酶活性增加,如果在贮藏中保持原果胶含量,就可以提高甘薯的贮藏品质[10-11],甘薯原果胶是影响甘薯质地、衡量衰老及耐贮性的重要指标[12],耐贮性好的品种具有较高的纤维素含量和木质素含量,木质素含量也是影响耐贮性的因素之一[11]。“烟薯25”和“心香”是目前常见的优质甘薯品种,有研究认为“烟薯25”为抗病品种[13],“心香”为感病品种[14],可能具有不同的抗性,但没有直接对比2个品种抗性的相关报道。文中以2个甘薯品种为试验材料,通过人为接种甘薯长喙壳菌,研究不同品种甘薯贮藏期感染黑斑病后细胞壁相关变化特征,以期为阐明长喙壳菌侵染机理和甘薯贮藏病害的防治提供理论参考,促进甘薯产业的健康发展。
1 实验
1.1 供试材料
供试甘薯品种为“心香”和“烟薯25”,由浙江农林大学薯类研究所板桥基地种植,统一采收后运送到实验室,愈伤后选取大小均匀适中、无病虫害、无机械损伤的个体,洗净表皮泥土后用体积分数为75%酒精溶液擦拭消毒,沥干备用。甘薯长喙壳菌(C. fimbriata)由江苏徐淮地区徐州农业科学研究所提供。
1.2 试剂与仪器
主要仪器设备:SW-CJ-1CU 双人水平送风净化工作台,苏州苏洁净化设备有限公司;LDZX-50KBS立式高压蒸汽灭菌器,上海申安医疗器械厂;DRP-9162 型电热恒温培养箱,上海森信实验仪器有限公司;智能低温冷藏箱,宁波普朗特仪器有限公司;XSZ-H 生物显微镜,重庆光电仪器有限公司;UV-2802 紫外可见分光光度计,尤尼柯(上海)仪器有限公司;3K15 台式高速冷冻离心机,德国Sigma公司;SU8010-冷场扫描电镜,日本日立公司。
主要试剂:硫酸、咔唑、多聚半乳糖醛酸、无水乙醇、3, 5-二硝基水杨酸、乙酸钠、氯化钠、木聚糖、水杨苷、蒽酮、羧甲基纤维素钠(CMC)等均为分析纯,葡萄糖、木糖、半乳糖醛酸均为标准品,购于国药集团化学试剂有限公司。
1.3 菌种制备和接种
将病原菌在28 ℃的PDA 培养基上活化培养7 d后备用。
利用培养好的长喙壳菌分生孢子制备长喙壳菌的孢子悬浮液(1×106CFU/mL),使用灭菌打孔器在甘薯赤道附近等距离制造3 个直径为5 mm、深度为5 mm的损伤,采用无菌注射器向损伤处注射25 μL 菌悬液,每个品种处理5 个薯块,晾干后置于温度为28 ℃、相对湿度为80%的环境中贮藏15 d。将对照组(CK)制造相同损伤后,向损伤处注入等量无菌水。
1.4 指标测定
病斑调查:用游标卡尺逐个测量病斑表面直径、病斑内部(表皮层下)直径、病斑侵入深度、病斑组织腐烂量。每组处理用5 个薯块的平均值表示其测定值,病斑综合直径是表面直径和内部直径的平均值[15],单位为mm。
腐烂指数:依甘薯腐烂的面积划分为0—5 级:0级(无腐烂)、1 级(腐烂的面积≤10%)、2 级(腐烂的面积介于10%~30%)、3 级(腐烂的面积介于30%~50%)、4 级(腐烂的面积介于50%~70%)、5级(腐烂的面积≥70%)[16],单位为%。计算方法:

硬度测定:采用GY-4 数显水果硬度计,探头直径为8 mm,预压速度和下压速度均为2 mm/s,起始力为0.1 N,在每个甘薯赤道部分的病变部位进行测定,每组测定15 次,单位为N。
果胶物质含量测定:参考曹建康等[17]的方法,以鲜基的质量分数表示,单位为%。
木质素、纤维素含量测定:参考韩敏等[18]的方法,以干基的质量分数表示,单位为%。
纤维素酶(Cx 酶)、β-葡萄糖苷酶(β-Glu 酶)活性测定:参考曹建康等[13]的方法,用鲜样测定表示,单位为mg/(h·g)。
1.5 数据处理
每个样品指标测定均重复3 次。采用Excel 进行统计作图,并用SPSS 22.0 统计软件进行显著性分析,P<0.05 表示显著性差异。
2 结果与分析
2.1 长喙壳菌侵染不同品种甘薯后黑斑病发病症状
周佳明等[15]从年度间鉴定结果的吻合率、接近度、一致性与稳定性,以及对其他方法的代表性角度,认为用病斑内部直径和病斑表面直径作指标是较好的鉴定抗性方法;从鉴定结果的稳定性,以及与其他方法的一致性看,认为用综合病斑直径分级法优于表面病斑分级法。甘薯黑斑病抗性常采用破损接种后15 d 发病情况来鉴定[15,19],接种长喙壳菌15 d 后,测定分析甘薯黑斑病发病情况(表1),甘薯品种“烟薯25”对长喙壳菌侵染抗性与“心香” 对长喙壳菌侵染抗性具有较大的差异性。根据观察需要,图1 进一步展示了甘薯“心香”和“烟薯25”在接种后第0、6、12 和15 天的病斑处横截面,可明显观察到在贮藏后期,“心香”病变程度高于“烟薯25”,其中在贮藏第15 天,“心香”的腐烂指数高达86.7%,较“烟薯25”显著高出23.3%。该研究结果表明,“烟薯25”的病斑内部直径、病斑深度和腐烂指数显著低于“心香”的,且病斑表面直径和综合直径小于“心香”的。众多数据均可以表明,甘薯品种“烟薯25”对黑斑病的抗性大于“心香”对黑斑病的抗性。
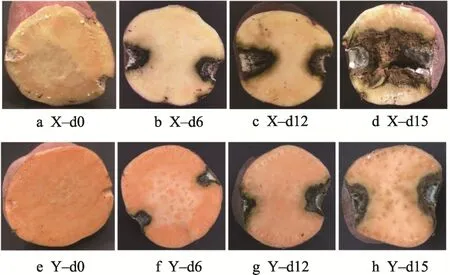
图1 染菌后甘薯随贮藏时间的病斑变化Fig.1 Changes of disease spots of sweet potato with storage time after infection

表1 甘薯黑斑病症状Tab.1 Symptoms of sweet potato with black rot
2.2 长喙壳菌侵染对不同抗性甘薯硬度的影响
硬度是果实非常重要的一项品质指标,细胞壁的结构组成是影响果实硬度主要因素之一[20]。果实软化会降低果实的抗病性,缩短果实的货架寿命。由图2 可知,甘薯硬度变化随贮藏时间呈先升后降的变化趋势,在第3 天时达到峰值。可能是由于初始甘薯愈伤,促使甘薯组织硬度增加,后期由于不断衰老和病变,硬度逐渐降低。不同抗性品种存在显著差异,贮藏期间甘薯品种“烟薯25”的硬度比“心香”的显著高出18.4%~26.2%;同时发现,染菌后“心香”甘薯硬度后期下降较快,在贮藏第15 天时,相较于对照组,甘薯“心香”的硬度降低了17.5%,“烟薯25”的硬度降低了11.1%。甘薯硬度的降低表明其细胞壁正在解体,组织结构变得松散,贮藏后期“心香”硬度降低更加显著,这也可能是抗病性较弱的一个表现。

图2 染菌后甘薯硬度的变化Fig.2 Changes of hardness in sweet potato after infection
2.3 长喙壳菌侵染对不同抗性甘薯果胶含量的影响
果胶是细胞壁的重要组成物质,甘薯在贮藏期间,原果胶在果胶酶的作用下分解为可溶性果胶,细胞间失去黏结作用,甘薯组织变得松弛[10,21]。从图3a 可以看出,原果胶含量在贮藏期间呈现下降趋势,染菌处理具有加速作用,可溶性果胶质量分数则相反(图3b)。在贮藏期间,“心香”和“烟薯25”原果胶的质量分数分别降低了28.4%和23.7%;与对照组相比,甘薯“心香”染菌后原果胶胶质量分数的下降幅度大于“烟薯25”染菌后原果胶胶质量分数的下降幅度。在贮藏15 d 内,“心香”的原果胶质量分数降低了0.58%,相较于对照组的降低了45.64%;而染菌后“烟薯25”的下降幅度相对平缓,原果胶质量分数贮藏期间降低了0.27%,相较于对照组降低了40.26%,在一定程度上维持了甘薯硬度。染菌后“心香”和“烟薯25”可溶性果胶的质量分数分别上升了50.0%和82.3%,染菌后“心香”的可溶性果胶质量分数在贮藏期间显著高于对照组的,“烟薯25”的可溶性果胶质量分数略高于对照组的,贮藏期间相对稳定,抗性较高[10-12]。

图3 染菌后甘薯果胶物质质量分数的变化Fig.3 Changes of pectin content in sweet potato after infection
2.4 长喙壳菌侵染对不同抗性甘薯纤维素和木质素含量的影响
纤维素是细胞壁的构成骨架,木质素是细胞壁的主要组成部分,诸多研究发现,果蔬中纤维素和木质素的质量分数在采后贮藏期间显著增加[22-23]。
由图4a 可知,甘薯纤维素质量分数在贮藏期间呈先上升后下降的趋势,这可能是因病原菌侵染后,甘薯防御反应被启动[9],纤维素质量分数开始大幅度增加,以便抵抗微生物入侵,但后期发病逐渐严重,甘薯纤维素质量分数急剧下降,细胞壁破损严重。不同黑斑病抗性甘薯品种的纤维素质量分数差异极显著,在贮藏期间,对照组和染菌组“烟薯25”的纤维素质量分数比“心香”都显著提高;染菌后贮藏前期甘薯纤维素的质量分数显著高于对照组的,尤其是在贮藏前期9 d 内,染菌甘薯纤维素质量分数显著提高了13.4%~36.2%,“烟薯25”的增加幅度较大,中后期可能由于防御系统崩溃,染菌组纤维素质量分数下降较快,第15 天时均低于对照组。
木质素是细胞壁的组分,具有一定抗菌作用,能将细胞相连,与富含羟脯氨酸糖蛋白协同阻挡病原菌侵入,以维持细胞壁的完整性[24]。由图4b 可知,贮藏期间甘薯木质素质量分数呈现上升趋势,且染菌组高于对照组,贮藏期间染菌组甘薯木质素质量分数提高了21.2%~67.0%,中后期较为显著,这可能主要是因为染菌诱导甘薯产生了防御反应;“烟薯25”的木质素质量分数比“心香”的高出4.1%~22.3%,其中染菌组中“烟薯25”的木质素质量分数高于“心香”的,尤其是贮藏中后期差异更大,贮藏第15 天时,接种了长喙壳菌的“烟薯25”的木质素质量分数为6.2%,比同处理“心香”的高了24.8%,比对照组的高了50.6%。木质素一般通过苯丙烷途径合成,有利于抵抗生物和非生物的胁迫[25]。“烟薯25”的纤维素和木质素质量分数较高,表现为抗病性较强[10-11],冬枣感染黑斑病也有类似现象[26]。

图4 染菌后甘薯纤维素和木质素质量分数变化Fig.4 Changes of cellulose and lignin content in sweet potato after infection
2.5 长喙壳菌侵染对不同抗性甘薯纤维素酶活性的影响
纤维素酶(Cx)是纤维素分解为寡糖或单糖的降解酶。由图5a 可知,甘薯Cx 酶活性在贮藏期间呈先下降后上升的趋势,在第6 天时活性最低;染菌后甘薯品种“烟薯25”的Cx 酶活性显著小于“心香”的,在贮藏期间“烟薯25”的酶活性降低了3.6%~50.2%,抗性表现强[10-11];染菌后甘薯的Cx 酶活性显著高于对照组的,提高了4.3%~96.3%,主要是由于生物胁迫所致,染菌后“烟薯25”和“心香”的Cx 酶活性分别增加了2.5%~30.5%和4.7%~186.3%。
β-葡萄糖苷酶(β-Glu 酶)是Cx 中的关键组分,对纤维素的降解速率起重要作用。由图5b 可知,贮藏期间甘薯β-Glu 酶活性都呈现上升趋势,染菌后防御启动较Cx 快,染菌处理后上升迅速且显著增加;染菌后抗性较高品种“烟薯25”的酶活性比“心香”的增加速度和增加量都显著,随着贮藏时间差异逐渐加大,未染菌的两品种甘薯间则几乎没有差异。说明病变部位的β-Glu 酶活性上升速度快,且长喙壳菌抗性较高的品种的β-Glu 酶活性更高。

图5 染菌后甘薯纤维素酶和β-葡萄糖苷酶活性变化Fig.5 Changes of cellulase and β-glucosidase activities in sweet potato after infection
3 结语
细胞壁是果蔬细胞最基本细胞骨架,其组织结构对果蔬抵抗病原菌侵染具有很大的影响。研究结果表明,接种长喙壳菌15 d 后,“烟薯25”的黑斑病病斑表面直径、病斑内部直径、综合直径、病斑深度和腐烂指数均不同程度小于“心香”的,尤其是病斑内部直径、病斑深度和腐烂指数差异显著,甘薯品种“烟薯25”对长喙壳菌的抗性大于“心香”对长喙壳菌的抗性。同时发现,采后甘薯硬度逐渐下降,甘薯长喙壳菌侵染后会导致甘薯贮藏期间病变部位硬度下降,“烟薯25”的硬度显著高于“心香”的,且染菌后下降幅度较小。
果蔬硬度与细胞壁组成结构关系密切,对细胞壁的组成成分研究表明,甘薯采后呈现出原果胶含量开始逐渐降低,可溶性果胶逐渐增加,纤维素含量先增加后降低,木质素含量逐渐增加,纤维素酶先降低后增加,β-葡萄糖苷酶呈逐渐增加趋势。“烟薯25”原果胶和可溶性果胶的质量分数分别显著低于和高于“心香”品种的,且染菌和未染菌的“烟薯25”在贮藏期间的变化幅度均小于“心香”的,稳定性较好;贮藏期间,“烟薯25”的纤维素和木质素含量较高,纤维素酶的酶活性较低和β-葡萄糖苷的酶活性较高。染菌后甘薯病变组织的纤维素、木质素含量、纤维素酶和β-葡萄糖苷酶均显著增加,且“烟薯25”的纤维素、木质素含量、β-葡萄糖苷酶活性显著高于“心香”的,而纤维素酶活性则显著低于“心香”的。
综上所述,甘薯硬度、纤维素含量、木质素含量、果胶含量与黑斑病抗性具有正相关性,与纤维素酶活性呈负相关性。染菌后硬度、原果胶含量的稳定性对抗性也很重要,细胞壁的组成结构及其成分的具体影响规律及其调控机制还需要进一步研究。

